Διμεθυλοπροπάνιο
Το διμεθυλοπροπάνιο[1] (αγγλικά: dimethylpropane) είναι οργανική ένωση, που περιέχει άνθρακα και υδρογόνο, με μοριακό τύπο C5H12 και ημισυντακτικό τύπο (CH3)4C .Το χημικά καθαρό διμεθυλοπροπάνιο, στις συνηθισμένες συνθήκες, δηλαδή σε θερμοκρασία 20°C και υπό πίεση 1 atm, είναι εξαιρετικά εύφλεκτο αέριο, αλλά μπορεί να συμπυκνωθεί σε πολύ πτητικό υγρό, με ψυκτική παγίδα ή με συμπίεση, έχοντας κανονική θερμοκρασία βρασμού 9,5°C. Το διμεθυλοπροπάνιο είναι το απλούστερο αλκάνιο που περιέχει διπλή διακλάδωση και άρα τεταρτοταγές άτομο άνθρακα, δηλαδή ένα άτομο που συνδέεται με άλλα τέσσερα (4) άτομα άνθρακα. Με βάση το μοριακό του τύπο, C5H12, έχει δύο ισομερή θέσης: το πεντάνιο και το μεθυλοβουτάνιο. Παράγεται (συνήθως) από το πετρέλαιο και, όταν διαχωρίζεται από τη βενζίνη, χρησιμοποιείται κυρίως ως πρόδρομη ύλη στη χημική βιομηχανία. Είναι, όμως, και εξαιρετικό καύσιμο για βενζινοκινητήρες, εφόσον έχει αριθμό οκτανίων 100.
| Διμεθυλοπροπάνιο | |||
|---|---|---|---|

| |||
| |||

| |||
| |||
| Γενικά | |||
| Όνομα IUPAC | Διμεθυλοπροπάνιο | ||
| Άλλες ονομασίες | Νεοπεντάνιο Τετραμυθυλομεθάνιο | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | C5H12 | ||
| Μοριακή μάζα | 72,15 amu | ||
| Σύντομος συντακτικός τύπος |
C(CΗ3)4 | ||
| Συντομογραφίες | NpH, tBuMe, CMe4 | ||
| Αριθμός CAS | 463-82-1 | ||
| SMILES | CC(C)(C)C | ||
| Αριθμός EINECS | 207-343-7 | ||
| Ισομέρεια | |||
| Ισομερή θέσης | Πεντάνιο Μεθυλοβουτάνιο | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | −16,6°C | ||
| Σημείο βρασμού | 9,5°C | ||
| Πυκνότητα | 627 kg/m³ (υγρό στους 9,5°C) | ||
| Εμφάνιση | Άχρωμο αέριο | ||
| Χημικές ιδιότητες | |||
| Βαθμός οκτανίου | 80,2 | ||
| Ελάχιστη θερμοκρασία ανάφλεξης |
-7°C | ||
| Ενθαλπία σχηματισμού |
−168 kJ/mol | ||
| Επικινδυνότητα | |||
  
| |||
| Εξαιρετικά εύφλεκτο (F+), Επιβλαβές (Xn), Τοξικό για τους υδρόβιους οργανισμούς (N) | |||
| Φράσεις κινδύνου | 12, 51/53, 65, 66, 67 | ||
| Φράσεις ασφαλείας | 2, 9, 16, 29, 33, 61, 62 | ||
| MSDS | Σύνδεσμος MSDS | ||
| Κίνδυνοι κατά NFPA 704 |
|||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Ονοματολογία Επεξεργασία
Η ονομασία «διμεθυλοπροπάνιο» από την ονοματολογία κατά IUPAC. Συγκεκριμένα, το αρχικό πρόθεμα «διμεθυλο-»[2] δηλώνει την παρουσία δύο (2) όμοιων διακλαδώσεων («δι-») ενός (1) ατόμου άνθρακα («-μεθυλο-»), το τμήμα «προπ-» δηλώνει την παρουσία τριών (3) ατόμων άνθρακα στην κύρια ανθρακική αλυσίδα της ένωσης, το ενδιάμεσο «-αν-» δείχνει την παρουσία μόνο απλών δεσμών μεταξύ ατόμων άνθρακα στο μόριο και η κατάληξη «-ιο» φανερώνει ότι δεν περιέχει χαρακτηριστικές ομάδες, δηλαδή ότι είναι υδρογονάνθρακας. Το αλκύλιο που παράγεται από την αφαίρεση ενός ατόμου υδρογόνου από το διμεθυλοπροπάνιο ονομάζεται νεοπεντύλιο [(CH3)3CCH2-], με συντομογραφία Np. Δηλαδή, το ίδιο το διμεθυλοπροπάνιο μπορεί να συμβολιστεί και ως NpH.
Δομή Επεξεργασία
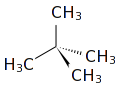
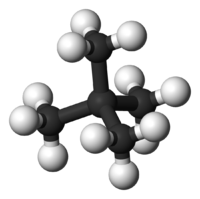
Το μόριό του αποτελείται από τέσσερα (4) άτομα άνθρακα (4 πρωτοταγή[3] και ένα τεταρτοταγές[4])) και δέκα (10) άτομα υδρογόνου. Δομικά, το κάθε ακραίο άτομο άνθρακα βρίσκεται στο κέντρο ενός τετραέδρου και τα τρία (3) άτομα υδρογόνου και το έτερο άτομο άνθρακα στις κορυφές του. Για τα κεντρικό άτομο άνθρακα, η διαφορά είναι ότι είναι συνδεμένο με ένα (1) άτομο υδρογόνου και τρία (3) άτομα άνθρακα Οι δεσμοί C-Η που σχηματίζονται είναι ελαφρά πολωμένοι (~3%) ομοιοπολικοί τύπου σ (2sp3-1s), με μήκος 108,7 pm. Ο δεσμός C-C είναι ομοιοπολικός τύπου σ (2sp3-2sp3), με μήκος 154 pm. Οι δε γωνίες είναι περίπου 109° 28΄.
| Δεσμοί[5] | ||||
| Δεσμός | τύπος δεσμού | ηλεκτρονική δομή | Μήκος δεσμού | Ιονισμός |
|---|---|---|---|---|
| C-H | σ | 2sp3-1s | 109 pm | 3% C- H+ |
| C-C | σ | 2sp3-2sp3 | 154 pm | |
| Κατανομή φορτίων σε ουδέτερο μόριο | ||||
| C#1,#3,#1',#1'' | -0,09 | |||
| C#2 | -0,00 | |||
| H | +0,03 | |||
Παραγωγή Επεξεργασία
Απομόνωση από φυσικές και βιομηχανικές πηγές Επεξεργασία
- Απομονώνεται από το πετρέλαιο.
- Απομονώνεται από μίγματα που προκύπτουν από πυρόλυση βαρύτερων προϊόντων διύλισης πετρελαίου ή πολυμερών υδρογονανθράκων.
Παραγωγή με αντιδράσεις σύνθεσης Επεξεργασία
1. Δομικά το ισοπεντάνιο αποτελείται από δυο μέρη: τ.βουτύλιο ((CH3)3C-) και μεθύλιο (CH3-). Επομένως, ο απλούστερος τρόπος παρασκευής καθαρού νεοπεντανίου είναι η αντίδραση ζεύγους τ.βουτυλολογονιδίου - μεθυλολιθίου ή τ.βουτυλολιθίου - μεθυλαλογονιδίου[6]:
ή
όπου X οποιοδήποτε αλογόνο, αλλά συνήθως χρησιμοποιείται το Br.
2. Αν επιχειρηθεί η ανάλογη αντίδραση Wurtz το αποτέλεσμα είναι ένα μίγμα προϊόντων[7]:
- Οι ρίζες των τ. βουτυλίων δεν ενώνονται μεταξύ τους λόγω στερεοχημικής παρεμπόδισης.
- Η αντίδραση είναι ασύμφορη σε σχέση με την προηγούμενη, αλλά τα προϊόντα αυτά διαχωρίζονται εύκολα: Το βαρύτερο είναι το ζητούμενο (εδώ) νεοπεντάνιο με σ.ζ.: 9,5 °C ενώ του αιθάνιου με σ.ζ.: -88,6 °C.
Παραγωγή με αντιδράσεις χωρίς αλλαγή ανθρακικής αλυσίδας Επεξεργασία
Με αναγωγή αλογονούχων ενώσεων Επεξεργασία
1. Με «υδρογόνο εν τω γεννάσθαι», δηλαδή μέταλλο + οξύ[8]:
2. Με LiAlH4 ή NaBH4[9]:
3. Με αναγωγή νεοπεντυλοϊωδίδιου[10]:
4. Με αναγωγή από σιλάνιο, παρουσία τριφθοριούχου βορίου παράγεται μεθυλοβουτάνιo[11]:
5. Αναγωγή από ένα αλκυλοκασσιτεράνιο. Π.χ.[12]:
6. Με αναγωγή από μέταλλα και στη συνέχεια υδρόλυση των παραγόμενων οργανομεταλλικών ενώσεων:
Με αναγωγή οξυγονούχων ενώσεων Επεξεργασία
Με αναγωγή διμεθυλοπροπανάλης - Αντίδραση Wolf-Kishner[15]:
Με αναγωγή θειούχων ενώσεων Επεξεργασία
1. Με αναγωγή των κατάλληλων θειολών μπορεί να παραχθεί διμεθυλοπροπάνιο. Π.χ. από την αναγωγή της διμεθυλοπροπανοθειόλης (μέθοδος Raney)[16]:
2. Με αναγωγή των κατάλληλων θειεστέρων μπορεί να παραχθεί διμεθυλοπροπάνιο. Π.χ. από την αναγωγή του δινεοπεντυλοθειαιθέρα (μέθοδος Raney)[16]:
Παραγωγή με αντιδράσεις αποσύνθεσης με μείωση του μήκους της ανθρακικής αλυσίδας Επεξεργασία
- Με τη θέρμανση αλκαλικού διαλύματος 3,3-διμεθυλοβουτανικού οξέος [(CH3)3CCH2COOΗ][17]:
Φυσικές διότητες και ισομερή Επεξεργασία
Το νεοπεντάνιο είναι άχρωμο και εξαιρετικά εύφλεκτο αέριο το οποίο υγροποιείται εύκολα μόλις στους 9,5 °C. Ανήκει στην οικογένεια των αλκανίων και μάλιστα είναι ένα από τα μέλη που διατηρεί την εμπειρική του ονομασία ανεξάρτητα από τους κανόνες ονοματολογίας.
Το αέριο νεοπεντάνιο είναι βαρύτερο από τον αέρα (ειδικό βάρος ως προς τον αέρα 2,5) και γι' αυτό έχει την τάση να συγκεντρώνεται στο επίπεδο του εδάφους ή κάτω από αυτό ιδιαίτερα σε κλειστούς χώρους.
Είναι μία από τις τρεις ισομερείς μορφές του πεντανίου: το (κανονικό) n-πεντάνιο (CH3-(CH2)3-CH3) που είναι ένας γραμμικός υδρογονάνθρακας, το ισοπεντάνιο ή μεθυλοβουτάνιο (CH-(CH3)2-CH2-CH3) και το νεοπεντάνιο ή διμεθυλοπροπάνιο (C-(CH3)4). Τα ισομερή αυτά παρόλο που έχουν ίδιο χημικό τύπο και μοριακό βάρος, έχουν διαφορετικές δομές και διαφορετικές ιδιότητες.
Αναμιγνύεται πλήρως με υδρογονάνθρακες και αιθέρες, αλλά είναι αδιάλυτο στο νερό.
| Συντακτικός τύπος Δομή |
Όνομα IUPAC (ελληνική μορφή) Όνομα |
Μοριακό Βάρος |
Σημείο ζέσεως (°C, 1 atm) |
Κρίσιμη πίεση (atm) |
Κρίσιμη Θερμοκρασία (°C) |
| |
κ-πεντάνιο πεντάνιο |
72,149 | 36,06 | 33,25 | 196,50 |
| |
2-μεθυλοβουτάνιο ισοπεντάνιο |
72,149 | 27,84 | 33,37 | 187,24 |
| |
2,2-διμεθυλοπροπάνιο νεοπεντάνιο |
72,149 | 9,50 | 31,57 | 160,60 |
Χημικές ιδιότητες Επεξεργασία
Οξείδωση Επεξεργασία
1. Όπως όλα τα αλκάνια, το νεοπεντάνιο με περίσσεια οξυγόνου καίγεται προς διοξείδιο του άνθρακα και νερό[18]:
2. Παραγωγή υδραερίου:
3. Καταλυτική οξείδωση κυρίως προς νεοπεντανάλη
Αλογόνωση [22] Επεξεργασία
- Δραστικότητα των X2: F2 > Cl2 > Br2 > Ι2.
- Ανάλυση του μηχανισμού της χλωρίωσης του (CH3)4C:
- 1. Έναρξη: Παράγονται ελεύθερες ρίζες.
- Η απαιτούμενη ενέργεια προέρχεται από το υπεριώδες φως (UV) ή θερμότητα (Δ).
- 2. Διάδοση: Καταναλώνονται οι παλιές ελεύθερες ρίζες, σχηματίζοντας νέες.
- 3. Τερματισμός: Καταναλώνονται μεταξύ τους οι ελεύθερες ρίζες, κατά τη στατιστικά σπάνια περίπτωση της συνάντησής τους.
- Είναι όμως πρακτικά δύσκολο να σταματήσει η αντίδραση στην παραγωγή μονοααλογονιδίων.
- Αν χρησιμοποιηθούν ισομοριακές ποσότητες (CH3)4C και Χ2 θα παραχθεί μίγμα όλων των αλογονοπαραγώγων του (CH3)4C.
- Αν όμως χρησιμοποιηθει περίσσεια (CH3)4C, τότε η απόδοση τωμ μονοπαραγώγων αυξάνεται πολύ, λόγω της αύξησης της στατιστική πιθανότητας συνάντισης (CH3)4C με X. σε σχέση με την πιθανότητα συνάντισης μονοπαραγώγου και X., που μπορεί να οδηγήσει στην παραγωγή των υπόλοιπων X-παραγώγων.
Παρεμβολή καρβενίων Επεξεργασία
- Τα καρβένια (π.χ. [:CH2]) μπορούν παρεμβληθούν στους δεσμούς C-H, παράγοντας ένα (1) μόνο προϊόν. Π.χ., με μεθυλένιο [:CH2] παράγεται μόνο 2,2-διμεθυλοβουτάνιο[24]:
Νίτρωση Επεξεργασία
Καταλυτική ισομερείωση Επεξεργασία
Το νεοπεντάνιο μπορεί να υποστεί καταλυτική ισομερείωση προς πεντάνιο ή ισοπεντάνιο:
Εφαρμογή Επεξεργασία
Το νεοπεντάνιο χρησιμοποιείται κυρίως ως πρόδρομη ύλη στη χημική βιομηχανία για την παραγωγή του ισοβουτυλένιου, από το οποίο στη συνέχεια παράγεται το καουτσούκ. Επίσης χρησιμοποιείται για την σύνθεση και άλλων οργανικών ενώσεων.
Ασφάλεια - υγεία Επεξεργασία
Το νεοπεντάνιο είναι ένα εξαιρετικά εύφλεκτο υλικό το οποίο πρέπει να αποθηκεύεται σε καλά αεριζόμενο μέρος και μακριά από πηγές ανάφλεξης. Είναι τοξικό για τους υδρόβιους οργανισμούς και πρέπει να αποφεύγεται η απελευθέρωσή στο περιβάλλον ή στην αποχέτευση.
Αναφορές και σημειώσεις Επεξεργασία
- ↑ Για εναλλακτικές ονομασίες δείτε τον πίνακα πληροφοριών.
- ↑ Οι αριθμοί θέσης (2,2-) των διακλαδώσεων παραλείπεται, επειδή δεν υπάρχει άλλο διμεθυλοπροπάνιο.
- ↑ Άτομο C ενωμένο με ένα άλλο άτομο C.
- ↑ Άτομο C ενωμένο με τέσσερα άλλα άτομα C.
- ↑ Τα δεδομένα προέρχονται εν μέρει από το «Table of periodic properties of thw Ellements», Sagrent-Welch Scientidic Company και Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, Σελ. 34.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 187, §7.3.5
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.2.2β, R = CH3, R' = (CH3)3CH
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.2.1β., με R = (CH3)3CCH2
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, §6.2.1α., με R = (CH3)3CCH2
- ↑ Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991, σελ.14, §1.1
- ↑ Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991, σελ. 291-293, §19.1.
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, Σελ. 42, §4.3.
- ↑ Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991, σελ.80-82, §5.1-5.2
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.2.4α., με R = (CH3)3CCH2
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.7.6β.
- ↑ 16,0 16,1 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.269, §11.6B7.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.2.3α., με R = (CH3)3CCH2
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 155, §6.7.1, v = 5 και μετατροπή μονάδας ενέργειας σε kJ.
- ↑ ΔHC-C= +347 kJ/mol
- ↑ ΔHC-H = +415 kJ/mol
- ↑ ΔHO-O=+146 kJ/mol
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.7.1β., με R = (CH3)3CCH2
- ↑ καθοριστικό ταχύτητας
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 155, §6.7.3, R = (CH3)3CCH2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 244 , §10.3.2, R = (CH3)3CCH2
Πηγές Επεξεργασία
- Η σελίδα της Ε.Ε. για την ταξινόμηση και την επισήμανση των επικίνδυνων ουσιών.
- Τεχνικό δελτίο δεδομένων για το νεοπεντάνιο
- Παπαγεωργίου Β.Π., Εφαρμοσμένη Οργανική Χημεία: Άκυκλες ενώσεις, Εκδόσεις Παρατηρητής, Θεσσαλονίκη 1986.
- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, Χημεία Οργανικών Ενώσεων, Παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
Σημ.: Μερικές από τις ενέργειες αντιδράσεων υπολογίστηκαν με χρήση κατάλληλου λογισμικού. Θα διασταυρωθούν και βιβλιογραφικά το συντομότερο για μεγαλύτερη ακρίβεια.
