Τυροσίνη
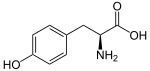
Η τυροσίνη[1] (συμβολισμός: Tyr ή Y) είναι ένα από τα 22 πρωτεϊνογόνα αμινοξέα. Στο επίπεδο της μοριακής γενετικής, τα κωδικόνιά της είναι UAC και UAU. Είναι ένα μη απαραίτητο αμινοξύ, με μια μη φορτισμένη αλλά πολική πλευρική ανθρακική αλυσίδα. Η λέξη «τυροσίνη» προέρχεται από την ελληνική τυρί, επειδή ανακαλύφθηκε για πρώτη φορά το 1846, από το Γερμανό χημικό Τζούστους βον Λίμπιγκ (Justus von Liebig), στην πρωτεΐνη καζεΐνη από τυρί[2][3]. Αντιστοίχως, όταν χρειάζεται αναφορά ειδικά στην πλευρική της αλυσίδα, η τελευταία ονομάζεται «τυροσυλ-».
| Τυροσίνη | |
|---|---|
| |

| |
| Γενικά | |
| Όνομα IUPAC | Τυροσίνη 2-αμινο-3-(4-υδροξυφαινυλο)προπανοϊκό οξύ |
| Χημικά αναγνωριστικά | |
| Χημικός τύπος | C9H11NO3 |
| Μοριακή μάζα | 181,19 amu |
| Συντομογραφίες | tyr ή Y |
| Αριθμός CAS | 60-18-4 (L) |
| SMILES | N[C@@H](Cc1ccc(O)cc1)C(O)=O |
| InChI | 1S/C9H11NO3/c10-8(9(12)13)5-6-1-3-7(11)4-2-6/h1-4,8,11H,5,10H2,(H,12,13)/t8-/m0/s1 Κλειδί: OUYCCCASQSFEME-QMMMGPOBSA-N |
| PubChem CID | 1153 |
| ChemSpider ID | 5833 |
| Φυσικές ιδιότητες | |
| Χημικές ιδιότητες | |
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |
Διαιτητικές πηγές Επεξεργασία
Η τυροσίνη μπορεί να συνθεθεί στο ανθρώπινο σώμα από τη φαινυλαλανίνη, που βρίσκεται σε πολλά υψηλής συγκέντρωσης σε πρωτεΐνες τροφικά προϊόντα όπως κοτόπουλο, γαλοπούλα, ψάρι, φυστίκια, αμύγδαλα, αβοκάντο, γάλα, τυρί, γιαούρτι, φασόλια, κολοκυθόσπορους, σουσάμι, μπανάνες, προϊόντα σόγιας[4] και ασπαρτάμη.
Βιοσύνθεση Επεξεργασία
Στα φυτά και στους περισσότερους μικροοργανισμούς η τυροσίνη παράγεται μέσω προφαινικού οξέος, ενός ενδιάμεσου παραγώγου της μεταβολικής οδού του σικιμικού οξέος. Το προφαινικό οξύ υφίσταται οξειδωτική αποκαρβοξυλίωση με την κατακράτηση της υδροξυλομάδας για να δώσει 4-υδροξυφαινυλοπυροσταφυλικό οξύ, που τρανσαμινώνεται με τη χρήση γλουτινικού οξέος ως πηγής αζώτου, δίνοντας τελικά τυροσίνη και α-κετογλουταμικό οξύ.
Τα θηλαστικά συνθέτουν την τυροσίνη από το απαραίτητο αμινοξύ φαινυλαλανίνη, που παραλαμβάνεται απευθείας από την τροφή. Η μετατροπή φαινυλαλανίνης σε τυροσίνη καταλύεται από το ένζυμο υδροξυλάση της φαινυλαλανίνης, μια μονοξυγενάση. Αυτό το ένζυμο καταλύει την αντίδραση προκαλώντας την προσθήκη μιας υδροξυλομάδας στη θέση #4 του αρωματικού δακτυλίου της φαινυλαλανίνης, που έτσι μετατρέπεται σε τυροσίνη.
Λειτουργικότητα Επεξεργασία
Εκτός από το ότι είναι ένα πρωτεϊνικό αμινοξύ, η τυροσίνη έχει και έναν ειδικό ρόλο επειδή περιέχει μια φαινολική λειτουργική ομάδα. Βρίσκεται σε πρωτεΐνες που συμμετέχουν σε διεργασίες «μετάφρασης» σήματος. Λειτουργεί ως ένας αποδέκτης φωσφορικών ομάδων που μετακινούνται από κινάσες. Η φωσφορυλίωση της υδροξυλομάδας μεταβάλλει τη δραστικότητα των πρωτεϊνών - στόχων.
Η τυροσίνη είναι πρόδρομη ένωση της μελανίνης, χρωστικής του δέρματος που παράγεται από το ένζυμο τυροσινάση.
Λόγω της ικανότητάς της να συμμετέχει σε αντιδράσεις μεταφοράς ηλεκτρονίων, η τυροσίνη παίζει σημαντικό ρόλο στη φωτοσύνθεση. Στο ένζυμο φωτοσύστημα ΙΙ των φωτοσυνθετικών οργανισμών (φυτά, φύκη και κυανοβακτήρια), μια συγκεκριμένη τυροσίνη (η Tyr161 της πρωτεϊνικής αλυσίδας D1) δρα ως δότης ηλεκτρονίου στην αναγωγή του φωτο-οξειδωμένου συμπλέγματος χλωροφυλλών γνωστού ως P680.[5] Σ'αυτήν τη διεργασία συμβαίνει αποπρωτονίωση της φαινολικής υδροξυλομάδας. Η παραγόμενη ρίζα τυροσίνης στη συνέχεια ανάγεται από τα 4 ιόντα μαγγανίου που απαρτίζουν το σύμπλοκο οξείδωσης του νερού (Mn4CaO5).
Αναφορές και σημειώσεις Επεξεργασία
- ↑ Δείτε τις εναλλακτικές ονομασίες και επίσημες συντομογραφίες στον παρακείμενο πίνακα πληροφοριών χημικής ένωσης.
- ↑ Tyrosine". The Columbia Electronic Encyclopedia, 6th ed. Infoplease.com — Columbia University Press. 2007. Retrieved 2008-04-20.
- ↑ Douglas Harper (2001). "Tyrosine". Online Etymology Dictionary. Retrieved 2008-04-20.
- ↑ Tyrosine". University of Maryland Medical Center. Retrieved 2011-03-17.
- ↑ S. Styring, J. Sjöholm, F. Mamedov (2012). «Two tyrosines that changed the world: Interfacing the oxidizing power of photochemistry to water splitting in photosystem II». Biochim. Biophys. Acta Bioenerg. 1817: 76-87.
| Αυτό το λήμμα σχετικά με τη βιοχημεία χρειάζεται επέκταση. Μπορείτε να βοηθήσετε την Βικιπαίδεια επεκτείνοντάς το. |