Ηλεκτροχημικό στοιχείο
Ηλεκτροχημικό στοιχείο είναι μια συσκευή που είναι ικανή είτε να παραγάγει ηλεκτρική ενέργεια από ηλεκτροχημικές αντιδράσεις ή να διευκολύνει χημικές αντιδράσεις μέσω της εισαγωγής ηλεκτρικής ενέργειας. Ένα συνηθισμένο παράδειγμα ηλεκτροχημικού στοιχείου είναι μια τυπική μπαταρία 1,5 - volt[1] που προορίζεται για απλή κατανάλωση. Αυτός ο τύπος συσκευής είναι γνωστός ως μοναδικό γαλβανικό στοιχείο (galvanic cell). Μια μπαταρία αποτελείται από ένα ή περισσότερα στοιχεία, συνδεμένα με παράλληλη διάταξη ή σε σειρά.[2]
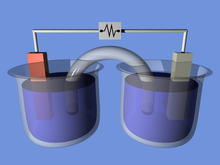
Ημιστοιχεία Επεξεργασία
Ένα ηλεκτροχημικό στοιχείο αποτελείται από δύο ημιστοιχεία. Κάθε ημιστοιχείο αποτελείται από ηλεκτρόδιο και ηλεκτρολύτη. Τα δύο ημιστοιχεία μπορεί να χρησιμοποιούν τον ίδιο ηλεκτρολύτη, ή μπορούν να χρησιμοποιούν διαφορετικούς ηλεκτρολύτες. Οι χημικές αντιδράσεις στο στοιχείο μπορεί να περιλαμβάνουν τον ηλεκτρολύτη, τα ηλεκτρόδια, ή μια εξωτερική ουσία (όπως στις κυψέλες καυσίμου που μπορούν να χρησιμοποιούν αέριο υδρογόνο ως αντιδρόν). Σε πλήρες ηλεκτροχημικό στοιχείο, ουσίες από το ένα ημιστοιχείο χάνουν ηλεκτρόνια (οξείδωση) στο ηλεκτρόδιό τους, ενώ ουσίες από το άλλο ημιστοιχείο κερδίζουν ηλεκτρόνια (αναγωγή) από το ηλεκτρόδιό τους.
Συχνά, χρησιμοποιείται γέφυρα άλατος (π.χ., χαρτί φίλτρου εμβαπτισμένο σε KNO3, NaCl, ή κάποιον άλλο ηλεκτρολύτη) για να δώσει την ιονική επαφή μεταξύ των δύο ημιστοιχείων με διαφορετικούς ηλεκτρολύτες, ωστόσο αποτρέπει τα διαλύματα από ανάμειξη και την πρόκληση ανεπιθύμητων παράπλευρων αντιδράσεων. Μια εναλλακτική προς γέφυρα άλατος είναι να επιτραπεί η άμεση επαφή (και ανάμειξη) μεταξύ των δύο ημιστοιχείων, παραδείγματος χάρη στην απλή ηλεκτρόλυση του νερού.
Καθώς τα ηλεκτρόνια ρέουν από ένα ημιστοιχείο στο άλλο μέσω εξωτερικού κυκλώματος, δημιουργείται διαφορά φορτίου. Εάν δεν δοθεί ιονική επαφή, αυτή η διαφορά φορτίου θα απέτρεπε γρήγορα την παραπέρα ροή των ηλεκτρονίων. Η γέφυρα άλατος επιτρέπει τη ροή αρνητικών ή θετικών ιόντων να διατηρεί σταθερή κατάσταση κατανομής φορτίου μεταξύ των δοχείων οξείδωσης και αναγωγής, ενώ κρατά τα περιεχόμενα κατά τα άλλα ξεχωριστά. Άλλες διατάξεις επίτευξης του διαχωρισμού των διαλυμάτων είναι πορώδη δοχεία και διαλύματα γέλης. Πορώδες δοχείο χρησιμοποιείται στο στοιχείο Μπούνσεν (δεξιά).
Αντίδραση ισορροπίας Επεξεργασία
Κάθε ημιστοιχείο έχει χαρακτηριστική τάση. Διάφορες επιλογές ουσιών για κάθε ημιστοιχείο δίνουν διαφορετικές διαφορές δυναμικού. Κάθε αντίδραση υφίσταται μια αντίδραση ισορροπίας μεταξύ διαφορετικών αριθμών οξείδωσης των ιόντων: Όταν επιτευχθεί ισορροπία, το στοιχείο δεν μπορεί να δώσει παραπέρα τάση. Στο ημιστοιχείο που υφίσταται οξείδωση, όσο πιο κοντά στην ισορροπία βρίσκεται το ιόν/άτομο με τον πιο θετικό αριθμό οξείδωσης, τόσο πιο πολύ δυναμικό θα δώσει η αντίδραση. Παρομοίως, στην αντίδραση αναγωγής, όσο πιο κοντά βρίσκεται η ισορροπία προς το ιόν/άτομο με τον πιο αρνητικό αριθμό οξείδωσης, τόσο πιο υψηλό το δυναμικό.
Δυναμικό στοιχείου Επεξεργασία
Το δυναμικό του στοιχείου μπορεί να προβλεφθεί μέσω της χρήσης των δυναμικών ηλεκτροδίου (electrode potentials) (τις τάσεις κάθε ημιστοιχείου). Αυτά τα δυναμικά ημιστοιχείου καθορίζονται σχετικά ως προς την εκχώρηση των 0 volts στο πρότυπο ηλεκτρόδιο υδρογόνου (standard hydrogen electrode ή SHE). Η διαφορά στην τάση μεταξύ των δυναμικών ηλεκτροδίων δίνει πρόβλεψη για το μετρούμενο δυναμικό. Κατά τον υπολογισμό της διαφορά στην τάση, θα πρέπει να ξαναγραφτούν οι εξισώσεις αντίδρασης του ημιστοιχείου για να πάρει μια εξισορροπημένη εξίσωση οξείδωσης-αναγωγής.
- Αντιστρέψτε την αντίδραση αναγωγής με το πιο μικρό δυναμικό (για να δημιουργήσετε μια αντίδραση με θετικό δυναμικό στοιχείου)
- Οι ημιαντιδράσεις πρέπει να πολλαπλασιάζονται με ακεραίους για να επιτευχθεί ισορροπία ηλεκτρονίων.
Σημειώστε ότι το δυναμικό στοιχείου δεν αλλάζει, όταν η αντίδραση πολλαπλασιάζεται με σταθερά.
Τα δυναμικά στοιχείου έχουν δυνατό εύρος από περίπου 0 έως 6 βολτ. Τα στοιχεία που χρησιμοποιούν ηλεκτρολύτες με βάση το νερό περιορίζονται συνήθως σε δυναμικά στοιχείων λιγότερο από 2,5 βολτ, επειδή τα πολύ ισχυρά οξειδωτικά και αναγωγικά μέσα που απαιτούνται για να παραγάγουν υψηλότερο δυναμικό τείνουν να αντιδρούν με το νερό. Υψηλότερα δυναμικά στοιχείου είναι εφικτά με στοιχεία που χρησιμοποιούν άλλους διαλύτες αντί για νερό. Παραδείγματος χάρη, υπάρχουν διαθέσιμα στοιχεία λιθίου με τάση 3 βολτ.
Το δυναμικό του στοιχείου εξαρτάται από τη συγκέντρωση των αντιδρώντων, καθώς και από τον τύπο τους. Καθώς το στοιχείο εκφορτίζεται, η συγκέντρωση των αντιδρώντων μειώνεται και το δυναμικό του στοιχείου μειώνεται επίσης.
Παραπομπές Επεξεργασία
- ↑ «Byjus ( a tutorial site)».
- ↑ «Electrochemical Cells». hyperphysics.phy-astr.gsu.edu.