Σιλάνιο
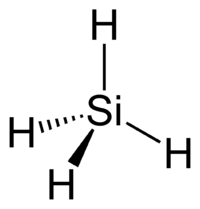
Το (μονο)σιλάνιο[1] (αγγλικά: silane) είναι ανόργανη δυαδική[2] χημική ένωση με μοριακό τύπο SiH4. Θεωρείται ότι είναι το πυριτιούχο ανάλογο του μεθανίου και φυσικά ταυτόχρονα είναι ένα από τα υδρίδια των στοιχείων της ομάδας 14. Το χημικά καθαρό σιλάνιο, στις κανονικές συνθήκες περιβάλλοντος, δηλαδή σε θερμοκρασία 25°C και υπό πίεση 1 atm, είναι άχρωμο τοξικό, εξαιρετικά εύφλεκτο αέριο, με έντονη, απωθητική οσμή, που μοιάζει κάπως με αυτήν του αιθανικού οξέος[3]. Από πρακτικής άποψης, το σιλάνιο ενδιαφέρει ως πρόδρομη ένωση για την παραγωγή (καθαρού) στοιχειακού πυριτίου. Το 1857, οι Γερμανοί χημικοί Χάινριχ Μπουφ (Heinrich Buff) και Φρήντριχ Βέλερ (Friedrich Wöhler) ανακάλυψαν το σιλάνιο ανάμεσα στα συστατικά που παράχθηκαν από την επίδραση υδροχλωρικού οξέος (HCl) σε πυριτιούχο αργίλιο (Al4Si3), που οι ίδιοι είχαν προηγουμένως παρασκευάσει. Ονόμασαν την (νέα τότε) ένωση siliciuretted hydrogen (που μπορεί να μεταφραστεί στα ελληνικά ως «πυριτιομένο υδρογόνο»)[4][5]. Το σιλάνιο είναι αναγωγικό μέσο[6], εφόσον περιέχει υδρογόνο στην οξειδωτική βαθμίδα -1.
| Σιλάνιο | |
|---|---|
| |

| |
| Γενικά | |
| Όνομα IUPAC | Σιλάνιο |
| Άλλες ονομασίες | Μονοσιλάνιο Σιλικάνιο Τετραϋδρίδιο του πυριτίου |
| Χημικά αναγνωριστικά | |
| Χημικός τύπος | SiH4 |
| Μοριακή μάζα | 32,12 amu |
| Αριθμός CAS | 7803-62-5 |
| SMILES | [SiH4] |
| Αριθμός EINECS | 231-635-3 |
| Αριθμός RTECS | VV1400000 |
| Αριθμός UN | 2203 |
| Δομή | |
| Μήκος δεσμού | 143 pm |
| Είδος δεσμού | ομοιοπολικός σ (1s-3sp³) |
| Πόλωση δεσμού | 3% (Si+H-) |
| Γωνία δεσμού | 109°28' |
| Μοριακή γεωμετρία | τετραεδρική |
| Φυσικές ιδιότητες | |
| Σημείο τήξης | −185 °C |
| Σημείο βρασμού | −112 °C |
| Πυκνότητα | 1,342 kg/m³ |
| Διαλυτότητα στο νερό |
Αδιάλυτο με αργή υδρόλυση |
| Εμφάνιση | Αέριο |
| Χημικές ιδιότητες | |
| Σημείο αυτανάφλεξης | 21 °C |
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |
Ακόμη, η έννοια σιλάνιο, μπορεί να επίσης να αναφέρεται ευρύτερα σε μια μεγάλη ομάδα ανόργανων και οργανικών ενώσεων που επίσης περιέχουν πυρίτιο, όπως το τριχλωροσιλάνιο (SiHCl3), το τετραμεθυλοσιλάνιο [Si(CH3)4] και το τετραιθοξυσιλάνιο [Si(CH3CH2Ο)4].
Δομή Επεξεργασία
Η τετραεδρική μοριακή δομή του ομοιάζει γεωμετρικά με αυτήν του μεθανίου. Ωστόσο, οι δεσμοί Si-Η είναι πολωμένοι κατά την έννοια Siδ+-Hδ-, δηλαδή αντίθετα από τους δεσμούς C-Η του μεθανίου, που είναι πολωμένοι κατά την έννοια Cδ--Hδ+, γιατί το πυρίτιο έχει μικρότερη ηλεκτραρνητικότητα (1,90 κατά Paouling) από το υδρογόνο (2,20 κατά Paouling), ενώ ο άνθρακας μεγαλύτερη (2,55 κατά Paouling) από το υδρογόνο.
Παραγωγή Επεξεργασία
1. Βιομηχανικά το σιλάνιο παράγεται συνήθως από μεταλλουργικού βαθμού καθαρότητας πυρίτιο (Si), σε δυο στάδια:
- 1. Με επίδραση υδροχλωρίου σε σκόνη πυριτίου, στους περίπου 300 °C παράγεται τριχλωροσιλάνιο (SiHCl3) και υδρογόνο:
- 2. Το τριχλωροσιλάνιο βράζεται μαζί με ρετσίνι, που περιέχει καταλύτη (συνήθως τριχλωριούχο αργίλιο, AlCl3), και μετατρέπεται σε σιλάνιο και τετραχλωροπυρίτιο (SiCl4):
- Συνήθως ως καταλύτες για αυτήν τη διεργασία χρησιμοποιούνται αλογονἰδια μετάλλων, ιδιαίτερα τριχλωριούχο αργίλιο (AlCl3). Αυτού του είδους η αντίδραση αναφέρεται ως αντίδραση ανακατανομής. Αποτελεί υποκατηγορία αντίδρασης διπλής αντικατάστασης που περιλαμβάνει το ίδιο κεντρικό στοιχείο. Μπορεί επίσης να θεωρηθεί ως αντίδραση δυσαναλογοποίησης, παρόλο που δεν υπάρχει μεταβολή στο βαθμό οξείδωσης του πυριτίου, που παραμένει +4 για όλα τα πυριτιούχα χημικά είδη που περιλαμβάνονται στην αντίδραση. Ωστόσο, η λειτουργικότητα του βαθμού οξείδωσης για μια ομοιοπολική ένωση, έστω και αν αυτή είναι πολωμένη, είναι αμφιλεγόμενη. Το άτομο του πυριτίου θα μπορούσε να αναλογοποιηθεί σαν να είχε τυπικά υψηλότερο βαθμό οξείδωσης στο SiCl4 και τυπικά χαμηλότερο βαθμό οξείδωσης στο SiH4, εφόσον το χλώριο είναι πολύ ηλεκτραρνητικότερο από το υδρογόνο.
2. Μια εναλλακτική βιομηχανική μέθοδος για την παραγωγή πολύ υψηλής καθαρότητας σιλανίου, κατάλληλου για την παραγωγή πυριτίου ημιαγωγικού βαθμού καθαρότητας, αρχίζει με πυρίτιο μεταλλουργικού βαθμού καθαρότητας, υδρογόνο και τετραχλωριούχο πυρίτιο και περιλαμβάνει μια πολύπλοκη σειρά αντιδράσεων ανακατανομής και αποστάξεις. Οι αντιδράσεις σε αυτήν τη μέθοδο συνοψίζονται στις παρακάτω στοιχειομετρικές εξισώσεις:
Τελικά, το σιλάνιο που παράγεται από αυτήν την παραγωγική οδό μπορεί απευθείας να διασπαστεί θερμικά, παράγοντας υψηλής καθαρότητας στοιχειακό πυρίτιο και υδρογόνο.
3. Με θέρμανση μείγματος άμμου (που αποτελείται κυρίως από διοξείδιο του πυριτίου, SiO2) με σκόνη μαγνησίου (Mg), παράγεται πυριτικό μαγνήσιο (MgSiO3):
Μετά, το σιλάνιο απελευθερώνεται με επίδραση διαλύματος 20% υδροχλωρικό οξύ (HCl).
- (Προσοχή: Το παραγόμενο σιλάνιο αναφλέγεται με τον ατμοσφαιρικό αέρα, δίνοντας μικροεκρήξεις)[10]:
4. Με αναγωγή πυριτιούχου μαγνησίου (Mg2Si) με υδροχλώριο (HCl):
5. Με θέρμανση τριαιθοξυσιλανίου [SiH(OC2H5)3] στους 80 °C, παρουσία μεταλλικού νατρίου (Na):
6. Με αναγωγή τετραχλωροπυρίτιου (SiCl4) από λιθιοαργιλιοϋδρίδιο (LiAlH4):
7. Με αναγωγή τετραχλωροπυρίτιου (SiCl4) από υδρίδιο του λιθίου (LiH):
- Μια παραλλαγή της παραπάνω, αποτελεί η αναγωγή του τετραφθοροπυρίτιου από υδρίδιο του νατρίου:
8. Με υδρόλυση πυριτιούχου αργιλίου[11]:
9. Με αναγωγή διοξειδίου του πυριτίου από αργίλιο και υδρογόνο[12]:
Φυσικοχημικές ιδιότητες, χημική συμπεριφορά και παράγωγα Επεξεργασία
Έχει ιδιαίτερα δυσάρετη οσμή[13]. Το σιλάνιο έχει αποδειχθεί πρόσφατα ότι συμπεριφέρεται ως υπεραγωγός υπό ιδιαίτερα υψηλή πίεση (96-120 GPa) και θερμοκρασία της τάξης των 17 Κ[14].
Το σιλάνιο αναφλέγεται εύκολα, σχηματίζοντας διοξείδιο του πυριτίου (SiO2) και νερό (H2O):
Επίσης ανάγει διάφορα αντιδραστήρια, όπως π.χ.:
- Το υπερμαγγανικό κάλιο (KMnO4) σε διοξείδιο του μαγγανίου.
- Τα ιόντα Hg2+ σε Hg+.
- Τα ιόντα Fe3+ σε Fe2+.
Το σιλάνιο είναι σταθερό σε ουδέτερο ή όξινο περιβάλλον, αλλά όχι και σε αλκαλικό:
Το σιλάνιο αντιδρά εκρηκτικά με τα αλογόνα, ακόμη και σε χαμηλές θερμοκρασίες, σχηματίζοντας αλογονοπαράγωγά του[15].
Απουσία οξυγόνου, διασπάται σε πυρίτιο και υδρογόνο σε θερμοκρασίες πάνω από 420 °C ή αν υποστεί πίεση πάνω από 50 atm:
Πυρηνόφιλη υποκατάσταση Επεξεργασία
Διάφορα πυρηνόφιλα (Nu-) αντιδραστήρια, διασπούν έναν από τους δεσμούς Si-H. Οι μηχανισμοί που επικρατούν είναι οι SN2 και SNi. Στην πρώτη περίπτωση σχηματίζεται ενδιάμεσο ασταθές προϊόν γενικού τύπου [SiH4Nu]- με υβριδισμό 3sp3d και δομή τριγωνικής διπυραμίδας, αφού το πυρίτιο μπορεί να αξιοποιεί και τα 3d τροχιακά του. Η γενική μορφή της πυρηνόφιλης υποκατάστασης σε σιλάνιο είναι η ακόλουθη:[16].
- Με ANu συμβολίζεται (γενικά) πυρηνόφιλο αντιδραστήριο.
- Ο ρόλος του BF3 είναι να σχηματίζει το ενδιάμεσο σύμπλοκο [ANu-BF] και διευκολύνει την ενεργοποίηση του ANu.
Σιλανόλη Επεξεργασία
1. Με επίδραση νερού (H2O) σε σιλάνιο παράγεται υδρογόνο και σιλανόλη
- A = H, Nu = OH.
2. Με επίδραση αλκοόλης (ROH) σε σιλάνιο παράγεται το αντίστοιχο στην αλκοόλη αλκάνιο (RH) και σιλανόλη
- A = R, Nu = OH.
Αλκοξυσιλάνιο Επεξεργασία
Με επίδραση αιθέρα (ROR) σε σιλάνιο παράγεται το αντίστοιχο στον αιθέρα αλκάνιο (RH) και αλκοξυσιλάνιο (SiH3OR)
- A = R, Nu = OR.
Αλκινυλοσιλάνιο Επεξεργασία
Με επίδραση αλκινίων (RC ≡ CH) σε σιλάνιο παράγεται υδρογόνο και αλκινυλοσιλάνιο (SiH3C ≡ CR)
- A = H, Nu = RC ≡ C.
Καρβαλκοξυσιλάνιο Επεξεργασία
Με επίδραση εστέρα (RCOOR) σε σιλάνιο παράγεται το αντίστοιχο στον εστέρα αλκάνιο (RH) και καρβαλκοξυσιλάνιο (SiH3OOCR, εστέρας της σιλανόλης)
- A = R, Nu = RCOO.
Σιλανονιτρίλιο Επεξεργασία
Με επίδραση νιτριλίων (RCN) σε σιλάνιο παράγεται το αντίστοιχο στο νιτρίλιο αλκάνιο (RH) και σιλανονιτρίλιο
- A = R, Nu = CN.
Αλκυλοσιλάνιο Επεξεργασία
Με επίδραση οργανομεταλλικών ενώσεων (π.χ RNa) σε σιλάνιο παράγεται το αντίστοιχο υδρίδιο (π.χ. NaH) και αλκυλοσιλάνιο (RSiH3)
- A = Na, Nu = R.
Μεθυλοσιλανοθειόλη Επεξεργασία
Με επίδραση θειόλης (RSH) σε σιλάνιο παράγεται το αντίστοιχο στη θειόλη αλκάνιο (RH) και σιλανοθειόλη
- A = R, Nu = SH.
Αλκυλοθειοσιλάνιο Επεξεργασία
Με επίδραση θειαιθέρα (RSR) σε σιλάνιο παράγεται το αντίστοιχο στο θειαιθέρα αλκάνιο (RH) και αλκυλοθειοσιλάνιο (SiH3SR)
- A = R, Nu = SR.
Σιλιλαλογονίδιο Επεξεργασία
Με επίδραση αλκυλαλογονίδιου (RX) σε σιλάνιο παράγεται το αντίστοιχο αλκάνιο (RH) και σιλυλαλογονίδιο (SiH3Χ)
- A = R, Nu = X.
Σιλαναμίνες Επεξεργασία
1. Με επίδραση αμμωνίας (NH3) σε σιλάνιο παράγεται υδρογόνο και σιλαναμίνη:
- A = H, Nu = NH2.
2. Με επίδραση πρωτοταγούς αμίνης (RNH2) σε οσιλάνιο παράγεται υδρογόνο και Ν-αλκυλοσιλαναμίνη (SiH3NHR):
- A = Η, Nu = RNH.
3. Με επίδραση δευτεροταγούς αμίνης (R2NH) σε σιλάνιο παράγεται υδρογόνο και Ν,N-διαλκυλοσιλαναμίνη (SiH3NR2):
- A = Η, Nu = R2N.
Με μεθυλένιο Επεξεργασία
Με επίδραση μεθυλενίου ([:CH2]) σε σιλάνιο παράγεται μεθυλοσιλάνιο[17]:
Εφαρμογές Επεξεργασία
Το σιλάνιο βρίσκει αρκετές βιομηχανικές και ιατρικές εφαρμογές. Για παράδειγμα, χρησιμοποιείται ως αντιδραστήριο για την προσαρμογή γυάλινων και πολυμερικών οπτικών ινών, σταθεροποιώντας το σύνθετο υλικό. Επίσης, χρησιμοποιείται ως βιοαδρανές υλικό σε εμφυτεύματα από τιτάνιο. Άλλη εφαρμογή του είναι η προστασία γκράφιτι από νερό[18]. Η βιομηχανία ημιαγωγών απορροφά περί τους 300 τόνους σιλανίου. Πιο πρόσφατα χρησιμοποιήθηκε στην κατασκευή χαμηλού κόστους φωτοβολταϊκών στοιχείων, μαζί με γυαλί και άμορφο πυρίτιο. Χρησιμοποιήθηκε, επί πλέον, σαν ενισχυτικό καυσίμου σε υπερηχητικά μαχητικά. Ακόμη, αποτελεί αντιδραστήριο για την Οργανική Χημεία και ειδικότερα για την Οργανομεταλλική Χημεία[19]. Επίσης χρησιμοποιείται στην οδοντιατρική για την για αύξηση αντοχής των δεσμών μεταξύ της ρητίνης και πορσελάνης ή της στεφάνης.
Θέματα ασφαλείας Επεξεργασία
Έχει αναφερθεί ένας αριθμός μοιραίων βιομηχανικών ατυχημάτων από ανάφλεξη σιλανίου στην ατμόσφαιρα.[20][21][22].
Αν υπάρξει διαρροή σιλανίου απελευθερώνεται ενέργεια, εξαιτίας της ανάφλεξής του, οδηγώντας σε επιταχυνόμενη αντίδραση καύσης, οπότε προκαλούνται πιθανές ζημιές από την εκτόνωση των παραγόμενων αερίων. Το σιλάνιο μπορεί να αυτοαναφλεγεί από τους 54 °C[23]:
Ο μηχανισμός της καύσης δίνει και άλλα επικίνδυνα παραπροϊόντα, που κάποια από αυτά διατηρούνται (προσωρινά) σε περίπτωση ατελούς καύσης:
Για «φτωχά» (σε σιλάνιο) μίγματα η αντίδραση καύσης προτάθηκε ότι διεξάγεται σε δυο (2) μόνο στάδια, που αποτελούνται από τις παραπάνω μερικές αντιδράσεις #2 και #5. Η παραγόμενη θερμότητα από την απόθεση του διοξειδίου του πυριτίου αυξάνει κι άλλο την ταχύτητα καύσης[24].
Μίγματα σιλανίου με (σχετικά) αδρανή αέρια, όπως το άζωτο ή το αργό, είναι ακόμη πιο πιθανό να αναφλεγούν, όταν έρθουν σε επαφή με τον αέρα, σε σχέση με το καθαρό σιλάνιο. Ακόμη και μείγμα 1% σιλανίου και 99% αζώτου αναφλέγεται εύκολα όταν εκτίθεται στον αέρα[25].
Αντίθετα από το μεθάνιο, το σιλάνιο είναι μέτρια τοξικό. Η θανατηφόρα συγκέντρωσή του (LD50) είναι 9.600 ppm, για τετράωρη έκθεση σ' αυτό. Επιπρόσθετα, όμως, κατά την επαφή με τα μάτια μπορεί να σχηματίσει πυριτικό οξύ, με αποτέλεσμα ερεθισμό.[26]. Στην Ιαπωνία, με σκοπό τη μείωση του κινδύνου από το σιλάνιο, κατά την παραγωγή άμορφου πυριτίου για φωτοβολταϊκά κύτταρα , αρκετές βιομηχανίες τους άρχισαν να χρησιμοποιούν διαλύματα σιλανίου και αερίου υδρογόνου. Αυτό έχει ως αποτέλεσμα ένα «συμβιωτικό πλεονέκτημα» που κάνει πιο σταθερά τα φωτοβολταϊκά κύτταρα, γιατί μειώνει το φαινόμενο Σταίμπλερ - Ρόνσκι (Staebler-Wronski Effect).
Σε ότι αφορά την επαγγελματική έκθεσης σιλανίου σε εργαζόμενους, το Εθνικό Ίδρυμα Επαγγελματικής Ασφάλειας και Υγείας των ΗΠΑ έχει θέσει ένα προτεινόμενο όριο έκθεσης 5 ppm (που αντιστοιχεί σε 7 mg/m³), για ένα μέσο όρο οκτώ (8) ωρών[27].
Παρατηρήσεις, υποσημειώσεις και αναφορές Επεξεργασία
- ↑ Για εναλλακτικές ονομασίες δείτε τον πίνακα πληροφοριών.
- ↑ Σημείωση: Αποτελείται από δύο (2) μόνο χημικά στοιχεία.
- ↑ CFC Startec properties of Silane. C-f-c.com. Retrieved on 2013-03-06.
- ↑ J. W. Mellor, "A Comprehensive Treatise on Inorganic and Theoretical Chemistry," Vol VI, Longmans, Green and Co. (1947), p. 216.
- ↑ Σημειώνεται ότι και το μεθάνιο μπορεί να παραχθεί, ομοίως, δηλαδή με υδρόλυση ανθρακαργίλιου (Al4C3), δηλαδή από την αντίστοιχη ανθρακούχα ένωση του πυριτιούχου αργιλίου.
- ↑ Shriver and Atkins. Inorganic Chemistry (5th Edition). W. H. Freeman and Company, New York, 2010, 358.
- ↑ Τα δεδομένα προέρχονται από τους πίνακες δεδομένων των στοιχείων άνθρακα, πυριτίου και υδρογόνου και τις πηγές«Table of periodic properties of thw Ellements», Sagrent-Welch Scientidic Company και «Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982»
- ↑ «chem.tamu.edu» (PDF). Αρχειοθετήθηκε από το πρωτότυπο (PDF) στις 28 Ιανουαρίου 2018.
- ↑ Υπολογισμένο βάση του ιονισμού από τον παραπάνω πίνακα
- ↑ Making Silicon from Sand Αρχειοθετήθηκε 2009-02-17 στο Wayback Machine., by Theodore Gray. Originally published in Popular Science magazine.
- ↑ Η μέθοδος της πρώτης παραγωγής από τους Heinrich Buff και Friedrich Wöhler
- ↑ Shriver and Atkins. Inorganic Chemistry (5th Edition). W. H. Freeman and Company, New York, 2010, pp 358.
- ↑ «CFC Startec properties of Silane». Αρχειοθετήθηκε από το πρωτότυπο στις 19 Μαρτίου 2008. Ανακτήθηκε στις 30 Σεπτεμβρίου 2009.
- ↑ M. I. Eremets, I. A. Trojan, S. A. Medvedev, J. S. Tse, Y. Yao (2008). «Superconductivity in Hydrogen Dominant Materials: Silane». Science 319 (5869): 1506–1509. doi:. PMID 18339933.
- ↑ Εξαρτάται από τις συνθήκες και τα αλογόνα το ποια ακριβώς παράγωγα θα σχηματιστούν.
- ↑ Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991, σελ. 291-293, §19.1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 155, §6.7.3.
- ↑ «Graffiti protection systems». Αρχειοθετήθηκε από το πρωτότυπο στις 9 Οκτωβρίου 2007. Ανακτήθηκε στις 8 Ιουνίου 2009.
- ↑ Reductions of organic compounds using silanes
- ↑ Chen, J. R. (2002). "Characteristics of fire and explosion in semiconductor fabrication processes". Process Safety Progress 21 (1): 19–25. doi:10.1002/prs.680210106.
- ↑ Chen, J. R.; Tsai, H. Y.; Chen, S. K.; Pan, H. R.; Hu, S. C.; Shen, C. C.; Kuan, C. M.; Lee, Y. C.; and Wu, C. C. (2006). "Analysis of a silane explosion in a photovoltaic fabrication plant". Process Safety Progress 25 (3): 237–244. doi:10.1002/prs.10136.
- ↑ Chang, Y. Y.; Peng, D. J.; Wu, H. C.; Tsaur, C. C.; Shen, C. C.; Tsai, H. Y.; and Chen, J. R. (2007). "Revisiting of a silane explosion in a photovoltaic fabrication plant". Process Safety Progress 26 (2): 155–158. doi:10.1002/prs.10194.
- ↑ «Διαδικτυακός τόπος voltaix.com, Mssi000_Silane.pdf». Αρχειοθετήθηκε από το πρωτότυπο στις 4 Μαρτίου 2016. Ανακτήθηκε στις 22 Δεκεμβρίου 2021.
- ↑ V.I Babushok (1998). "Numerical Study of Low and High Temperature Silane Combustion". The Combustion Institute. 27th Symposium: 2431–2439.
- ↑ Kondo, S.; Tokuhashi, K.; Nagai, H.; Iwasaka, M.; and Kaise, M. (1995). "Spontaneous Ignition Limits of Silane and Phosphine". Combustion and Flame 101 (1–2): 170–174. doi:10.1016/0010-2180(94)00175-R.
- ↑ See MSDS for silane| Διαδικτυακός τόπος vngas.com, g97.pdf MSDS for silane Αρχειοθετήθηκε 2009-02-20 στο Wayback Machine..
- ↑ "Silicon tetrahydride". NIOSH Pocket Guide to Chemical Hazards. Centers for Disease Control and Prevention. April 4, 2011. Retrieved November 18, 2013.