Τριμεθυλοφωσφίνη
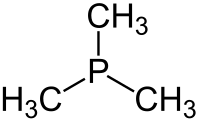
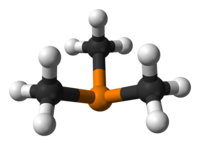
Η τριμεθυλοφωσφίνη[1] (αγγλικά: trimethylphosphine) είναι οργανική χημική ένωση, που περιέχει άνθρακα, υδρογόνο και φωσφόρο, με χημικό τύπο C3H9P. Eίναι η απλούστερη τριτοταγής (δηλαδή τριυποκατεστημένη) οργανική φωσφίνη. Είναι το φωσφορούχο ανάλογο της τριμεθυλαμίνης. Μπορεί να θεωρηθεί ότι προέρχεται από τη «μητρική» ένωση «φωσφίνη» (PH3), με αντικατάσταση όλων [δηλαδή και των τριών (3)] ατόμων υδρογόνου της τελευταίας από τρία (3) μεθύλια (CH3-). Η χημικά καθαρή τριμεθυλαμίνη, στις συνηθισμένες συνθήκες, δηλαδή σε θερμοκρασία 25°C και υπό πίεση 1 atm, είναι άχρωμο πυροφορικό (δηλαδή που αυτοαναφλέγεται εύκολα) και τοξικό υγρό. Με επίδρσση υποχλωριώδους νατρίου (NaClO) μπορεί να μετατραπεί σε μη πυροφορικό τριμεθυλοφωσφινοξείδιο [(CH3)3PO)]. Με βάση το χημικό τύπο της (C3H9P) έχει τρία (3) ισομερή θέσης:
- Προπυλοφωσφίνη, με σύντομο συντακτικό τύπο CH3CH2CH2PH2.
- Ισοπροπυλοφωσφίνη, με σύντομο συντακτικό τύπο CH3CH(PH2)CH3.
- Αιθυλομεθυλοφωσφίνη, με σύντομο συντακτικό τύπο CH3CH2PHCH3.
| Τριμεθυλοφωσφίνη | |||
|---|---|---|---|
| |||
| |||
| Γενικά | |||
| Όνομα IUPAC | Τριμεθυλοφωσφίνη | ||
| Άλλες ονομασίες | Τριμεθυλοφωσφαμίνη Τριμεθυλοφωσφίνη Τριμεθυλοφωσφάνιο μεθυλο-2-φωσφαπροπάνιο | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | C2H7P | ||
| Μοριακή μάζα | 76,07 | ||
| Σύντομος συντακτικός τύπος |
(CH3)3P | ||
| Συντομογραφίες | Me3P | ||
| Αριθμός CAS | 594-09-2 | ||
| SMILES | CP(C)C | ||
| Δομή | |||
| Διπολική ροπή | 1,19 D | ||
| Είδος δεσμού | σ (2sp3-3sp3, C-P) | ||
| Πόλωση δεσμού | 3% (C--P+) | ||
| Γωνία δεσμού | 118° (CPC) | ||
| Μοριακή γεωμετρία | τριγωνική πυραμιδική | ||
| Ισομέρεια | |||
| Ισομερή θέσης | 3 Προπανοφωσφαμίνη-1 Προπανοφωσφαμίνη-2 P-μεθυλαιθανοφωσφαμίνη | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | -86°C | ||
| Σημείο βρασμού | 38-39°C | ||
| Πυκνότητα | 735 kg/m3 | ||
| Διαλυτότητα στο νερό |
μικρή | ||
| Εμφάνιση | άχρωμο πυροφορικό υγρό | ||
| Χημικές ιδιότητες | |||
| Επικινδυνότητα | |||
| Φράσεις κινδύνου | 11-36/37/38 | ||
| Φράσεις ασφαλείας | 9-16-26-36/37/39 | ||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Ονοματολογία Επεξεργασία
- Η πρώτη προκύπτει αν η ένωση θεωρηθεί φωσφαμίνη (συστηματική ονομασία, δηλαδή αμίνη με φωσφόρο αντί άζωτο) άκυκλη με ένα (1) άτομα άνθρακα, χωρίς διπλό ή τριπλό δεσμό και δύο (2) επιπλέον μεθύλια συνδεμένο με το άτομο του φωσφόρου.
- Η δεύτερη προκύπτει αν η ένωση θεωρηθεί τριυποκατεστημένο, από τρία (3) συνολικά μεθύλια, φωσφάνιο (συστηματική ονομασία, PH3).
- Η τρίτη προκύπτει αν η ένωση θεωρηθεί τριυποκατεστημένο, από τρία (3) συνολικά μεθύλια, φωσφίνη (παλαιότερη, αλλά πολύ πιο συνηθισμένη ονομασία, PH3).
- Η τέταρτη είναι ονομασία που προκύπτει από την «ονοματολογία αντικαταστάσεως», δηλαδή μεθυλοπροπάνιο [(CH3)3CH] στο οποίο έχει αντικατασταθεί το #2 άτομο άνθρακα (C) με ένα άτομο φωσφόρου (P).
Παραγωγή Επεξεργασία
Με οργανομαγνησιακή ένωση Επεξεργασία
Με επίδραση μεθυλομαγνησιοβρωμίδιου (CH3MgBr) σε τριχλωριούχο φωσφόρο (PCl3) παράγεται τριμεθυλοφωσφίνη[2]:
Με μεθυλίωση διμεθυλοφωσφίνης Επεξεργασία
Με επίδραση διμεθυλοφωσφίνης (CH3PHCH3) σε μεθυλαλογονίδιο (CH3X) παράγεται τριμεθυλοφωσφίνη[3][4]:
Χημική συμπεριφορά και παράγωγα Επεξεργασία
Η τριμεθυλοφωσφίνη έχει έντονο πυρηνόφιλο χαρακτήρα, λόγω της μεγάλης επιδεκτικότητας πόλωσης του φωσφόρου[4].
Αλκυλίωση Επεξεργασία
Η αντίδραση με αλκυλαλογονίδια παράγεται τεταρτοταγές αλογονούχο αλκυλοτριμεθυλοφωσφώνιο {[RP(CH3)3]X}[3][4]:
Αναγωγικές ικανότητες Επεξεργασία
Γενικά, οι ενώσεις του τρισθενούς φωσφόρου, μπορούν να χρησιμοποιηθούν ως αναγωγικά μέσα, για να αφαιρέσουν οξυγόνο ή θείο από διάφορες ενώσεις. Μερικά σχετικά παραδείγματα είναι τα ακόλουθα[3][4]:
1. Αναγωγή θειοξειδίων (RSOR) σε θειαιθέρες (RSR):
2. Αναγωγή νιτρωδοαλκανίων (RNO) σε αμίνες (RNH2)
3. Αναγωγή οξιράνιου σε αιθένιο:
4. Αναγωγή θειιράνιου σε αιθένιο:
- Όπου τα R συμβολίζουν υδροκαρβύλια, και σε όποια ένωση αναφέρονται δύο από αυτά δεν είναι απαραίτητο να είναι ίδια μεταξύ τους.
Επίδραση μεθυλενίου Επεξεργασία
Με επίδραση μεθυλενίου ([:CH2]) σε τριμεθυλοφωσφίνη παράγεται αιθυλοδιμεθυλοφωσφίνη[5]:
Ενώσεις συναρμογής Επεξεργασία
Η τριμεθυλοφωσφίνη παράγει επίσης ένα μεγάλο αριθμό ενώσεων συναρμογής, συμπεριφερόμενη ως βάση κατά Lewis, με διάφορα μέταλλα. Π.χ. αντιδρά με τον πεντακαρβονυλοσίδηρο [Fe(CO)5], σχηματίζοντας τετρακαρβονυλοτριμεθυλοφωσφινοσίδηρο [Fe(CO)4P(CH3)3]:
Πηγές πληροφόρησης Επεξεργασία
- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
Παρατηρήσεις, υποσημειώσεις και αναφορές Επεξεργασία
- ↑ Για εναλλακτικές ονομασίες δείτε τον πίνακα πληροφοριών.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 267, §11.3Α1.
- ↑ 3,0 3,1 3,2 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.270, §11.7B.
- ↑ 4,0 4,1 4,2 4,3 Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991, §19.2, σελ. 294.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 155, §6.7.3.