1-βουτένιο
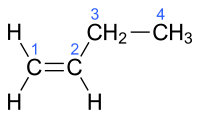
Το 1-βουτένιο[2] είναι οργανική χημική ένωση, που περιέχει άνθρακα και υδρογόνο, με χημικό τύπο C4H8 και σύντομο συντακτικό τύπο CH3CH2CH=CH2. Είναι μέλος της ομόλογης σειράς των αλκενίων, με τέσσερα (4) άτομα άνθρακα. Το χημικά καθαρό 1-βουτένιο, στις «συνηθισμένες συνθήκες», δηλαδή σε θερμοκρασία 25 °C και υπό πίεση 1 atm, είναι άχρωμο, άοσμο και εξαιρετικά εύφλεκτο αέριο. Στην εμπορική του μορφή είναι αναμεμειγμένο με ίχνη κάποιου οσμοθέτη, συνήθως κάποια θειόλη, η οποία του δίνει χαρακτηριστική οσμή και έτσι το κάνει εύκολα ανιχνεύσιμο ακόμα και σε πολύ μικρές συγκεντρώσεις, στην ατυχή περίπτωση διαρροής του.
| 1-βουτένιο | |||
|---|---|---|---|
| |||

| |||

| |||
| Γενικά | |||
| Όνομα IUPAC | 1-βουτένιο | ||
| Άλλες ονομασίες | α-Βουυλένιο Αιθυλοβινύλιο | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | C4H8 | ||
| Μοριακή μάζα | 56,11 amu | ||
| Σύντομος συντακτικός τύπος |
CH3CH2CH=CH2 | ||
| Συντομογραφίες | EtVi | ||
| Αριθμός CAS | 106-98-9 | ||
| SMILES | C=CCC | ||
| Δομή | |||
| Μοριακή γεωμετρία | Επίπεδη εκτός αιθύλιου. | ||
| Ισομέρεια | |||
| Ισομερή θέσης | 4 2-βουτένιο (CH3CH=CHCH3) Μεθυλοπροπένιο (CH3CH=C(CH3)2), Κυκλοβουτάνιο ( Μεθυλοκυκλοπροπάνιο ( | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | -185 °C | ||
| Σημείο βρασμού | -6,3 °C | ||
| Πυκνότητα | 2,37 kg/m3 | ||
| Εμφάνιση | Άχρωμο αέριο | ||
| Χημικές ιδιότητες | |||
| Θερμότητα πλήρους καύσης |
2628 kJ | ||
| Βαθμός οκτανίου | 98,8[1] | ||
| Επικινδυνότητα | |||

| |||
| Εξαιρετικά εύφλεκτο (F+) | |||
| Κίνδυνοι κατά NFPA 704 |
|||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Συνήθως μεταφέρεται και αποθηκεύεται σε υγρή μορφή υπό πίεση, γιατί έτσι καταλαμβάνει πολύ μικρότερο όγκο. Είναι πολύ λίγο διαλυτό στο νερό αλλά διαλύεται εύκολα στην αλκοόλη. Ανήκει στα λεγόμενα «υγραέρια».
Ισομέρεια Επεξεργασία
Με βάση χημικό τύπο του έχει 4 ισομερή θέσης (+ 1 γεωμετρικό ισομερές = 5 συνολικά ισομερή):
- 2-βουτένιο (β-βουτυλένιο, σε 2 γεωμερικά ισομερή).
- Μεθυλοπροπένιο (γ-βουτυλένιο).
- Κυκλοβουτάνιο.
- Μεθυλοκυκλοπροπάνιο.
Ονοματολογία Επεξεργασία
Η ονομασία «1-βουτένιο» προέρχεται από την ονοματολογία κατά IUPAC. Συγκεκριμένα, το πρόθεμα «βουτ-» δηλώνει την παρουσία τεσσάρων (4) ατόμων άνθρακα ανά μόριο της ένωσης, το ενδιάμεσο «-εν-» δείχνει την παρουσία ενός (1) διπλού δεσμού μεταξύ ατόμων άνθρακα στο μόριο και η κατάληξη «-ιο» φανερώνει ότι δεν περιέχει χαρακτηριστικές ομάδες, δηλαδή ότι είναι υδρογονάνθρακας. Τέλος τοποθετεί υποχρεωτικά στην αρχή ο αριθμός θέσης (1-) του διπλού δεσμού του, γιατί να γίνει διάκριση με το ισομερές 2-βουτένιο.
Δομή Επεξεργασία
Αυτός ο υδρογονάνθρακας έχει μόριο που αποτελείται από τρία (3) άτομα υδρογόνου και ένα αιθύλιο, ενωμένα με ένα ζεύγος ατόμων άνθρακα, που συνδέονται μεταξύ τους με ένα διπλό δεσμό. Όλα αυτά τα έξι (6) συνολικά άτομα [5 υδρογόνου + 3 άτομα άνθρακα (τα 2 με το διπλό δεσμό + το πρώτο από το αιθύλιο)] είναι ομοεπίπεδα. Η γωνία HCH είναι 119°, δηλαδή πολύ κοντά στις 120° που προβλέπονται για τον sp2 υβριδισμό των ατόμων άνθρακα, που συνδέονται με διπλό δεσμό. Η περιστροφή του δεσμού C=C απαιτεί (σχετικά) υψηλή ποσότητα ενέργειας, γιατί απαιτεί την (προσωρινή) διάσπαση του π-δεσμού.
Ο π-δεσμός στο μόριο του προπενίου είναι υπεύθυνος για τη χρήσιμη χημική δραστικότητά του. Ή περιοχή του διπλού δεσμού χαρακτηρίζεται από (σχετικά) υψηλή ηλεκτρονιακή πυκνότητα, που επομένως είναι ευάλωτη σε επιδράσεις ηλεκτρονιόφιλων. Πολλές αντιδράσεις του προπενίου καταλύνται από διάφορα μέταλλα μετάπτωσης, που σχηματίζουν προσωρινά σύμπλοκα με τα π και π* τροχιακά του προπενίου.
| Δεσμοί[3] | ||||
| Δεσμός | τύπος δεσμού | ηλεκτρονική δομή | Μήκος δεσμού | Ιονισμός |
|---|---|---|---|---|
| C#3,#4-H | σ | 2sp3-1s | 109 pm | 3% C- H+ |
| C#1,#2-H | σ | 2sp2-1s | 108,7 pm | 3% C- H+ |
| C#3-C#2 | σ | 2sp3-2sp2 | 151 pm | |
| C#3-C#4 | σ | 2sp3-2sp3 | 154 pm | |
| C=C | σ | 2sp2-2sp2 | 133,9 pm | |
| C=C | π | 2p-2p | 133,9 pm | |
| Κατανομή φορτίων σε ουδέτερο μόριο | ||||
| C#4 | -0,09 | |||
| C#1,#3 | -0,06 | |||
| C#2 | -0,03 | |||
| H | +0,03 | |||
Παραγωγή Επεξεργασία
Βιομηχανική μέθοδος Επεξεργασία
Το 1-βουτένιο παράγεται βιομηχανικά με τις ακόλουθες μεθόδους:
- Με το διαχωρισμό του από το κλάσμα C4 ενός διυλιστηρίου αργού πετρελαίου.
- Με διμερισμό αιθένιου. Μετά αποστάζεται για να ληφθεί με μεγαλύτερη καθαρότητα.
Με πυρόλυση αλκανίων Επεξεργασία
Με πυρόλυση αλκανίων παράγονται μίγματα που περιέχουν και 1-βουτένιο. Π.χ.:
Με αφυδάτωση αλκανολών Επεξεργασία
Με ενδομοριακή αφυδάτωση 1-βουτανόλης παράγεται 1-βουτένιο. Η αντίδραση ευνοείται σε σχετικά υψηηλές θερμοκρασίες, >150 °C[4]:
Με απόσπαση υδραλογόνου Επεξεργασία
Με απόσπαση υδραλογόνου (HX) από 1-αλοβουτάνιο παράγεται 1-βουτένιο:[5]:
Με απόσπαση αλογόνου Επεξεργασία
Με απόσπαση αλογόνου (X2) από 1,2-διαλοβουτάνιο παράγεται 1-βουτένιο[6]:
Με μερική καταλυτική υδρογόνωση Επεξεργασία
Με μερική καταλυτική υδρογόνωση 1-βουτινίου παράγεται 1-βουτένιο[7]:
Με καταλυτική αφυδρογόνωση αλκανίων Επεξεργασία
Με καταλυτική αφυδρογόνωση βουτανίου, παράγεται και 1-βουτένιο:
- Όπου .
Με θέρμανση τεταρτοταγών αμμωνιακών αλάτων Επεξεργασία
Με θέρμανση τεταρτοταγών αμμωνιακών αλάτων (μέθοδος Hoffmann) παράγεται και 1-βουτένιο. Π.χ[4].
Με επίδραση φωσφοροϋλιδίων σε καρβονυλικές ενώσεις Επεξεργασία
Με επίδραση φωσφοροϋλιδίου σε προπανάλη ή μεθανάλη (μέθοδος Wittig) παράγεται 1-βουτένιο. Π.χ.[8]:
ή
Χημική συμπεριφορά Επεξεργασία
Χημική σταθερότητα Επεξεργασία
Το 1-βουτένιο είναι χημικά σταθερό μόνο του, αλλά πολυμερίζεται εξωθερμικά. Είναι πολύ εύφλεκτο και γρήγορα σχηματίζει εκρηκτικά μίγματα με τον ατμοσφαιρικό αέρα. Είναι, ωστόσο, ασύμβατο με την παρουσία ορισμένων μεταλλικών αλάτων, αλογόνων, οξειδίων του αζώτου, τριφθοριούχου βορίου, υδραλογόνων και ισχυρών οξειδωτικών μέσων.
Τέλεια καύση Επεξεργασία
Ενυδάτωση Επεξεργασία
1. Επίδραση θειικού οξέος και στη συνέχεια νερού (ενυδάτωση). Παράγεται 2-βουτανόλη[9]:
2. Υδροβορίωση και στη συνέχεια επίδραση με υπεροξείδιο του υδρογόνου. Παράγεται βουτυλοβοράνιο και στη συνέχεια 1-βουτανόλη[10]:
- Προσθήκη διβορανίου έχει το ίδιο αποτέλεσμα.
3. Αντίδραση με οξικό υδράργυρο και έπειτα αναγωγή. Παράγεται 2-βουτανόλη:
4. Υπάρχει ακόμη η δυνατότητα αλλυλικής υδροξυλίωσης κατά Prins με επίδραση αλδευδών ή κετονών σε 1-βουτένιο απουσία νερού. Π.χ. με μεθανάλη προκύπτει 1-πεντεν-2-όλη:
Προσθήκη υποαλογονώδους οξέως Επεξεργασία
Με επίδραση (προσθήκη) υποαλογονώδους οξέος (HOX) σε 1-βουτένιο παράγεται 1-αλο-2-βουτανόλη[11]:
- Το HOX παράγεται συνήθως επιτόπου με την αντίδραση:
Καταλυτική υδρογόνωση Επεξεργασία
Με καταλυτική υδρογόνωση 1-βουτένιου σχηματίζεται βουτάνιο. Π.χ.[12]:
Αλογόνωση Επεξεργασία
1. Με προσθήκη αλογόνου (X2) (αλογόνωση) σε 1-βουτένιο έχουμε προσθήκη στο διπλό δεσμό. Παράγεται 1,2-διαλοβουτάνιο. Π.χ.[13]:
2. Υποκατάσταση σε αλλυλική θέση, δηλαδή σε α θέση ως προς το διπλό δεσμό. Παράγεται 3-αλο-βουτένιο-1: Π.χ.:
- Η αλλυλική υποκατάσταση ευνοείται με ορισμένα ειδικά αντιδραστήρια αλογόνωσης ή σε υψηλές θερμοκρασίες.
Υδραλογόνωση Επεξεργασία
Με προσθήκη υδραλογόνων (HX) (υδραλογόνωση) σε 1-βουτένιο[14]:
1. Με τον πολικό μηχανισμό. Παράγεται 2-βουτυλαλογονίδιο:
2. Με το μηχανισμό ελευθέρων ριζών. Παράγεται 1-βουτυλαλογονίδιο:
Καταλυτική αμμωνίωση Επεξεργασία
1. Προσθήκη αμμωνίας (NH3). Παράγεται 2-βουταναμίνη. Π.χ.:
- Τα παραπάνω μέταλλα που αναφέρονται στη θέση του καταλύτη χρησιμοποιούνται με τη μορφή συμπλόκων τους και όχι σε μεταλλική μορφή.
2. Προσθήκη πρωτοταγούς αμίνης. Παράγεται δευτεροταγής δ. βουτυλαμίνη. Π.χ. με μεθυλαμίνη παράγεται N-μεθυλο-2-βουταναμίνη:
3. Προσθήκη δευτεροταγούς αμίνης. Παράγεται τριτοταγής δ. βουτυλαμίνη. Π.χ. με διμεθυλαμίνη παράγεται N,N-διμεθυλο-2-βουταναμίνη:
Καταλυτική φορμυλίωση Επεξεργασία
Με προσθήκη μεθανάλης (CO + H2) σε βουτένιο παράγεται 2-μεθυλοβουτανάλη ή πεντανάλη. Π.χ.:
- Τα παραπάνω μέταλλα που αναφέρονται στη θέση του καταλύτη χρησιμοποιούνται με τη μορφή συμπλόκων τους και όχι σε μεταλλική μορφή.
- Όπου . Εξαρτάται από την επιλογή του καταλύτη. Οι σχετικά ογκώδεις καταλύτες ευνοούν το δεύτερο παραγωγο.
Προσθήκη αλδεΰδών ή κετονών κατά Prins Επεξεργασία
Με επίδραση περίσσειας αλδευδών ή κετονών σε προπένιο απουσία νερού, σε χαμηλή θερμοκρασία παράγεται παράγωγο διοξανίου. Π.χ. με μεθανάλη παράγεται 4-αιθυλο-1,3-διοξάνιο και 5-αιθυλο-1,3-διοξάνιο:
Διυδροξυλίωση Επεξεργασία
Η διυδροξυλίωση 1-βουτενίου, αντιστοιχεί σε προσθήκη H2O2[15]:
1. Επίδραση αραιού διαλύματος υπερμαγγανικού καλίου. Παράγει 1,2-βουτανοδιόλη:
2. Επίδραση καρβονικού οξέος και υπεροξείδιου του υδρογόνου. Παράγει 1,2-βουτανοδιόλη:
3. Μέθοδος Sharpless. Παράγει 1,2-βουτανοδιόλη:
4. Μέθοδος Woodward. Παράγει 1,2-βουτανοδιόλη:
5. Υπάρχει ακόμη δυνατότητα για 1,3-διυδροξυλίωση με επίδραση αλδευδών ή κετονών σε αιθένιο, παρουσία νερού. Αντίδραση Prins. Π.χ. με μεθανάλη παράγεται 1,3-πεντανοδιόλη:
Οζονόλυση Επεξεργασία
Με επίδραση όζοντος (οζονόλυση) σε 1-βουτένιο, παράγεται ασταθές οζονίδιο που τελικά διασπάται σε μεθανάλη και προπανάλη[16]:
Επίδραση πυκνού υπερμαγγανικού καλίου Επεξεργασία
Με επίδραση πυκνού διαλύματος υπερμαγγανικού καλίου (KMnO4) παράγεται τελικά διοξείδιο του άνθρακα και προπανικό οξύ[17]:
- Ενδιάμεσα παράγεται και μεθανικό οξύ, αλλά είναι ευαίσθητο σε τυχόν περίσσεια υπερμαγγανικού καλίου:
Καταλυτική προσθήκη οξυγόνου Επεξεργασία
Κατά την καταλυτική προσθήκη οξυγόνου σε 1-βουτένιο σχηματίζεται αιθυλοξιράνιο. Π.χ.:
Αλλυλική οξείδωση Επεξεργασία
Με επίδραση διοξειδίου του σεληνίου σε 1-βουτένιο παράγεται 3-βουτεν-2-όλη:
- Η μέθοδος αυτή ονομάζεται αλλυλική οξείδωση.
Αντίδραση Diels–Adler Επεξεργασία
Κατά την επίδραση αλκαδιενίου (διένιου) σε 1-βουτένιο (διενόφιλο) έχουμε την ονομαζόμενη (αντίδραση Diels–Adler) που στην περίπτωση αυτή οδηγεί σε παραγωγή παραγώγου κυκλοεξενίου. Π.χ. με 1,3-βουταδιένιο παίρνουμε 4-αιθυλοκυκλοεξένιο[18]:
Αντίδραση Pauson-Khand Επεξεργασία
Κατά την επίδραση αλκίνια και μονοξειδίου του άνθρακα σε 1-βουτένιο έχουμε την ονομαζόμενη αντίδραση Pauson-Khand που στην περίπτωση αυτή οδηγεί σε παραγωγή παραγώγων κυκλοπεντόνης. Π.χ. με αιθίνιο παράγεται 4-αιθυλο-2-κυκλοπεντενόνη και 5-αιθυλο-2-κυκλοπεντενόνη:
Προσθήκη καρβενίων Επεξεργασία
Κατά την προσθήκη μεθυλενίου σε 1-βουτένιο σχηματίζεται αιθυλοκυκλοπροπάνιο. Ταυτόχρονα όμως γίνονται και αντιδράσεις παρεμβολής στους δεσμούς C-H, οπότε παράγονται και πεντένια[19]:
- Η αντίδραση είναι ελάχιστα εκλεκτική και αυτό σημαίνει ότι κατά προσέγγιση έχουμε:
- 1. Παρεμβολή στους δύο (2) δεσμούς C#1H-H: Παράγεται 2-πεντένιο.
- 2. Παρεμβολή στον (1) δεσμό C-H: Παράγεται 2-μεθυλο-1-βουτένιο.
- 3. Παρεμβολή στους δύο (2) δεσμούς C#3H-H: Παράγεται 3-μεθυλο-1-βουτένιο.
- 4. Παρεμβολή στους τρεις (3) δεσμούς CH2-H: Παράγεται 1-πεντένιο.
- 5. Προσθήκη στον (ένα διπλό) δεσμό: Παράγεται αιθυλοκυκλοπροπάνιο.
Προκύπτει επομένως μίγμα 1-πεντενίου ~33%, 3-μεθυλο-1-βουτένιου ~22%, 2-πεντενίου ~22%, 2-μεθυλο-1-βουτένιου ~11% και αιθυλοκυκλοπροπάνιου ~11%.
Πολυμερισμός Επεξεργασία
Διακρίνονται τα ακόλουθα είδη πολυμερισμού 1-βουτένιου, που όλα παράγουν α-πολυβουτυλένιο[20]:
1. Κατιονικός. Π.χ.:
2.. Ελευθέρων ριζών. Π.χ.:
Φωτοχημικός διμερισμός Επεξεργασία
Κατά το φωτοχημικό διμερισμό 1-βουτένιου σχηματίζεται 1,3-διαιθυλοκυκλοβουτάνιο. Π.χ.[21]:
Φωτοχημική προσθήκη αλδεϋδών ή κετονών Επεξεργασία
Με επίδραση αλδευδών ή κετονών σε 1-βουτένιο απουσία νερού σχηματίζονται και φωτοχημικά παράγωγα οξετανίου (Αντίδραση Paterno–Büchi). Π.χ. με μεθανάλη παράγεται 3-αιθυλοξετάνιο:
Αρυλίωση Επεξεργασία
Με επίδραση αρενίων (ArH) παράγεται παράγωγο γενικού τύπου ArCH(CH3)CH2CH3. Π.χ. με βενζολίου, παρουσία καταλύτη, παράγεται 2-φαινυλοβουτάνιο[22]:
- Πρόκειται για αντίδραση προσθήκης του βενζολίου (PhH) με την έννοια Phδ--Hδ+.
Παράγωγα Επεξεργασία
Το 1-βουτένιο χρησιμοποιείται για την παραγωγή πολλών άλλων χημικών προϊόντων, όπως γραμμικό χαμηλής πυκνότητας πολυαιθυλένιο (Linear Low - Density Polyethylene → LLDPE), ρητίνες πολυπροπυλενίου, πολυβουτένιο, τετραϋδροφουράνιο και βουτανόνη[23].
Αναφορές και σημειώσεις Επεξεργασία
- ↑ Διαδικτυακός τόπος researchgate.net
- ↑ Για εναλλακτικές ονομασίες δείτε τον πίνακα πληροφοριών.
- ↑ Τα δεδομένα προέρχονται εν μέρει από το «Table of periodic properties of thw Ellements», Sagrent-Welch Scientidic Company και Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, Σελ. 34.
- ↑ 4,0 4,1 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.153, §6.3.3.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.153, §6.3.1α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.153, §6.3.1β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.158, §6.9.4.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.153, §6.3.4.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.3.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.5.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.4.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.6.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 157, §6.8.9.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 157, §6.8.10.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 158, §6.9.8.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 160, §6.10.2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 157, §6.8.7., σελ. 155, §6.7.3, R = CH3CH2CH=CH ή CH3CH2C=CH2 ή CH3CHCH=CH2 ή CH2CH2CH=CH2
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 157, §6.8.11.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 157, §6.8.12.
- ↑ Kniel, Ludwig· Winter, Olaf· Stork, Karl (1980). Ethylene, keystone to the petrochemical industry. New York: M. Dekker. ISBN 0-8247-6914-7.
- ↑ 1-Butene product overview
Πηγές Επεξεργασία
- Πληροφορίες για το βουτένιο-1 στη ιστοσελίδα της Shell.[νεκρός σύνδεσμος]
- Speight J. G., “Chemical and Process Design Handbook”, McGraw-Hill, 2002.
- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
