Προπεν-2-όλη
Η προπενόλη-2 είναι ονομασία δύο γεωμετρικών ισομερών αλκενολών, δηλαδή ακόρεστων άκυκλων μονοσθενών αλκοολών με ένα διπλό δεσμό. Συνήθως αντιπροσωπεύεται από τους τύπους CH3C(OH)=CH2 και MeC(OH)=CH2. Με βάση το χημικό της τύπο, C3H6Ο έχει τα ακόλουθα οκτώ (8) ισομερή:
- Προπεν-1-όλη-1 (ελάσσων ταυτομερές της προπανάλης) με σύντομο συντακτικό τύπο CH3CH=CHOH.
- Προπεν-2-όλη-1 ή αλλυλική αλκοόλη με σύντομο συντακτικό τύπο CH2=CHCH2OH.
- Βινυλμεθυλαιθέρας ή μεθοξυαιθένιο με σύντομο συντακτικό τύπο CH3OCH=CH2.
- Κυκλοπροπανόλη με σύντομο συντακτικό τύπο
 .
. - Προπανάλη (κύριο ταυτομερές) της προπεν-1-όλης-1 με σύντομο συντακτικό τύπο CH3CH2CHO.
- Προπανόνη (κύριο ταυτομερές) της προπενόλης-2 με σύντομο συντακτικό τύπο CH3COCH3.
- Οξετάνιο με σύντομο συντακτικό τύπο
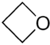 .
. - Μεθυλοξιράνιο με σύντομο συντακτικό τύπο

| Προπεν-2-όλη | |
|---|---|
| Γενικά | |
| Όνομα IUPAC | Προπεν-2-όλη |
| Χημικά αναγνωριστικά | |
| Χημικός τύπος | C3H6O |
| Μοριακή μάζα | 58,08 amu[1] |
| Σύντομος συντακτικός τύπος |
CH3C(OH)=CH2 |
| Συντομογραφίες | MeC(OH)=CH2 |
| SMILES | CC(O)=C |
| Δομή | |
| Ισομέρεια | |
| Ισομερή θέσης | 9 |
| Φυσικές ιδιότητες | |
| Χημικές ιδιότητες | |
| Αυτοϊσομερίωση | ναι προς προπανόνη |
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |
Χημικές ιδιότητες και παράγωγα Επεξεργασία
Ταυτομέρεια Επεξεργασία
Βασική ιδιότητά της είναι η ταυτομέρεια με την προπανόνη, με την οποία βρίσκεται πάντα σε χημική ισορροπία, έντονα μετατοπισμένη σε όφελος της κετόνης, η οποία όμως δεν είναι δυνατό να απομονωθεί χωρίς την παρουσία ανιχνεύσιμων ιχνών προπενόλης-2. Μπορεί να καταλυθεί προς την επιθυμητή κατεύθυνση με παρουσία οξέων, βάσεων ή ουσιών που απομακρύνουν ποσότητες από τη μια από τις δύο ενώσεις[2]:
Αλογόνωση Επεξεργασία
Με επίδραση αλογόνου (X2) έχουμε προσθήκη του στην προπενόλη-2. Παράγεται αρχικά η ασταθής 1,2-διαλοπροπανόλη-2 που αφυδραλογονώνεται σχηματίζοντας τελικά αλοπροπανόνη[3]:
Αναφορές και σημειώσεις Επεξεργασία
- ↑ Ελλείψει άλλης πηγής χρησιμοποιείθηκε η μορισκή μάζα της ισομερούς προπεν-2-όλης-1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.218, §9.5.1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.220, §9.5.13.
Πηγές Επεξεργασία
- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
- Δημήτριου Ν. Νικολαΐδη: Ειδικά μαθήματα Οργανικής Χημείας, Θεσσαλονίκη 1983.