Μεθυλοβουτίνιο
Το (3-)μεθυλο(-1-)βουτίνιο[2] (αγγλικά: 3-methyl-1-butyne) είναι οργανική χημική ένωση, που περιέχει άνθρακα και υδρογόνο, με μοριακό τύπο C5H8 και ημισυντακτικό τύπο (CH3)2CHC≡CH. Ανήκει στην ομόλογη σειρά των αλκινίων.
| Μεθυλοβουτίνιο | |||
|---|---|---|---|
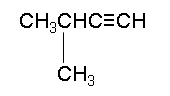
| |||

| |||
| Γενικά | |||
| Όνομα IUPAC | Μεθυλοβουτίνιο | ||
| Άλλες ονομασίες | Ισοπροπυλακετυλένιο Ισοπροπυλαιθίνιο | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | C5H8 | ||
| Μοριακή μάζα | 68.12 | ||
| Σύντομος συντακτικός τύπος |
(CH3)2CHC≡CH | ||
| Συντομογραφίες | iPrC≡CH | ||
| Αριθμός CAS | 598-23-2[1] | ||
| SMILES | CC(C)C#C | ||
| Δομή | |||
| Ισομέρεια | |||
| Ισομερή θέσης | 25 | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | -9°C | ||
| Σημείο βρασμού | 29,5 °C | ||
| Πυκνότητα | 666 kg/m³ | ||
| Διαλυτότητα στο νερό |
Αδιάλυτο | ||
| Εμφάνιση | Διαφανές, άχρωμο υγρό | ||
| Χημικές ιδιότητες | |||
| Επικινδυνότητα | |||
 
| |||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Το χημικά καθαρό μεθυλοβουτίνιο, στις «κανονικές συνθήκες περιβάλλοντος», δηλαδή σε θερμοκρασία 25 °C και υπό πίεση 1 atm, είναι εξαιρετικά εύφλεκτο υγρό.
Παραγωγή Επεξεργασία
Με απόσπαση υδραλογόνων Επεξεργασία
Με απόσπαση δύο ισοδυνάμων υδραλογόνου (HX) από 1,1-διαλο-3-μεθυλοβουτάνιο, με χρήση υδροξειδίου του νατρίου (NaOH), παράγεται μεθυλοβουτίνιο[3]:
Με βρωμίωση και μετά απόσπαση υδροβρωμίου Επεξεργασία
Με βρωμίωση (Br2) 3-μεθυλο-1-βουτενίου παράγεται αρχικά 1,2-διβρωμο-3-μεθυλοβουτάνιο. Μετά, με απόσπαση δύο ισοδυνάμων υδροβρωμίου (HBr) από το τελευταίο με χρήση διαλύματος νατραμιδίου (NaNH2) σε υγρή αμμωνία (NH3) παράγεται τελικά μεθυλοβουτίνιο:[4]
Με απόσπαση αλογόνων Επεξεργασία
Με απόσπαση δύο ισοδυνάμων αλογόνου (X2) 1,1,2,2-τετραλο-3-μεθυλοβουτάνιο, με χρήση ψευδαργύρου (Zn), παράγεται μεθυλοβουτίνιο[5]:
Με ισοπροπυλίωση αιθινίου Επεξεργασία
Το αιθινικό νάτριο (HC≡CNa) μπορεί να ισοπροπυλιωθεί με ισοπροπυλαλογονίδιο[6]:
Χημικές ιδιότητες και παράγωγα Επεξεργασία
- Εμφανίζει όλες τις χαρακτηριστικές ιδιότητες των ακόρεστων υδρογονανθράκων:
Καύση Επεξεργασία
Ενυδάτωση Επεξεργασία
Με επίδραση θειικού οξέος (H2SO4) και στη συνέχεια νερού (Η2Ο, ενυδάτωση) σε μεθυλοβουτίνιο , παρουσία ιόντων υδραργύρου (Hg2+), παράγεται (ττελικά) μεθυλοβουτανόνη [(CH3)2CHCOCH3][7]:
- Ενδιάμεσα παράγεται 3-μεθυλο-1-βουτεν-2-όλη [(CΗ3)2CΗC(OH)=CH ασταθής ενόλη], που τελικά ισομερειώνεται σε μεθυλοβουτανόνη .
Προσθήκη υπαλογονώδους οξέος Επεξεργασία
Με επίδραση (προσθήκη) υποαλογονώδους οξέος (HOX) μεθυλοβουτίνιο παράγεται 1-αλομεθυλοβουτανόνη [(CΗ3)2CHCΟCΗ2Χ[[8]:
- Ενδιάμεσα παράγεται 1-αλο-3-μεθυλο-1-βουτεν-2-όλη [(CΗ3)2CHC(ΟH)=CΗX, ασταθής ενόλη], που τελικά ισομερειώνεται σε 1-αλομεθυλοβουτανόνη.
Καταλυτική υδρογόνωση Επεξεργασία
Με καταλυτική υδρογόνωση (H2) μεθυλοβουτίνιου σχηματίζεται αρχικά 3-μεθυλο-1-βουτένιο και στη συνέχεια (με περίσσεια υδρογόνου) μεθυλοβουτάνιο.[9]:
Αλογόνωση Επεξεργασία
Με επίδραση αλογόνου (X2, αλογόνωση) σε μεθυλοβουτίνιο έχουμε προσθήκη στον τριπλό δεσμό. Παράγεται αρχικά 1,2-διαλο-3-μεθυλο-1-βουτένιο, και στη συνέχεια (με περίσσεια αλογόνου), 1,1,2,2-τετραλο-3-μεθυλοβουτάνιο.[10]:
Υδραλογόνωση Επεξεργασία
Με προσθήκη υδραλογόνων (HX, υδραλογόνωση) σε μεθυλοβουτίνιο παράγεται αρχικά 2-αλο-3-μεθυλο-1-βουτένιο, και στη συνέχεια (με περίσσεια υδραλογόνου) 2,2-διαλο-3-μεθυλοβουτάνιο.[11]:
Υδροκυάνωση Επεξεργασία
Με προσθήκη υδροκυανίου (HCN, υδροκυάνωση) σε μεθυλοβουτίνιο παράγεται ισοπροπυλαιθενονιτρίλιο:
Διυδροξυλίωση Επεξεργασία
Η διυδροξυλίωση μεθυλο-1-βουτίνιου , αντιστοιχεί σε προσθήκη υπεροξειδίου του υδρογόνου (H2O2) και παράγει τελικά μεθυλο-1-υδροξυβουτανόνη[12]:
1. Επίδραση αραιού διαλύματος υπερμαγγανικού καλίου (KMnO4). Π.χ.:
2. Επίδραση καρβοξυλικού οξέος (RCΟOH) και υπεροξείδιου του υδρογόνου (Η2Ο2):
- Ενδιάμεσα παράγεται 3-μεθυλο-1-βουεν-1,2-διόλη (ασταθής ενόλη), που τελικά ισομερειώνεται σε μεθυλο-1-υδροξυβουτανόνη.
Επίδραση πυκνού υπερμαγγανικού καλίου Επεξεργασία
Με επίδραση πυκνού διαλύματος υπερμαγγανικού καλίου (KMnO4) παράγεται μεθυλο-2-οξοβουτανικό οξύ[13]:
Προσθήκη αλκοολών Επεξεργασία
Με επίδραση αλκοόλης (ROH) σε μεθυλοβουτίνιο παράγεται 2-αλκοξυ-3-μεθυλο-1-βουτένιο[14]:
Προσθήκη καρβονικών οξέων Επεξεργασία
Με επίδραση καρβοξυλικού οξέος (RCOOH) σε μεθυλοβουτίνιο παράγεται καρβονικός ισοπροπυλοβινυλεστέρας[15]:
Οζονόλυση Επεξεργασία
Με επίδραση όζοντος (Ο3 οζονόλυση) σε μεθυλοβουτίνιο παράγεται αρχικά ασταθές οζονίδιο που τελικά διασπάται σε μεθυλο-2-οξοβουτανάλη[16]:
Σχηματισμός ακετυλιδίων Επεξεργασία
1. Με επίδραση μεταλλικού νατρίου σε μεθυλοβουτίνιο παράγεται μεθυλοβουτινικό νάτριο[6]:
- Το μεθuλοβουτανικό νάτριο [(CH3)2CHC≡CΝa] αποτελεί πρώτη ύλη για την παραγωγή άλλων παραγώγων με τριπλό δεσμό, γιατί αντιδρά με αλκυλαλογονίδια (RX):
2. Με επίδραση ιόντων αργύρου (Ag+) και παρουσία αμμωνίας (NH3) παράγεται ένα λευκό στερεό, ο μεθυλοβουτινικός άργυρος[17]:
3. Με επίδραση ιόντων μονοσθενούς χαλκού (Cu+) και παρουσία αμμωνίας (NH3) παράγεται ένα κεραμιδί στερεό, ο μεθυλοβουτινικός χαλκός[18]:
- Οι αντιδράσεις 2 και 3 χρησιμοποιούνται για την ανίχνευση της ομάδας -C ≡ CH.
Προσθήκη καρβενίων Επεξεργασία
Κατά την προσθήκη μεθυλενίου σε μεθυλοβουτίνιο σχηματίζονται 3-μεθυλοπεντίνιο-1, διμεθυλοβουτίνιο, μεθυλοπεντίνιο-2 και 1-ισοπροπυλοκυκλοπροπένιο[19]:
- Η αντίδραση είναι ελάχιστα εκλεκτική και αυτό σημαίνει ότι κατά προσέγγιση έχουμε:
- 1. Παρεμβολή στους έξι (6) δεσμούς C4-Η και C1'-H: Προκύπτει 3-μεθυλοπεντίνιο-1, ένα αλκίνιο.
- 2. Παρεμβολή στον έναν (1) δεσμό C3-H: Προκύπτει διμεθυλοβουτίνιο, ένα αλκίνιο.
- 3. Παρεμβολή στον έναν (1) δεσμό C1-H: Προκύπτει μεθυλοπεντίνιο-2, ένα αλκίνιο.
- 4. Προσθήκη στον έναν (1) τριπλό δεσμό: Προκύπτει 1-ισοπροπυλοκυκλοπροπένιο, ένα κυκλοαλκένιο.
- Προκύπτει επομένως μίγμα 3-μεθυλοπεντινίου-1 ~67%, διμεθυλοβουτινίου ~11%, μεθυλοπεντινίου-2 ~11% και 1-ισοπροπυλοκυκλοπροπενιου ~11%.
- Με τη χρήση μεθυλενοδιιωδιδίου (CH2I2) και ψευδαργύρου (Zn) επικρατεί η προσθήκη, οπότε είναι:
Πηγές Επεξεργασία
- Speight J. G., “Chemical and Process Design Handbook”, McGraw-Hill, 2002.
- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
Αναφορές και σημειώσεις Επεξεργασία
- ↑ Δικτυακός τόπος ChemicalBook
- ↑ Για εναλλακτικές ονομασίες δείτε τον πίνακα πληροφοριών.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.153, §6.4.3.
- ↑ H. N. Miller, K. W. Greenlee, J. M. Derfer, C. E. Boord: „Mono- and Di-Alkylacetylenes from Vicinal Dihalides and Sodium Amide in Liquid Ammonia“, in: J. Org. Chem., 1954, 19, S. 1882–1888 (doi:10.1021/jo01377a003).
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.153, §6.3.1β.
- ↑ 6,0 6,1 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 159, §6.9.10α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 158, §6.9.3.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.4.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 158, §6.9.4α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 158, §6.9.2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 158, §6.9.1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 157, §6.8.9.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 158, §6.9.8.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 158, §6.9.5.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 158, §6.9.6.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 158, §6.9.7α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 159, §6.9.10β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 159, §6.9.10γ.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 157, §6.8.7., σελ. 155, §6.7.3