Διοξάνιο
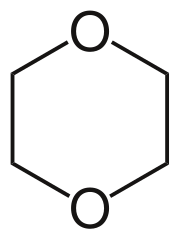
Το διοξάνιο είναι μία ετεροκυκλική οργανική ένωση, που ταξινομείται ως αιθέρας.[1] Είναι ένα άχρωμο υγρό χημικό, με ελαφρά γλυκιά οσμή, παρόμοια με αυτή του διαιθυλαιθέρα. Η ένωση συχνά ονομάζεται απλώς διοξάνιο ή χημικώς ορθά 1,4- διοξάνιο επειδή τα άλλα ισομερή του (ήτοι: 1,2- διοξάνιο και 1,3- διοξάνιο) σπάνια συναντώνται.
Το διοξάνιο χρησιμοποιείται ως διαλύτης για ποικίλες πρακτικές εφαρμογές, καθώς και στο εργαστήριο, όπως και ως σταθεροποιητής για τη μεταφορά χλωριωμένων υδρογονανθράκων σε δοχεία αλουμινίου.[2]
Σύνθεση
ΕπεξεργασίαΤο διοξάνιο παράγεται με αφυδάτωση μιας γλυκόλης, συγκεκριμένα με καταλυόμενη από οξύ αφυδάτωση της διαιθυλενογλυκόλης, η οποία με τη σειρά της λαμβάνεται από υδρόλυση του αιθυλενοξειδίου.
Δομή
ΕπεξεργασίαΤο μόριο του διοξανίου είναι κεντροσυμμετρικό, που σημαίνει ότι έχει στερεοχημική δομή (chair) καρέκλας, χαρακτηριστική των συγγενών του κυκλοεξανίου. Ωστόσο, το μόριο είναι δομικώς εύκαμπτο και η διαμόρφωση του υλοποιείται εύκολα, λ.χ. στη χηλικοποίηση κατιόντων μετάλλων. Το διοξάνιο ομοιάζει με έναν μικρότερο αιθέρα κορώνας με μόνο δύο μονάδες αιθυλενοξυλίου.
Χρήσεις
ΕπεξεργασίαΓια τη μεταφορά του τριχλωροαιθανίου
ΕπεξεργασίαΣτη δεκαετία του 1980, το μεγαλύτερο μέρος του παραγόμενου διοξανίου χρησιμοποιήθηκε ως σταθεροποιητής για το χημικό συστατικό, 1,1,1-τριχλωροαιθάνιο για αποθήκευση και μεταφορά μέσα σε δοχεία αλουμινίου.[3]
Ως διαλύτης
ΕπεξεργασίαΤο διοξάνιο χρησιμοποιείται σε ποικίλες εφαρμογές ως ευέλικτος απρωτικός διαλύτης, π.χ. για μελάνια, κόλλες και εστέρες κυτταρίνης.[4] Δύναται να αντικαθιστά το τετραϋδροφουράνιο (THF) σε ορισμένες διεργασίες, λόγω της χαμηλότερης τοξικότητας που έχει και του υψηλότερου σημείου βρασμού (δηλ. 101°C, έναντι 66°C του THF).
Φασματοσκοπία
ΕπεξεργασίαΤο διοξάνιο χρησιμοποιείται ως πρότυπος διαλύτης για τη φασματοσκοπία NMR σε οξείδιο του δευτερίου.[5]
Τοξικολογία
ΕπεξεργασίαΤο διοξάνιο έχει μέση θανατηφόρο δόση -LD50- 5170 mg/kg σε αρουραίους.[3] Είναι χημικό ερεθιστικό για τους οφθαλμούς και την αναπνευστική οδό.[6] Η έκθεση μπορεί να προκαλέσει βλάβη στο κεντρικό νευρικό σύστημα, στο ήπαρ και στα νεφρά.[7] Ταξινομείται από το Εθνικό Πρόγραμμα Τοξικολογίας ως "αναμενόμενα καρκινογόνος ουσία για τον άνθρωπο".[8] Επίσης ταξινομείται από την διεθνή ένωση IARC ως πιθανώς καρκινογόνος για τον άνθρωπο επειδή είναι γνωστό καρκινογόνο σε άλλα ζώα (θηλαστικά).[9]
Ισομερή
ΕπεξεργασίαΤο διοξάνιο έχει τυπικά τρία διαφορετικά ισομερή, εκ των οποίων μόνον το ένα είναι το συχνά απαντώμενο.
Παραπομπές
Επεξεργασία- ↑ «Dioxane». PubChem. Ανακτήθηκε στις 17 Νοεμβρίου 2021.
- ↑ Wisconsin Department of Health Services (2013) 1,4-Dioxane Fact Sheet Αρχειοθετήθηκε 2020-10-16 στο Wayback Machine..
- ↑ 3,0 3,1 Surprenant, Kenneth S. (2000). «Dioxane». Dioxane in Ullmann's Encyclopedia of Industrial Chemistry. ISBN 978-3527306732.
- ↑ Klaus Weissermel, Hans-Jürgen Arpe (2003) "Industrial Organic Chemistry".
- ↑ Shimizu, A.; Ikeguchi, M.; Sugai, S. (1994). «Appropriateness of DSS and TSP as internal references for 1H NMR studies of molten globule proteins in aqueous media». Journal of Biomolecular NMR 4 (6): 859–62. doi:. PMID 22911388.
- ↑ «Εκατοντάδες καλλυντικά για παιδιά ύποπτα για καρκινογόνες ουσίες». Think Organic. 8 Ιανουαρίου 2020. Ανακτήθηκε στις 17 Νοεμβρίου 2021.
- ↑ «International Chemical Safety Card». National Institute for Occupational Safety and Health. Αρχειοθετήθηκε από το πρωτότυπο στις 29 Απριλίου 2005. Ανακτήθηκε στις 6 Φεβρουαρίου 2006.
- ↑ «12th Report on Carcinogens». United States Department of Health and Human Services' National Toxicology Program. Αρχειοθετήθηκε από το πρωτότυπο στις 14 Ιουλίου 2014. Ανακτήθηκε στις 11 Ιουλίου 2014.
- ↑ IARC Monographs Volume 71 (PDF). International Agency for Research on Cancer. Ανακτήθηκε στις 11 Ιουλίου 2014.