AlphaFold
| Αυτό το λήμμα είναι ορφανό καθώς λίγα ή και καθόλου λήμματα συνδέουν σε αυτό. Παρακαλούμε βοηθήστε βάζοντας συνδέσμους προς αυτό σε λήμματα για σχετικά θέματα. |
Σήμερα υπάρχουν περίπου 230 εκατομμύρια πρωτεΐνες καταχωρημένες στη βάση δεδομένων UniProt, ενώ κάθε χρόνο προστίθενται εκατομμύρια νέες. Κάθε μία από αυτές έχει ένα μοναδικό τρισδιάστατο σχήμα που καθορίζει τη λειτουργία της. Ο αλγόριθμος AlphaFold έχει σχεδιαστεί για να προβλέπει τη στερεοδιάταξη των πρωτεϊνών, πράγμα που έχει καταφέρει για περισσότερες από 200 εκατομμύρια γνωστές πρωτεΐνες στη UniProt [1].
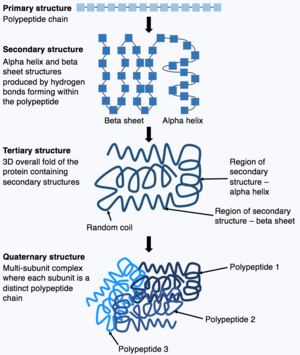
Τα δομικά συστατικά των πρωτεϊνών αποτελούν τα αμινοξέα των οποίων η αλληλουχία θα καθορίσει την τρισδιάστατη δομή του μορίου. Υπάρχουν 20 διαφορετικά αμινοξέα διαθέσιμα για την παραγωγή πρωτεϊνών τα οποία συναρμολογούνται σύμφωνα με τις οδηγίες των γονιδίων στο DNA του οργανισμού. Οι δυνάμεις έλξης και απώθησης μεταξύ τους αναδιπλώνουν την πρωτεΐνη κατά έναν τρόποπου μπορεί να παρομοιαστεί με "φυσικό οριγκάμι", δημιουργώντας τις πολύπλοκες πτυχώσεις, τις θηλιές και τις αναδιπλώσεις της τρισδιάστατης δομής της πρωτεΐνης [2][3][4].
Η λύση της δομής των πρωτεϊνών αποτελεί πρόκληση εξέχουσας σημασίας καθώς κάτι τέτοιο θα οδηγούσε στην κατανόηση της λειτουργίας τους. Αν ληφθεί υπόψιν ότι οι πρωτεΐνες είναι τα λειτουργικά μόρια των οργανισμών, ο προσδιορισμός της δομής τους θα βοηθούσε την επιστημονική κοινότητα να κατανοήσει σε βάθος της βιολογικές διεργασίες και να αντιμετωπίσει προβλήματα που αφορούν τομείς όπως την ανθρώπινη υγεία και το περιβάλλον. Οι διαμορφώσεις κάποιων πρωτεϊνών έχουν προσδιοριστεί με πειραματικές τεχνικές και βρίσκονται διαθέσιμες στη βάση δεδομένων Protein Data Bank (PDB) (https://www.rcsb.org/), παρόλα αυτά, οι τεχνικές αυτές δεν είναι καθόλου εύκολο να πραγματοποιηθούν για το σύνολο των πρωτεϊνών [1].
Δύο θεωρήματα που πυροδότησαν την έρευνα σχετικά με την εύρεση ενός υπολογιστικού μοντέλου που να μπορεί να προβλέπει τη στερεοδιαμόρφωση των πρωτεϊνών ήταν το παράδοξο του Levinthal (Levinthal paradox) και το δόγμα του Anfinsen (Anfinsen's dogma) [1]. Συγκεκριμένα, το 1969, o Cyrus Levinthal εξέφρασε την άποψη ότι θα ήταν πρακτικά αδύνατο για μία πρωτεΐνη να καταφέρει να αποκτήσει τη λειτουργική της διαμόρφωση μέσω μιας τυχαίας εξερεύνησης όλων των πιθανών διαμορφώσεων, σε ένα βιολογικά λογικό χρονικό διάστημα [5][6][7]. Έκτοτε, σχεδιάστηκαν αρκετά υπολογιστικά μοντέλα προκειμένου να λυθεί η στερεοδιάταξη των πρωτεϊνών με βάση την πρωτοταγή τους δομή, παρόλα αυτά δεν ήταν αρκετά ακριβή. Τα πράγματα άλλαξαν, όταν έκανε την εμφάνισή του ο αλγόριθμός AlphaFold, όπως αναλυτικά περιγράφεται στη συνέχεια [1].
Η πρόβλεψη της πρωτεϊνικής δομής μέχρι την εμφάνιση του AlphaFold
ΕπεξεργασίαΕίναι γεγονός πως ο προσδιορισμός της δομής μια πρωτεΐνης είναι πολύ δύσκολος. Οι ερευνητές ασχολήθηκαν με το πρόβλημα ενεργά νωρίτερα και από τη δεκαετία του 1970 όπου ο Αμερικανός βιοχημικός Κρίστιαν Άνφινσεν κέρδισε το βραβείο Νόμπελ χημείας για τις έρευνές του που καταδείκνυαν ότι οι αλληλουχίες είναι αυτές που καθορίζουν τη δομή[8]. Το 1994 κάνει την εμφάνισή του το CASP (Critical Assessment Protein Structure Prediction), το οποίο προσελκύει ερευνητές από όλον τον κόσμο και δίνει ώθηση στο πεδίο. Πρόκειται για μια κοινοτική πρωτοβουλία στον τομέα της δομικής βιολογίας που αξιολογεί την ακρίβεια και την αποτελεσματικότητα των υπολογιστικών μεθόδων πρόβλεψης της πρωτεϊνικής δομής μέσω της αλληλουχίας των αμινοξέων [9].
To 2018 στο CASP η DeepMind παρουσιάζει την πρώτη έκδοση του AlphaFold και κερδίζει τον διαγωνισμό ενσωματώνοντας στον αλγόριθμο τεχνικές τεχνητής νοημοσύνης και βαθιάς μάθησης. Η βαθμολόγηση των λογισμικών στο CASP γίνεται με μια μέθοδο γνωστή ως global distance test (GDT) η οποία δίνει έναν βαθμό από το 0 έως το 100 με βάση το πόσο κοντά είναι η προβλεπόμενη δομή μιας πρωτεΐνης, από την πραγματική δομή που έχει προσδιοριστεί εργαστηριακά. Το AlphaFold σημείωσε πολύ καλή βαθμολογία για όλες τις πρωτεΐνες της δοκιμασίας και μάλιστα για περίπου πάνω από τα δύο τρίτα των πρωτεϊνών είχε βαθμολογία άνω του 90, γεγονός που θα μπορούσε ακόμα να σημαίνει ότι οι διαφορές μεταξύ της προβλεπόμενης και της πραγματικής δομής, θα μπορούσαν να οφείλονται σε σφάλματα του εργαστηρίου και όχι του λογισμικού. Επιπλέον θα μπορούσε να σημαίνει ότι η προβλεπόμενη δομή είναι κι αυτή μια εναλλακτική διαμόρφωση εντός του εύρους της φυσικής παραλλαγής [10]. Μόλις δύο χρόνια αργότερα το 2020, η DeepMind κερδίζει ξανά τον διαγωνισμό (CASP14) με την δεύτερη έκδοση του AlphaFold (AlphaFold2) η οποία συγκέντρωσε εξαιρετικά αποτελέσματα και υπερίσχυσε σημαντικά των άλλων συμμετεχόντων. Συγκεκριμένα, στην ανανεωμένη εκδοχή του αλγορίθμου χρησιμοποιείται μία ενσωμάτωση που περιλαμβάνει όλες τις ακολουθίες που προκύπτουν από την ανάλυση πολλαπλών ακολουθιών (MSA) και από πιθανά δείγματα, σε αντίθεση με τον AlphaFold1, που περιλάμβανε μόνο τα στατιστικά από τις αναλύσεις πολλαπλών ακολουθιών. Αυτή η προσέγγιση επιτρέπει στο AlphaFold2 να κατανοήσει την χωροδιάταξη των πρωτεϊνών με μεγαλύτερη πληρότητα και πολυπλοκότητα. Παράλληλα, ήταν δυνατή η καλύτερη απόδοση του αλγορίθμου καθώς αποφεύγονται οι φυσικά αδύνατες διαμορφώσεις των πρωτεϊνών, μέσω της ενσωμάτωσης φυσικών και γεωμετρικών εννοιών στην αρχιτεκτονική του. Η αντικατάσταση του συνελικτικού νευρωνικού δικτύου (convolutional neural network) με μια αρχιτεκτονική που βασίζεται στην προσοχή (attention based architecture) αλλάζει τη σταθερή ροή πληροφοριών με μια ροή που ελέγχεται δυναμικά από το δίκτυο. Ένα σημαντικό συστατικό του μοντέλου είναι μια έκδοση του επαναληπτικού μετασχηματιστή SE(3)-Transformer. Ένας μετασχηματιστής είναι μια αρχιτεκτονική αυτόματου κωδικοποιητή που εξειδικεύεται διαδοχικά σε αντιστοίχιση ακολουθίας. Έτσι, ο μηχανισμός που επιστρατεύεται επιτρέπει στον αλγόριθμο να «μαθαίνει» τις συσχετίσεις ανάμεσα στα δεδομένα που χρησιμοποιούνται ως είσοδος και έτσι, ελαχιστοποιείται το χάσμα μεταξύ των προβλέψεων ζεύξης των αμινοξέων με την πραγματική τρισδιάστατη δομή της πρωτεΐνης [4].
Η λογική πίσω από τον αλγόριθμο του AlphaFold
ΕπεξεργασίαΓια την κατασκευή του AlphaFold η DeepMind βασίστηκε στην τεχνογνωσία μιας ομάδας βιολόγων, φυσικών και επιστημόνων των υπολογιστών. Η λογική του αλγορίθμου βασίζεται σε μια τεχνική βαθιάς μάθησης (Deep Learning,DL) που χρησιμοποιεί ένα δίκτυο προσοχής που επιτρέπει την ανάλυση ενός μεγαλύτερου προβλήματος, εστιάζοντας πρώτα σε μικρότερα [10]. Στην πράξη η μηχανική μάθηση (Machine Learning,ML) ανήκει στον τομέα της τεχνητής νοημοσύνης (Artificial Intelligence, AI), και αποσκοπεί στην κατασκευή αλγορίθμων που εκπαιδεύονται και αυτοβελτιώνουν την απόδοσή τους. Έναν τέτοιου τύπου αλγόριθμο αποτελούν τα νευρωνικά δίκτυα, τα οποία ονομάστηκαν έτσι επειδή είναι εμπνευσμένα από την οργάνωση των νευρώνων στον εγκέφαλο. Ένα νευρωνικό δίκτυο αποτελείται από έναν ιστό εικονικών κόμβων που περνούν σήματα ο ένας στον άλλον, ακριβώς όπως στον εγκέφαλο οι ιστοί των νευρώνων επικοινωνούν μεταξύ τους μέσω των συνάψεων. Συνήθως κάθε κόμβος εκτελεί κάποιες μαθηματικές πράξεις στα λαμβανόμενα σήματα και στη συνέχεια μεταβιβάζει το νέο σήμα στους επόμενους κόμβους. Κατά τη διαδικασία της εκπαίδευσης ,γίνεται η ρύθμιση των λειτουργιών κάθε κόμβου έτσι ώστε ολόκληρο το δίκτυο να παράγει την επιθυμητή έξοδο από τις εισόδους εκπαίδευσης [11].
Έτσι και το AlphaFold περιλαμβάνει ένα δίκτυο από εκατοντάδες επίπεδα με χιλιάδες κόμβους, όπου η είσοδος είναι πληροφορίες σχετικές με την πρωτεϊνική αλληλουχία και ο στόχος είναι να προβλεφθεί η απόσταση ανάμεσα σε κάθε υπόλειμμα μέσα στην αναδιπλούμενη πρωτεΐνη. Για την εκπαίδευση του λογισμικού χρησιμοποιήθηκαν περίπου 170.000 πρωτεΐνες που προέρχονται από την PDB (Protein Data Bank), ένα δημόσιο αποθετήριο αλληλουχιών και δομών. Αυτά τα δεδομένα χρησιμοποιούνται για τον υπολογισμό της απόστασης μεταξύ ζευγών αμινοξέων σε δομές που δεν είναι ακόμα γνωστές. Παράλληλα το λογισμικό είναι ικανό να αξιολογήσει την ακρίβεια αυτών των υπολογισμών [10].
Προβλεπόμενες επαφές vs Προβλεπόμενες αποστάσεις.
ΕπεξεργασίαΗ έννοια των προβλεπόμενων επαφών αφορά κατάλοιπα σε μια πρωτεΐνη που προβλέπεται να βρίσκονται κοντά το ένα στο άλλο («σε επαφή») στην αναδιπλούμενη δομή, ακόμη και εάν δεν είναι γειτονικά στην πρωτεϊνική αλληλουχία. Αυτές οι προβλέψεις προέρχονται από μοτίβα συνδιακύμανσης που προκύπτουν κατά τη διάρκεια της εξέλιξης και επιβεβαιώνονται με τη σύγκριση παρόμοιων αλληλουχιών σε διαφορετικούς οργανισμούς. Δηλαδή, η ίδια πρωτεΐνη στον άνθρωπο, τον ποντικό, τους χιμπατζήδες μπορεί να έχει θέσεις στην αλληλουχία που τείνουν να συν μεταβάλλονται, σαν να εξαρτάται το ένα κατάλοιπο από το άλλο μέσα στα χρόνια της εξέλιξης. Έτσι λοιπόν, η έντονη συνδιακύμανση μεταξύ δυο καταλοίπων υποδηλώνει συνήθως αλληλεπίδραση μέσα στην αναδιπλούμενη δομή, μέσω του πακεταρίσματος των πλευρικών αλυσίδων, δεσμών υδρογόνου, ηλεκτροστατικών αλληλεπιδράσεων, κλπ.
Βασικό πλεονέκτημα του AlphaFold, ήταν το ότι προώθησε την έννοια των προβλεπόμενων επαφών περεταίρω , καθώς προσπαθεί να προβλέψει την απόσταση μεταξύ δυο καταλοίπων (ένα εύρος τιμών μεταξύ 2 και 20 Å). Τέτοιου είδους προβλέψεις είναι πιο δύσκολο να γίνουν αλλά προσφέρουν περισσότερο ακριβείς πληροφορίες σχετικά με τη μορφή της αναδιπλούμενης δομής της πρωτεΐνης. Επιπλέον, ο αλγόριθμος προσφέρει την αναπαράσταση της κάθε προβλεπόμενης απόστασης ως μια ομαλή συνάρτηση περιορισμού, που επιτρέπει τη χρήση μιας απλής τεχνικής που ονομάζεται βαθμωτή κάθοδος. Έτσι, διπλώνεται απευθείας η πρωτεΐνη σε μια δομή συμβατή με τις προβλεπόμενες αποστάσεις. Τέλος, το AlphaFold συνδυάζει τις προβλέψεις απόστασης με την ενεργειακή συνάρτηση Rosetta για να βελτιώσει την τελική αναδιπλούμενη δομή του [12].
Η βάση δεδομένων του AlphaFold και ο αντίκτυπος του αλγορίθμου στην επιστημονική κοινότητα
ΕπεξεργασίαΟ αλγόριθμος AlphaFold αποτελεί σπουδαία ανακάλυψη που έφερε την επανάσταση στην πρόβλεψη της τρισδιάστατης δομής των πρωτεϊνών στον τομέα της δομικής βιολογίας [13]. Σύντομα, μετά τη δημοσίευση της αρχιτεκτονικής του αλγορίθμου, η DeepMind και το EMBL-EBI δημιούργησαν τη βάση δεδομένων πρωτεϊνικής δομής του AlphaFold (AlphaFold Protein Structure Database – AlphaFold DB) (https://alphafold.ebi.ac.uk), στην οποία έως σήμερα βρίσκονται καταχωρημένες 214 εκατομμύρια πρωτεϊνικές δομές, ενώ ταυτόχρονα περιλαμβάνουν προβλέψεις για την αναδίπλωση όλου του μήκους πρωτεϊνικών αλληλουχιών σε σχέση με εγγραφές τις Protein Data Bank στις οποίες περιλαμβάνονται τμήματα αυτών[1][14].
Συγκεκριμένα, μέσω της προαναφερόμενης βάσης δεδομένων, οι χρήστες έχουν πρόσβαση σε τρεις διαφορερικούς τύπους δεδομένων που προκύπτουν σαν έξοδος από τον αλγόριθμο AlphaFold2. Αυτά είναι οι συντεταγμένες μοντέλου (model coordinates) , τα μέτρα εμπιστοσύνης (confidence measures - pLDDT scores) και οι προβλεπόμενες βαθμολογίες ευθυγράμμισης σφαλμάτων (predicted aligned error scores - PAE), ενώ ταυτόχρονα παρέχεται γραφική και διαδραστική αναπαράσταση όλων των εγγραφών στην AlphaFold DB. Παράλληλα, για προβλέψεις πρωτεϊνικών δομών οι οποίες δεν είναι καταχωρημένες στη βάση δεδομένων, η DeepMind έχει διαθέσιμο τον κώδικα του AlphaFold2 (https://github.com/deepmind/alphafold/) και ένα διαδραστικό Google Colab (https://bit.ly/alphafoldcolab), ώστε οι χρήστες να μπορούν να διαμορφώσουν τις προβλέψεις του ενδιαφέροντός τους [1]. Αξιοποιώντας τα παραπάνω εφόδια, επιστήμονες διαφόρων κλάδων των βιοεπιστημών (Εικόνα 2), κατάφεραν να αντλήσουν πληροφορίες για τη στερεοδιαμόρφωση των πρωτεϊνών και να οδηγηθούν πιο κοντά στην απάντηση των ερευνητικών τους ερωτημάτων, αποκτώντας νέες δυνατότητες στον τομέα των αναλύσεων [15][1].
Σημαντική είναι, επίσης, και η συνεισφορά των μοντέλων του AlphaFold, στη διδασκαλία της δομικής βιολογίας. Αναλυτικότερα, δίνεται η δυνατότητα στους φοιτητές να αντιληφθούν τη σημασία συγκεκριμένων δομικά εύκαμπτων περιοχών για τη λειτουργία των πρωτεϊνών ενώ παράλληλα, η πρόσβαση σε τέτοια μοντέλα βοηθά στην εκπαίδευση και στην εξάσκηση των βιοεπιστημόνων, όπως δομικών βιολόγων, βιοπληροφορικών, κλπ. [1].
Αξίζει να σημειωθεί, ότι ο AlphaFold αρχικά σχεδιάστηκε ώστε να μπορεί να προβλέψει τη δομή μίας πρωτεΐνης η οποία αποτελείται από μία πολυπεπτιδική αλυσίδα. Γρήγορα, αυτή η δυνατότητα ενισχύθηκε ,καθώς κάποιες αλλαγές στο πρόγραμμα οδήγησαν στο να μπορεί πλέον να προβλεφθεί και η τεταρτοταγής δομή πρωτεϊνών που συνίστανται από παραπάνω από μία υπομονάδες [16]. Έτσι, η ευρεία χρήση του AlphaFold2 και παραλλαγών αυτού, όπως του AlphaFold2-Multimer (χρησιμοποιείται στην πρόβλεψη της δομής συμπλόκων πρωτεϊνών) έδωσε το έναυσμα ώστε να πραγματοποιηθεί μεγάλη πρόοδος στον εν λόγω τομέα. Πλήθος ερευνητών, προκειμένου να προβλέψουν την τρισδιάστατη δομή μεμονωμένων υπομονάδων πρωτεϊνικών συμπλόκων ή και ολόκληρων των συμπλόκων, αξιοποίησαν είτε έτοιμες εκδόσεις του αλγορίθμου είτε προσαρμοσμένες, με τις τελευταίες να μεγαλώνουν αρκετά το εύρος της συλλογής των πιθανών πρωτεϊνικών διαμορφώσεων [17]. Στα πλαίσια αυτής της ανάπτυξης, πλέον, ο εν λόγω αλγόριθμος μπορεί να χρησιμοποιηθεί και για να αναγνωριστούν αλληλεπιδράσεις πρωτεϊνών-πεπτιδίων (protein-peptide interactions) πράγμα που υποδεικνύει πως ο AlphaFold έχει εκπαιδευτεί να αναγνωρίζει δομικά χαρακτηριστικά της στερεοδιαμόρφωσης της πρωτεΐνης (Elofsson, 2023). Επίσης, ο AlphaFold αποτέλεσε την ιδέα πάνω στην οποία βασίστηκαν άλλες μέθοδοι για την πρόβλεψη της αναδίπλωσης πρωτεϊνών, όπως για παράδειγμα το RoseTTAFold, το OpenFold, το UniFold, το OmegaFold και το ESMfold, με τα δύο τελευταία να μοιάζουν αρκετά με το AlphaFold αλλά με τη διαφορά ότι δεν χρησιμοποιούν MSA [16][18][19][20][21][22].
Τέλος, δύο χρόνια μετά το CASP14, πραγματοποιήθηκε το CASP15, όπου η τυπική αρχιτεκτονική AlphaFold παρουσίασε καλύτερη απόδοση σε σχέση με πάνω από τις μισές ομάδες που συμμετείχαν στη συγκεκριμένη αξιολόγηση, ενώ από την άλλη πλευρά, υπήρξαν κάποιες οι οποίες παρουσίασαν βελτιώσεις. Συγκεκριμένα, οι βελτιώσεις αυτές αφορούσαν στην πιο αποτελεσματική χρήση μοντέλων (templates), στην αύξηση της δειγματοληψίας μέσα από εναλλακτικές μεθόδους για τη δημιουργία των MSA ή στην τροποποίηση του αλγόριθμου ώστε να χρησιμοποιεί τους λεγόμενους «dropout» νευρώνες, που κατά τη διάρκεια της εκπαίδευσης των νευρωνικών δικτύων, τυχαία, «αποκλείονται» ή «απενεργοποιούνται» [16].
Εφαρμογές του AlphaFold
ΕπεξεργασίαΗ χρήση του αλγορίθμου AlphaFold έχει οδηγήσει στην ανακάλυψη πάνω από 200 πρωτεϊνικών δομών, οι οποίες έχουν αναδιαμορφώσει τη Δομική Βιολογία και έχουν επηρεάσει θετικά αρκετούς κλάδους της Βιολογίας και της Ιατρικής που βασίζονται σε πληροφορίες της πρωτεϊνικής δομής. Με αυτό τον τρόπο, δίνονται στους ερευνητές τα εργαλεία να λύσουν βασικά ερωτήματα, τα οποία προηγουμένως θεωρούνταν αδύνατον να απαντηθούν. Οι βασικότεροι κλάδοι που έχει εφαρμοστεί το AlphaFold είναι η Δομική Βιολογία, η ανακάλυψη φαρμάκων, ο σχεδιασμός πρωτεϊνών, η πρόβλεψη στόχου, η πρόβλεψη πρωτεϊνικών λειτουργιών, η αλληλεπίδραση πρωτεΐνης -πρωτεΐνης, ο βιολογικός μηχανισμός δράσης κ.ά. [23]
Δομική Βιολογία
ΕπεξεργασίαΗ βάση δεδομένων του AlphaFold 2 (AF2) περιλαμβάνει δομές πρωτεϊνών που πιθανόν να μην έχουν μελετηθεί εκτενώς σε πειραματικές δομές [24]. Με τη χρήση του αλγορίθμου AF2 και της κρυσταλλογραφίας ακτινών-Χ, έχουν αποκαλυφθεί οι δομές πρωτεϊνών ορισμένων ιών, όπως η δομή του τμήματος VP8 της VP4, μίας πρωτεΐνης- ακίδας των ροταϊών ομάδας Β. Ακόμη, με τη χρήση της μεθόδου cryo-EM και του αλγορίθμου AF2, βρέθηκε η δομή της DNA ελικάσης του ιού της δαμαλίτιδας (vaccinia virus), αλλά και του συμπλέγματος σήματος της ιντερλευκίνης-27 (IL-27) [23]. Επιπλέον, ο αλγόριθμος AF2 «κερδίζει» έδαφος και στην πρόβλεψη της δομής συσσωματωμάτων πρωτεϊνών, όπου σχηματίζονται τα αμυλοειδή ινίδια, τα οποία είναι χαρακτηριστικά παθήσεων, όπως η νόσος Αλτσχάιμερ, η νόσος Πάρκινσον και ο σακχαρώδης διαβήτης τύπου 2 και αποτελούν πρόκληση ως προς την πρόβλεψη της δομής τους στις τρεις διαστάσεις [25].
Ανακάλυψη νέων φαρμάκων
ΕπεξεργασίαΟ αλγόριθμος AF2 μπορεί να φανεί εξίσου χρήσιμος στον σχεδιασμό φαρμάκων, που βασίζεται στην δομή και πιο συγκεκριμένα φάρμακα που να στοχεύουν σε πρωτεΐνες των οποίων η δομή είναι ελάχιστα ή καθόλου γνωστή [23]. Παραδείγματος χάρη, μία επιτυχημένη εφαρμογή του AF2 αποτελεί η χρήση προβλέψεων του AF2 από την ομάδα του επιστήμονα Ren το 2023 στις μηχανές σχεδιασμού φαρμάκων μέσω AI, PandaOmics και Chemistry42, και οδηγήθηκαν στην ταχεία ταυτοποίηση ενός μορίου που στοχεύει στην CDK20 (Cyclin-dependent Kinase 20), σε διάστημα μόλις 30 ημερών από την ημέρα επιλογής του στόχου και με τη σύνθεση μόνο επτά διαφορετικών παραλλαγών της ένωσης [26]. Επιπλέον, ο αλγόριθμος AF2 εφαρμόστηκε με επιτυχία από τον Weng και την ομάδα του για την πρόβλεψη της τρισδιάστατης δομής (3D) της πρωτεΐνης WSB1, η οποία αποτελείται από επαναλαμβανόμενες δομές WD40 στο Ν-τελικό άκρο της και τη δομή SOCS-box στο C-τελικό άκρο. Η πρωτεΐνη WSB1 έχει βρεθεί ότι προάγει την εξέλιξη ενός όγκου σε διάφορους τύπους καρκίνου μέσω της καταστολής της ογκοκατασταλτικής πρωτεΐνης pVHL. Επομένως, η πρωτεΐνη αυτή αποτελεί έναν νέο πιθανό αντικαρκινικό στόχο, όπου η 3D δομή της χρησιμοποιήθηκε ως υποδοχέας για να εντοπιστούν οι αναστολείς της [27].
Σχεδιασμός πρωτεϊνών
ΕπεξεργασίαΟ σχεδιασμός εξ’ ολοκλήρου πρωτεϊνών που δεν υπάρχουν στη φύση αποτελεί έναν μεγάλο στόχο της Δομικής Βιολογίας, ο οποίος είναι εφικτός με τη χρήση του αλγορίθμου AF2, καθώς και άλλων αλγορίθμων μηχανικής εκμάθησης [23]. Παραδείγματος χάρη, ο Jendrusch και οι συνεργάτες του δημιούργησαν ένα υπολογιστικό πλαίσιο για τον σχεδιασμό πρωτεϊνών de novo, που ονομάζεται AlphaDesign και ενσωματώνει τον αλγόριθμο AlphaFold 2 ως εργαλείο για την βελτιστοποίηση της διαδικασίας του σχεδιασμού. Πιο συγκεκριμένα, το AlphaDesign επεκτείνει τις ήδη υπάρχουσες έρευνες πάνω στον πρωτεϊνικό σχεδιασμό και επιτρέπει την πρόβλεψη νέων πρωτεϊνικών μονομερών, ξεκινώντας από τυχαίες αλληλουχίες, με αποτέλεσμα να δημιουργείται ένα εύρος προβλέψεων για μονομερή, ομοδιμερή, ετεροδιμερή, καθώς και υψηλής τάξεως ομο-ολιγομερή-τριμερή έως και εξαμερή [28].
Πρόβλεψη στόχου
ΕπεξεργασίαΗ ικανότητα πρόβλεψης του στόχου των πρωτεϊνών είναι πολύ σημαντική τόσο για την κατανόηση της λειτουργίας των φυσιολογικών παθολογικών διεργασιών, όσο για τον εντοπισμό νέων φαρμακευτικών στόχων και για την επαρκή αξιολόγηση της επιλεκτικότητας των φαρμάκων [23]. Ο αλγόριθμος AlphaFold 2 φαίνεται χρήσιμος και σε αυτό το πεδίο, με παράδειγμα τη δημιουργία της βάσης δεδομένων CavitySpace από την ομάδα του Wang, η οποία χρησιμοποιώντας τις προβλέψεις των 3D δομών των πρωτεϊνών από τον AlphaFold 2, περιλαμβάνει όλες τις πρωτεΐνες του ανθρώπινου πρωτεώματος, κάνοντας χρήση του προγράμματος CAVITY που ανιχνεύει τα σημεία σύνδεσης των πρωτεϊνικών- προσδετών. Αναλυτικότερα, το CavitySpace μπορεί να εφαρμοστεί στην ταυτοποίηση νέων στόχων για γνωστά φάρμακα στα πλαίσια του επαναπροσδιορισμού των φαρμάκων ή στην έρευνα για τις παρενέργειες που προκαλούν [29].
Πρόβλεψη πρωτεϊνικής λειτουργίας
ΕπεξεργασίαΜέχρι και σήμερα υπάρχουν πολλές πρωτεΐνες στη φύση των οποίων η λειτουργία παραμένει άγνωστη και δεδομένου ότι η τρισδιάστατη δομή των πρωτεϊνών προσδιορίζει απολύτως την λειτουργικότητά τους, οι επιστήμονες χρησιμοποιούν αυτό το χαρακτηριστικό για την δημιουργία μοντέλων πρόβλεψης της λειτουργίας των πρωτεϊνών καθοδηγούμενα από δεδομένα, συμπεριλαμβανομένων των 3D δομών που έχουν προέλθει από τον AlphaFold 2. Έχοντας αυτά τα δεδομένα, ο Ma και οι συνεργάτες του διερεύνησαν αυτή τη θεωρία κα δημιούργησαν ένα σετ δεδομένων αναφοράς με σκοπό τη σύγκριση της δομής δειγμάτων που έχουν λυθεί πειραματικά, με εκείνες των πρωτεϊνών που έχουν λυθεί μέσω του AlphaFold 2, με αποτέλεσμα να προκύψει ένα νέο σημείο αναφοράς για την πρόβλεψη της λειτουργίας των πρωτεϊνών βασιζόμενη στη δομή τους. Στη συνέχεια, δημιούργησαν μία μέθοδο πρόβλεψης με τη χρήση του PyTorch και μετά από ανάλυση των δεδομένων τους κατέληξαν στο συμπέρασμα ότι η χρήση δεδομένων από τον AlphaFold 2 για την πρόβλεψη της λειτουργίας των πρωτεϊνών είναι εξίσου χρήσιμη με τη χρήση πειραματικών δομών [30].
Αλληλεπίδραση πρωτεΐνης- πρωτεΐνης
ΕπεξεργασίαΜε τον όρο της αλληλεπίδρασης πρωτεΐνης- πρωτεΐνης (Protein- Protein Interaction, PPI) αναφερόμαστε σε μία διεργασία κατά την οποία δύο πρωτεΐνες σχηματίζουν μεταξύ τους μη ομοιοπολικούς δεσμούς προκειμένου να σχηματιστούν πρωτεϊνικά σύμπλοκα για να πραγματοποιήσουν τις λειτουργίες τους. Και σε αυτό το πεδίο ο αλγόριθμος του AlphaFold 2 μπορεί να φανεί εξίσου χρήσιμος, καθώς υπάρχει ανάγκη για την πρόβλεψη της δομής αυτών των πρωτεϊνικών συμπλόκων [23]. Ένα παράδειγμα αποτελεί το σύστημα AlphaFold-Multimer που δημιουργήθηκε από την ομάδα του Evans προκειμένου να προβλέπει τη δομή πρωτεϊνικών συμπλόκων πολλαπλών αλυσίδων[31] . Με τη χρήση αυτού του συστήματος έχουν λυθεί οι δομές σε πάνω από 4000 πρωτεϊνικά σύμπλοκα, όπως η δομή των ετεροδιμερών του CYP102A1 από την ομάδα του Ivanov [32].
Βιολογικός μηχανισμός δράσης
ΕπεξεργασίαΗ ανακάλυψη του βιολογικού μηχανισμού της δράσης μιας πρωτεΐνης είναι απαραίτητη σε διάφορα πεδία, όπως τη μελέτη της αλληλεπίδρασης ενός φαρμάκου με τον στόχο του. Ο αλγόριθμος του AlphaFold 2 προτείνει έναν εναλλακτικό τρόπο έρευνας, καθώς οι μοριακές μέθοδοι σύνδεσης που χρησιμοποιούνται βασίζονται σε ήδη υπάρχουσες πρωτεϊνικές δομές [23]. Αναφορικά αυτού του τρόπου, ο επιστήμονας Wong και οι συνεργάτες του συνδύασαν τις μεθόδους προσομοίωσης μοριακής σύνδεσης με τον αλγόριθμο AlphaFold 2 και πρόβλεψαν επιτυχώς τις αλληλεπιδράσεις μεταξύ 296 πρωτεϊνών που καλύπτουν το βασικό πρωτέωμα του Escherichia coli, καθώς και 218 ενεργών και 100 ανενεργών αντιβακτηριδιακών ενώσεων [33]. Επιπρόσθετα, μία ακόμη εφαρμογή του AF2 για την ανακάλυψη του βιολογικού μηχανισμού δράσης αποτελεί η εύρεση μίας νέας κατάστασης Β, η οποία επιτρέπει την μεταφορά ηλεκτρονίων μεταξύ των FADs και των πρωτεϊνών EtfAB που συμβαίνει σε ορισμένα αναερόβια βακτήρια κατά την οξείδωση του γαλακτικού οξέος [34]. Ακόμη, ο Liang και η ομάδα του μελέτησαν τον μηχανισμό του καθορισμού και της αναγνώρισης του υποστρώματος από την πρωτεΐνη σεπαράση, μία υπερμεγέθη πρωτεάση της κυστεΐνης, με τη χρήση του AF2 και προσομοιώσεων μοριακής δυναμικής και ανακάλυψαν ένα συντηρημένο τμήμα του υποδοχέα της σεπαράσης, του οποίου η σύνδεση με τη σεπαράση είναι αμοιβαίως αποκλειστική και απαιτεί αλλαγή στη διαμόρφωση της πρωτεΐνης [35]. Επομένως, με τη χρήση του AF2, μπορούν να δοθούν απαντήσεις στην βαθύτερη κατανόηση πολλών άγνωστων μέχρι τώρα μηχανισμών δράσης πρωτεϊνών.
Περιορισμοί
ΕπεξεργασίαΟ αλγόριθμος του AlphaFold 2 έχει πολυάριθμες εφαρμογές και οφέλη, ωστόσο υπάρχουν ακόμη ορισμένα σημεία στα οποία υστερεί και επιδέχεται βελτιώσεων. Πιο συγκεκριμένα, ένα βασικό μειονέκτημα του AF2 είναι ότι ενώ το AlphaFold- Multimer έχει την ικανότητα, όπως προαναφέρθηκε, να προβλέψει τόσο ομομερείς όσο και ετεροδιμερείς διεπαφές των πρωτεϊνικών δομών, ταυτόχρονα δεν μπορεί να προβλέψει άλλα σημαντικά χαρακτηριστικά της πρωτεϊνικής δομής, όπως είναι τα μεταλλικά ιόντα, οι συμπαράγοντες και άλλοι προσδέτες [36]. Ακόμη, ο AF2 δεν μπορεί να προβλέψει τα χαρακτηριστικά της «επιγενετικής διάστασης της πρωτεϊνικής δομής, τα οποία περιλαμβάνουν τις μετα-μεταφραστικές τροποποιήσεις, όπως τη φωσφορυλίωση ή τη γλυκοζυλίωση που μπορούν να προβλεφθούν από συγκεκριμένα μοτίβα της πρωτεϊνικής αλληλουχίας. Ένα χαρακτηριστικό παράδειγμα αποτελούν οι μεμβρανικές πρωτεΐνες, καθώς συγκεκριμένα λιπίδια λειτουργούν ως συμπαράγοντες για την αναδίπλωση και τη σταθερότητα της πρωτεΐνης. Αυτό αποτελεί σημαντικό μειονέκτημα του AF2, καθώς πολλές μεμβρανικές πρωτεΐνες παίζουν βασικό ρόλο σε ανθρώπινες παθολογίες [37]. Επιπλέον, ένας περιορισμός του AF2 είναι ότι δεδομένου ότι βασίζεται στη μέθοδο της στοίχισης πολλαπλών αλληλουχιών (Multiple Sequence Alignment, MSA), τα αποτελέσματά του βασίζονται στην ήδη υπάρχουσα γνώση μας και σε συγκεκριμένα σετ δεδομένων, όπως η PDB [4][38]. Επίσης, επειδή ο AF2 έχει εκπαιδευτεί με βάση δεδομένα της PDB, είναι πιθανόν να μην περιλαμβάνει τις δομές των πρωτεϊνών στην κατάσταση αναδίπλωσης που υπάρχουν στη φύση, καθώς κάποιες αναδιπλώσεις που υπάρχουν στην PDB συμβαίνουν κάτω από συγκεκριμένες συνθήκες, όπως η παρουσία μιας άλλης πρωτεΐνης. Σε αυτή την περίπτωση, ο AF2 θα προβλέψει την αναδίπλωση μιας πρωτεΐνης με βάση το πώς αυτή βρίσκεται στην PDB και δεν θα μπορέσει να εντοπίσει τις συνθήκες κάτω από τις οποίες πραγματοποιείται. Αυτό το πρόβλημα είναι αρκετά ορατό σε πρωτεΐνες που διαθέτουν πολλαπλές εγγενείς δομές[38]. Για παράδειγμα, ο AF2 μπορεί να προβλέψει την αναδίπλωση της αλυσίδας της αιμοσφαιρίνης, όμως η έλλειψη είτε της αίμης, είτε ενός από τα μέλη που βοηθούν στον σχηματισμό του τετραμερούς, που είναι απαραίτητα για την αναδίπλωση, δεν θα σταματούσαν τον AF2 από το να προβλέψει την αναδίπλωση της α-αλυσίδας. Επομένως, ο AF2 προτείνει μία πρακτική λύση αναδίπλωσης και αγνοεί τις ενεργειακές συνθήκες που απαιτούνται για την αναδίπλωση της αιμοσφαιρίνης σε ένα πραγματικό κύτταρο και σαν αποτέλεσμα προβλέπει την αναδίπλωση μιας μονής αλυσίδας της αιμοσφαιρίνης που από μόνη της δεν μπορεί να σταθεί στη φύση[36]. Επιπρόσθετα, υπάρχουν κάποιες πρωτεΐνες στη φύση που ονομάζονται IDPs (intrinsically disordered proteins), οι οποίες δεν έχουν κάποια καθορισμένη δομή ή έχουν τουλάχιστον ένα διαταραγμένο τμήμα. Οι πρωτεΐνες αυτές αντιπροσωπεύουν το 40% των πρωτεϊνών στους ευκαρυώτες και αποτελούν το “unfoldome”, δηλαδή το σύνολο των πρωτεϊνών που δεν αναδιπλώνονται. Οι πρωτεΐνες αυτές, οι οποίες παίζουν σημαντικό ρόλο σε αρκετές βιολογικές διεργασίες, όπως η ρύθμιση της γονιδιακής έκφρασης ή η κυτταρική διαίρεση, αποτελούν ένα βασικό περιορισμό για τον αλγόριθμο του AlphaFold [37]. Τέλος, όσον αφορά τον κλάδο της ανακάλυψης νέων φαρμάκων, ο αλγόριθμος AF2 αντιμετωπίζει δυσκολίες στην ανακάλυψη φαρμάκων, διότι οι κρυσταλλικές δομές που προσφέρουν τα μοντέλα του αποτελούν ένα στιγμιότυπο της δομής των πρωτεϊνών, οι οποίες στην πραγματικότητα αποτελούνται από ένα σύνολο συνεχόμενων αλλαγών στη διαμόρφωσή τους. Ο αλγόριθμος συνδέει το επίπεδο εμπιστοσύνης των προβλεπόμενων δομών των διαφορετικών τμημάτων των πρωτεϊνών και κατατάσσει τα μοντέλα με βάση αυτή την εκτίμηση. Επομένως, αν και είναι χρήσιμο για κάποιον που συνήθως επιλέγει μία ένωση με βάση την υψηλότερη βαθμολογία, αυτή η κατάταξη δεν βασίζεται σε φυσικές αρχές και δεν αντιπροσωπεύει δυναμικές καταστάσεις. Συμπερασματικά λοιπόν, ο AF2 δεν έχει την ικανότητα να σκανάρει τον ευρύ περίπλοκο χώρο, κάτι που αντιτάσσεται στην φύση του. Ακόμη, αποτελεί πρόκληση για τον AF2 να αναγνωρίσει τις δεσμευτικές τοποθεσίες στις οποίες προσδένονται τα φάρμακα με αλλοστερικό μηχανισμό, καθώς απαιτείται να αναγνωριστούν οι αλληλεπιδράσεις που προκαλούν την αλλοστερική αλλαγή στην πρωτεΐνη. Επιπλέον, είναι δύσκολη η αναγνώριση των «δεσμευτικών τσεπών», δηλαδή το τμήμα της πρωτεΐνης που αλληλεπιδρά με τα φάρμακα, καθώς αποτελεί ακρίβεια και εξειδίκευση, κάτι που αποτελεί ακόμη πρόκληση για τις μεθόδους που βασίζονται στον αλγόριθμο AF2 [39].
Παραπομπές
Επεξεργασία- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 1,6 1,7 Varadi, Mihaly; Velankar, Sameer (2023-09). «The impact of AlphaFold Protein Structure Database on the fields of life sciences» (στα αγγλικά). PROTEOMICS 23 (17). doi:. ISSN 1615-9853. https://analyticalsciencejournals.onlinelibrary.wiley.com/doi/10.1002/pmic.202200128.
- ↑ Azulay, Hay; Lutaty, Aviv; Qvit, Nir (2022-04-21). «How Similar Are Proteins and Origami?» (στα αγγλικά). Biomolecules 12 (5): 622. doi:. ISSN 2218-273X. PMID 35625549. PMC PMC9138822. https://www.mdpi.com/2218-273X/12/5/622.
- ↑ Gianni, Stefano; Jemth, Per (2016-05). «Protein folding: Vexing debates on a fundamental problem». Biophysical Chemistry 212: 17–21. doi:. ISSN 0301-4622. https://doi.org/10.1016/j.bpc.2016.03.001.
- ↑ 4,0 4,1 4,2 Marcu, Ştefan-Bogdan; Tăbîrcă, Sabin; Tangney, Mark (2022-06-09). «An Overview of Alphafold's Breakthrough» (στα English). Frontiers in Artificial Intelligence 5. doi:. ISSN 2624-8212. PMID 35757294. PMC PMC9218062. https://www.frontiersin.org/articles/10.3389/frai.2022.875587.
- ↑ Ivankov, Dmitry N.; Finkelstein, Alexei V. (2020-02-06). «Solution of Levinthal’s Paradox and a Physical Theory of Protein Folding Times» (στα αγγλικά). Biomolecules 10 (2): 250. doi:. ISSN 2218-273X. PMID 32041303. PMC PMC7072185. https://www.mdpi.com/2218-273X/10/2/250.
- ↑ Anfinsen, Christian B. (1973-07-20). «Principles that Govern the Folding of Protein Chains» (στα αγγλικά). Science 181 (4096): 223–230. doi:. ISSN 0036-8075. https://www.science.org/doi/10.1126/science.181.4096.223.
- ↑ Hirata, Fumio; Sugita, Masatake; Yoshida, Masasuke; Akasaka, Kazuyuki (2018-01-14). «Perspective: Structural fluctuation of protein and Anfinsen’s thermodynamic hypothesis» (στα αγγλικά). The Journal of Chemical Physics 148 (2). doi:. ISSN 0021-9606. https://pubs.aip.org/jcp/article/148/2/020901/196312/Perspective-Structural-fluctuation-of-protein-and.
- ↑ «Κρίστιαν Άνφινσεν». Βικιπαίδεια. 2020-02-06. https://el.wikipedia.org/w/index.php?title=%CE%9A%CF%81%CE%AF%CF%83%CF%84%CE%B9%CE%B1%CE%BD_%CE%86%CE%BD%CF%86%CE%B9%CE%BD%CF%83%CE%B5%CE%BD&oldid=8027417.
- ↑ Kryshtafovych, Andriy; Schwede, Torsten; Topf, Maya; Fidelis, Krzysztof; Moult, John (2019-12). «Critical assessment of methods of protein structure prediction (CASP)—Round XIII» (στα αγγλικά). Proteins: Structure, Function, and Bioinformatics 87 (12): 1011–1020. doi:. ISSN 0887-3585. https://onlinelibrary.wiley.com/doi/10.1002/prot.25823.
- ↑ 10,0 10,1 10,2 «DeepMind's protein-folding AI has solved a 50-year-old grand challenge of biology». MIT Technology Review (στα Αγγλικά). Ανακτήθηκε στις 25 Μαΐου 2024.
- ↑ Kriegeskorte, Nikolaus; Golan, Tal (2019-04). «Neural network models and deep learning» (στα αγγλικά). Current Biology 29 (7): R231–R236. doi:. https://linkinghub.elsevier.com/retrieve/pii/S0960982219302040.
- ↑ «Foldit». fold.it. Ανακτήθηκε στις 25 Μαΐου 2024.
- ↑ David, Alessia; Islam, Suhail; Tankhilevich, Evgeny; Sternberg, Michael J.E. (2022-01). «The AlphaFold Database of Protein Structures: A Biologist’s Guide». Journal of Molecular Biology 434 (2): 167336. doi:. ISSN 0022-2836. PMID 34757056. PMC PMC8783046. https://doi.org/10.1016/j.jmb.2021.167336.
- ↑ Varadi, Mihaly; Bertoni, Damian; Magana, Paulyna; Paramval, Urmila; Pidruchna, Ivanna; Radhakrishnan, Malarvizhi; Tsenkov, Maxim; Nair, Sreenath και άλλοι. (2024-01-05). «AlphaFold Protein Structure Database in 2024: providing structure coverage for over 214 million protein sequences» (στα αγγλικά). Nucleic Acids Research 52 (D1): D368–D375. doi:. ISSN 0305-1048. PMID 37933859. PMC PMC10767828. https://academic.oup.com/nar/article/52/D1/D368/7337620.
- ↑ Varadi, Mihaly; Anyango, Stephen; Deshpande, Mandar; Nair, Sreenath; Natassia, Cindy; Yordanova, Galabina; Yuan, David; Stroe, Oana και άλλοι. (2022-01-07). «AlphaFold Protein Structure Database: massively expanding the structural coverage of protein-sequence space with high-accuracy models» (στα αγγλικά). Nucleic Acids Research 50 (D1): D439–D444. doi:. ISSN 0305-1048. PMID 34791371. PMC PMC8728224. https://academic.oup.com/nar/article/50/D1/D439/6430488.
- ↑ 16,0 16,1 16,2 Elofsson, Arne (2023-06). «Progress at protein structure prediction, as seen in CASP15». Current Opinion in Structural Biology 80: 102594. doi:. ISSN 0959-440X. https://doi.org/10.1016/j.sbi.2023.102594.
- ↑ Lensink, Marc F.; Brysbaert, Guillaume; Raouraoua, Nessim; Bates, Paul A.; Giulini, Marco; Honorato, Rodrigo V.; van Noort, Charlotte; Teixeira, Joao M. C. και άλλοι. (2023-12). «Impact of AlphaFold on structure prediction of protein complexes: The CASP15‐CAPRI experiment» (στα αγγλικά). Proteins: Structure, Function, and Bioinformatics 91 (12): 1658–1683. doi:. ISSN 0887-3585. PMID 37905971. PMC PMC10841881. https://onlinelibrary.wiley.com/doi/10.1002/prot.26609.
- ↑ Baek, Minkyung; DiMaio, Frank; Anishchenko, Ivan; Dauparas, Justas; Ovchinnikov, Sergey; Lee, Gyu Rie; Wang, Jue; Cong, Qian και άλλοι. (2021-08-20). «Accurate prediction of protein structures and interactions using a three-track neural network» (στα αγγλικά). Science 373 (6557): 871–876. doi:. ISSN 0036-8075. PMID 34282049. PMC PMC7612213. https://www.science.org/doi/10.1126/science.abj8754.
- ↑ Ahdritz, Gustaf; Bouatta, Nazim; Floristean, Christina; Kadyan, Sachin; Xia, Qinghui; Gerecke, William; O’Donnell, Timothy J.; Berenberg, Daniel και άλλοι. (2023-08-12). «OpenFold: Retraining AlphaFold2 yields new insights into its learning mechanisms and capacity for generalization» (στα αγγλικά). bioRxiv: 2022.11.20.517210. doi:. https://www.biorxiv.org/content/10.1101/2022.11.20.517210v3.
- ↑ Wu, Ruidong; Ding, Fan; Wang, Rui; Shen, Rui; Zhang, Xiwen; Luo, Shitong; Su, Chenpeng; Wu, Zuofan και άλλοι. (2022-07-22). «High-resolution de novo structure prediction from primary sequence» (στα αγγλικά). bioRxiv: 2022.07.21.500999. doi:. https://www.biorxiv.org/content/10.1101/2022.07.21.500999v1.
- ↑ Lin, Zeming; Akin, Halil; Rao, Roshan; Hie, Brian; Zhu, Zhongkai; Lu, Wenting; Smetanin, Nikita; Verkuil, Robert και άλλοι. (2022-12-21). «Evolutionary-scale prediction of atomic level protein structure with a language model» (στα αγγλικά). bioRxiv: 2022.07.20.500902. doi:. https://www.biorxiv.org/content/10.1101/2022.07.20.500902v3.
- ↑ Li, Ziyao; Liu, Xuyang; Chen, Weijie; Shen, Fan; Bi, Hangrui; Ke, Guolin; Zhang, Linfeng (2022-08-30). «Uni-Fold: An Open-Source Platform for Developing Protein Folding Models beyond AlphaFold» (στα αγγλικά). bioRxiv: 2022.08.04.502811. doi:. https://www.biorxiv.org/content/10.1101/2022.08.04.502811v3.
- ↑ 23,0 23,1 23,2 23,3 23,4 23,5 23,6 Yang, Zhenyu; Zeng, Xiaoxi; Zhao, Yi; Chen, Runsheng (2023-03-14). «AlphaFold2 and its applications in the fields of biology and medicine» (στα αγγλικά). Signal Transduction and Targeted Therapy 8 (1). doi:. ISSN 2059-3635. PMID 36918529. PMC PMC10011802. https://www.nature.com/articles/s41392-023-01381-z.
- ↑ Akdel, Mehmet; Pires, Douglas E. V.; Pardo, Eduard Porta; Jänes, Jürgen; Zalevsky, Arthur O.; Mészáros, Bálint; Bryant, Patrick; Good, Lydia L. και άλλοι. (2022-11). «A structural biology community assessment of AlphaFold2 applications» (στα αγγλικά). Nature Structural & Molecular Biology 29 (11): 1056–1067. doi:. ISSN 1545-9993. PMID 36344848. PMC PMC9663297. https://www.nature.com/articles/s41594-022-00849-w.
- ↑ Pinheiro, Francisca; Santos, Jaime; Ventura, Salvador (2021-10). «AlphaFold and the amyloid landscape». Journal of Molecular Biology 433 (20): 167059. doi:. ISSN 0022-2836. https://doi.org/10.1016/j.jmb.2021.167059.
- ↑ Ren, Feng; Ding, Xiao; Zheng, Min; Korzinkin, Mikhail; Cai, Xin; Zhu, Wei; Mantsyzov, Alexey; Aliper, Alex και άλλοι. (2023). «AlphaFold accelerates artificial intelligence powered drug discovery: efficient discovery of a novel CDK20 small molecule inhibitor» (στα αγγλικά). Chemical Science 14 (6): 1443–1452. doi:. ISSN 2041-6520. PMID 36794205. PMC PMC9906638. https://xlink.rsc.org/?DOI=D2SC05709C.
- ↑ Weng, Ye; Pan, Chenghao; Shen, Zheyuan; Chen, Sikang; Xu, Lei; Dong, Xiaowu; Chen, Jing (2022-05-13). Xie, Danli, επιμ. «Identification of Potential WSB1 Inhibitors by AlphaFold Modeling, Virtual Screening, and Molecular Dynamics Simulation Studies» (στα αγγλικά). Evidence-Based Complementary and Alternative Medicine 2022: 1–11. doi:. ISSN 1741-4288. https://www.hindawi.com/journals/ecam/2022/4629392/.
- ↑ Jendrusch, Michael (2021). «AlphaDesign: A de novo protein design framework based on AlphaFold». bioRxiv. doi:. https://doi.org/10.1101/2021.10.11.463937.
- ↑ Wang, Shiwei; Lin, Haoyu; Huang, Zhixian; He, Yufeng; Deng, Xiaobing; Xu, Youjun; Pei, Jianfeng; Lai, Luhua (2022-07-11). «CavitySpace: A Database of Potential Ligand Binding Sites in the Human Proteome» (στα αγγλικά). Biomolecules 12 (7): 967. doi:. ISSN 2218-273X. PMID 35883523. PMC PMC9312471. https://www.mdpi.com/2218-273X/12/7/967.
- ↑ Ma, Wenjian; Zhang, Shugang; Li, Zhen; Jiang, Mingjian; Wang, Shuang; Lu, Weigang; Bi, Xiangpeng; Jiang, Huasen και άλλοι. (2022-09-12). «Enhancing Protein Function Prediction Performance by Utilizing AlphaFold-Predicted Protein Structures» (στα αγγλικά). Journal of Chemical Information and Modeling 62 (17): 4008–4017. doi:. ISSN 1549-9596. https://pubs.acs.org/doi/10.1021/acs.jcim.2c00885.
- ↑ Evans, Richard (2021). «Protein complex prediction with AlphaFold-Multimer». bioRxiv. doi:. https://doi.org/10.1101/2021.10.04.463034.
- ↑ Ivanov, Yuri D.; Taldaev, Amir; Lisitsa, Andrey V.; Ponomarenko, Elena A.; Archakov, Alexander I. (2022-02-18). «Prediction of Monomeric and Dimeric Structures of CYP102A1 Using AlphaFold2 and AlphaFold Multimer and Assessment of Point Mutation Effect on the Efficiency of Intra- and Interprotein Electron Transfer» (στα αγγλικά). Molecules 27 (4): 1386. doi:. ISSN 1420-3049. PMID 35209175. PMC PMC8874714. https://www.mdpi.com/1420-3049/27/4/1386.
- ↑ Wong, Felix; Krishnan, Aarti; Zheng, Erica J; Stärk, Hannes; Manson, Abigail L; Earl, Ashlee M; Jaakkola, Tommi; Collins, James J (2022-09). «Benchmarking AlphaFold ‐enabled molecular docking predictions for antibiotic discovery» (στα αγγλικά). Molecular Systems Biology 18 (9). doi:. ISSN 1744-4292. https://www.embopress.org/doi/10.15252/msb.202211081.
- ↑ Weghoff, Marie Charlotte; Bertsch, Johannes; Müller, Volker (2015-03). «A novel mode of lactate metabolism in strictly anaerobic bacteria» (στα αγγλικά). Environmental Microbiology 17 (3): 670–677. doi:. ISSN 1462-2912. https://sfamjournals.onlinelibrary.wiley.com/doi/10.1111/1462-2920.12493.
- ↑ Liang, Miaomiao; Chen, Xu; Zhu, Cheng; Liang, Xiaoge; Gao, Zhuoqun; Luo, Shukun (2022-09). «Identification of a novel substrate motif of yeast separase and deciphering the recognition specificity using AlphaFold2 and molecular dynamics simulation». Biochemical and Biophysical Research Communications 620: 173–179. doi:. ISSN 0006-291X. https://doi.org/10.1016/j.bbrc.2022.06.056.
- ↑ 36,0 36,1 Perrakis, Anastassis; Sixma, Titia K (2021-11-04). «AI revolutions in biology: The joys and perils of AlphaFold» (στα αγγλικά). EMBO reports 22 (11). doi:. ISSN 1469-221X. PMID 34668287. PMC PMC8567224. https://www.embopress.org/doi/10.15252/embr.202154046.
- ↑ 37,0 37,1 Azzaz, Fodil; Yahi, Nouara; Chahinian, Henri; Fantini, Jacques (2022-10-20). «The Epigenetic Dimension of Protein Structure Is an Intrinsic Weakness of the AlphaFold Program» (στα αγγλικά). Biomolecules 12 (10): 1527. doi:. ISSN 2218-273X. https://www.mdpi.com/2218-273X/12/10/1527.
- ↑ 38,0 38,1 Niazi, Sarfaraz K.; Mariam, Zamara; Paracha, Rehan Z. (2024-01-08). «Limitations of Protein Structure Prediction Algorithms in Therapeutic Protein Development» (στα αγγλικά). BioMedInformatics 4 (1): 98–112. doi:. ISSN 2673-7426. https://www.mdpi.com/2673-7426/4/1/7.
- ↑ Nussinov, Ruth; Zhang, Mingzhen; Liu, Yonglan; Jang, Hyunbum (2023-06). «AlphaFold, allosteric, and orthosteric drug discovery: Ways forward». Drug Discovery Today 28 (6): 103551. doi:. ISSN 1359-6446. https://doi.org/10.1016/j.drudis.2023.103551.
Περαιτέρω ανάγνωση
Επεξεργασία- Carlos Outeiral, CASP14: what Google DeepMind's AlphaFold 2 really achieved, and what it means for protein folding, biology and bioinformatics, Oxford Protein Informatics Group. (3 December)
- Mohammed AlQuraishi, AlphaFold2 @ CASP14: "It feels like one's child has left home." (blog), 8 December 2020
- Mohammed AlQuraishi, The AlphaFold2 Method Paper: A Fount of Good Ideas (blog), 25 July 2021
Εξωτερικοί σύνδεσμοι
Επεξεργασία- AlphaFold-3 web server
- Open access to protein structure predictions for the human proteome and 20 other key organisms at European Bioinformatics Institute (AlphaFold Protein Structure Database)
- CASP 14 website
- AlphaFold: The making of a scientific breakthrough, DeepMind, via YouTube.
- ColabFold (Mirdita, Milot; Schütze, Konstantin; Moriwaki, Yoshitaka; Heo, Lim; Ovchinnikov, Sergey; Steinegger, Martin (2022-05-30). «ColabFold: Making protein folding accessible to all» (στα αγγλικά). Nature Methods 19 (6): 679–682. doi:. PMID 35637307.), version for homooligomeric prediction and complexes