Δαπαγλιφλοζίνη
Η δαπαγλιφλοζίνη, που πωλείται με την εμπορική ονομασία Fοrxiga, μεταξύ άλλων, είναι φάρμακο που χρησιμοποιείται για τη θεραπεία του διαβήτη τύπου 2 και, με ορισμένους περιορισμούς, του διαβήτη τύπου 1.[2] Χρησιμοποιείται επίσης για τη θεραπεία ενηλίκων με καρδιακή ανεπάρκεια με μειωμένο κλάσμα εξώθησης για τη μείωση του κινδύνου καρδιαγγειακού θανάτου και νοσηλεία για καρδιακή ανεπάρκεια.[3]
 | |||
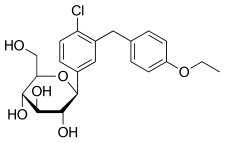 Προβολή Haworth (κάτω) | |||
| |||
| Ονομασία IUPAC | |||
|---|---|---|---|
(2S,3R,4R,5S,6R)-2-[4-Chloro-3-(4-ethoxybenzyl)phenyl]-6-(hydroxymethyl)tetrahydro-2H-pyran-3,4,5-triol | |||
| Κλινικά δεδομένα | |||
| Εμπορικές ονομασίες | Forxiga, Farxiga, Edistride, άλλες | ||
| AHFS/Drugs.com | monograph | ||
| Δεδομένα άδειας |
| ||
| Κατηγορία ασφαλείας κύησης | |||
| Οδοί χορήγησης | Από το στόμα | ||
| Κυκλοφορία | |||
| Κυκλοφορία |
| ||
| Φαρμακοκινητική | |||
| Βιοδιαθεσιμότητα | 78% (μετά από δόση 10 mg) | ||
| Πρωτεϊνική σύνδεση | ~91% | ||
| Μεταβολισμός | UGT1A9 (κυρίως), CYP | ||
| Μεταβολίτες | Dapagliflozin 3-O-glucuronide (inactive) | ||
| Βιολογικός χρόνος ημιζωής | ~12,9 ώρες | ||
| Απέκκριση | Ούρα (75%), κόπρανα (21%)[2] | ||
| Κωδικοί | |||
| Αριθμός CAS | 461432-26-8 | ||
| Κωδικός ATC | A10BK01 | ||
| PubChem | CID 9887712 | ||
| IUPHAR/BPS | 4594 | ||
| DrugBank | DB06292 | ||
| ChemSpider | 8063384 | ||
| UNII | 1ULL0QJ8UC | ||
| KEGG | D08897 | ||
| ChEBI | CHEBI:85078 | ||
| ChEMBL | CHEMBL429910 | ||
| Συνώνυμα | BMS-512148; (1S)-1,5-anhydro-1-C-{4-chloro-3-[(4-ethoxyphenyl)methyl]phenyl}-D-glucitol | ||
| Χημικά στοιχεία | |||
| Χημικός τύπος | C21H25ClO6 | ||
| Μοριακή μάζα | 408,88 g·mol−1 | ||
Clc1ccc(cc1Cc2ccc(OCC)cc2)[C@@H]3O[C@H](CO)[C@@H](O)[C@H](O)[C@H]3O | |||
InChI=1S/C21H25ClO6/c1-2-27-15-6-3-12(4-7-15)9-14-10-13(5-8-16(14)22)21-20(26)19(25)18(24)17(11-23)28-21/h3-8,10,17-21,23-26H,2,9,11H2,1H3/t17-,18-,19+,20-,21+/m1/s1 Key:JVHXJTBJCFBINQ-ADAARDCZSA-N | |||
| (verify) | |||
Η πιο συχνή ανεπιθύμητη ενέργεια σε άτομα με διαβήτη τύπου 2 είναι η υπογλυκαιμία, ειδικά όταν χρησιμοποιείται σε συνδυασμό με σουλφονυλουρία ή ινσουλίνη.[4] Η πιο συχνή ανεπιθύμητη ενέργεια σε άτομα με διαβήτη τύπου 1 είναι η μόλυνση των γεννητικών οργάνων, ειδικά στις γυναίκες και μια συχνή ανεπιθύμητη ενέργεια είναι η διαβητική κετοξέωση. Είναι της κατηγορίας γλιφλοζίνης (αναστολέας SGLT2).[2]
Αναπτύχθηκε από την Bristol-Myers Squibb σε συνεργασία με την AstraZeneca. Το 2017, ήταν η 259η πιο συχνά συνταγογραφούμενη φαρμακευτική αγωγή στις Ηνωμένες Πολιτείες, με περισσότερες από ένα εκατομμύριο συνταγές.[5][6]
Ιατρικές χρήσεις
ΕπεξεργασίαΣακχαρώδης διαβήτης
ΕπεξεργασίαΗ δαπαγλιφλοζίνη χρησιμοποιείται μαζί με τη διατροφή και την άσκηση για τη βελτίωση του γλυκαιμικού ελέγχου σε ενήλικες με διαβήτη τύπου 2 και για τη μείωση του κινδύνου νοσηλείας για καρδιακή ανεπάρκεια μεταξύ ενηλίκων με διαβήτη τύπου 2 και γνωστών καρδιαγγειακών παθήσεων ή άλλων παραγόντων κινδύνου.[7][3] Φαίνεται όμως ότι η μείωση που προκαλεί να είναι μικρότερη από αυτή της εμπαγλιφλοζίνης.[8]
Στην Ευρωπαϊκή Ένωση ενδείκνυται σε ενήλικες για τη θεραπεία ανεπαρκούς ελεγχόμενου σακχαρώδους διαβήτη τύπου 2 ως συμπλήρωμα στη διατροφή και την άσκηση:
- ως μονοθεραπεία όταν η μετφορμίνη θεωρείται ακατάλληλη λόγω δυσανεξίας.[4]
- εκτός από άλλα φαρμακευτικά προϊόντα για τη θεραπεία του διαβήτη τύπου 2.
και για τη θεραπεία ανεπαρκούς ελεγχόμενου σακχαρώδους διαβήτη τύπου 1 ως συμπλήρωμα της ινσουλίνης σε ασθενείς με ΔΜΣ ≥ 27 kg/m², όταν η ινσουλίνη από μόνη της δεν παρέχει επαρκή γλυκαιμικό έλεγχο παρά τη βέλτιστη θεραπεία με ινσουλίνη.[4]
Καρδιακή ανεπάρκεια
ΕπεξεργασίαΗ δαπαγλιφλοζίδη έχει εγκριθεί για χρήση σε ασθενείς με καρδιακή ανεπάρκεια με μειωμένο κλάσμα εξώθησης για τη μείωση του κινδύνου καρδιαγγειακού θανάτου και νοσηλεία για καρδιακή ανεπάρκεια.[3] Μια άλλη μελέτη διαπίστωσε ότι στην καρδιακή ανεπάρκεια με μειωμένο κλάσμα εξώθησης, η δαπαγλιφλοζίνη μείωσε τον κίνδυνο επιδείνωσης της καρδιακής ανεπάρκειας ή εξέλιξης σε θάνατο από καρδιαγγειακές αιτίες, ανεξάρτητα από τη διαβητική κατάσταση.[9]
Η νταπαγλιφλοζίνη παρουσιάστηκε σε κλινική δοκιμή για βελτίωση της επιβίωσης και μείωση της ανάγκης για νοσηλεία σε ενήλικες με καρδιακή ανεπάρκεια με μειωμένο κλάσμα εξώθησης.[3] Η ασφάλεια και η αποτελεσματικότητα της δαπαγλιφλοζίνης αξιολογήθηκαν σε μια τυχαιοποιημένη, διπλά τυφλή, ελεγχόμενη με εικονικό φάρμακο μελέτη 4.744 συμμετεχόντων. Η μέση ηλικία των συμμετεχόντων ήταν 66 ετών και περισσότεροι συμμετέχοντες ήταν άνδρες (77%). Για να προσδιοριστεί η αποτελεσματικότητα του φαρμάκου, οι ερευνητές εξέτασαν την εμφάνιση καρδιαγγειακού θανάτου, νοσηλεία για καρδιακή ανεπάρκεια και επείγουσες επισκέψεις λόγω καρδιακής ανεπάρκειας. Στους συμμετέχοντες δόθηκε τυχαία να λαμβάνουν μια δόση μία φορά την ημέρα είτε 10 mg δαπαγλιφλοζίνης είτε εικονικού φαρμάκου (αδρανή θεραπεία). Μετά από περίπου 18 μήνες, τα άτομα που έλαβαν δαπαγλιφλοζίνη είχαν λιγότερους καρδιαγγειακούς θανάτους, νοσηλεία για καρδιακή ανεπάρκεια και επείγουσες επισκέψεις καρδιακής ανεπάρκειας από εκείνους που έλαβαν εικονικό φάρμακο.[3][9]
Παρενέργειες
ΕπεξεργασίαΔεδομένου ότι η δαπαγλιφλοζίνη οδηγεί σε έντονη γλυκοζουρία (μερικές φορές έως και περίπου 70 γραμμάρια την ημέρα) μπορεί να οδηγήσει σε γρήγορη απώλεια βάρους και κόπωση. Η γλυκόζη δρα ως οσμωτικό διουρητικό (αυτό το αποτέλεσμα είναι η αιτία της πολυουρίας στον διαβήτη) που μπορεί να οδηγήσει σε αφυδάτωση. Η αυξημένη ποσότητα γλυκόζης στα ούρα μπορεί επίσης να επιδεινώσει τις λοιμώξεις που σχετίζονται ήδη με τον διαβήτη, ιδίως λοιμώξεις του ουροποιητικού συστήματος και μυκητίαση (καντιντίαση). Σπάνια, η χρήση ενός φαρμάκου SGLT2, συμπεριλαμβανομένης της δαπαγλιφλοζίνης, σχετίζεται με νεκρωτική φασίτιδα του περινέου, που ονομάζεται επίσης γάγγραινα του Φουρνιέρ.[10]
Η δαπαγλιφλοζίνη σχετίζεται επίσης με υποτασικές αντιδράσεις. Υπάρχουν ανησυχίες ότι μπορεί να αυξήσει τον κίνδυνο διαβητικής κετοξέωσης.[11]
Η δαπαγλιφλοζίνη μπορεί να προκαλέσει αφυδάτωση, σοβαρές λοιμώξεις του ουροποιητικού συστήματος και μυκητιασικές λοιμώξεις των γεννητικών οργάνων.[3] Ηλικιωμένοι, άτομα με νεφρικά προβλήματα, άτομα με χαμηλή αρτηριακή πίεση και άτομα που λαμβάνουν διουρητικά πρέπει να αξιολογούνται για την κατάσταση του όγκου τους και τη νεφρική τους λειτουργία. Τα άτομα με σημεία και συμπτώματα μεταβολικής οξέωσης ή κετοξέωσης (συσσώρευση οξέος στο αίμα) πρέπει επίσης να αξιολογούνται.
Για μείωση του κινδύνου εμφάνισης κετοξέωσης (μια σοβαρή κατάσταση στην οποία ο οργανισμός παράγει υψηλά επίπεδα οξέων αίματος που ονομάζονται κετόνες) μετά από χειρουργική επέμβαση, ο FDA ενέκρινε αλλαγές στις πληροφορίες συνταγογράφησης για τα φάρμακα τύπου αναστολέα SGLT2 για να συστήσει την προσωρινή διακοπή τους πριν από την προγραμματισμένη χειρουργική. Η καναγλιφλοζίνη, η δαπαγλιφλοζίνη και η εμπαγλιφλοζίνη θα πρέπει η καθεμία να σταματήσει τουλάχιστον τρεις ημέρες πριν και η ερτουγλιφλοζίνη θα πρέπει να σταματήσει τουλάχιστον τέσσερις ημέρες πριν από την προγραμματισμένη χειρουργική επέμβαση.[12]
Τα συμπτώματα της κετοξέωσης περιλαμβάνουν ναυτία, έμετο, κοιλιακό άλγος, κόπωση και δυσκολία στην αναπνοή.[12]
Μηχανισμός δράσης
ΕπεξεργασίαΗ δαπαγλιφλοζίνη αναστέλλει τον υπότυπο 2 των πρωτεϊνών μεταφοράς νατρίου-γλυκόζης ( SGLT2 ) οι οποίες είναι υπεύθυνες για τουλάχιστον 90% της επαναπορρόφησης της γλυκόζης στο νεφρό. Ο αποκλεισμός αυτού του μηχανισμού μεταφοράς προκαλεί την αποβολή της γλυκόζης στο αίμα μέσω των ούρων.[13] Σε κλινικές δοκιμές, η δαπαγλιφλοζίνη μείωσε την HbA 1c κατά 0,6 έναντι ποσοστιαίων μονάδων εικονικού φαρμάκου όταν προστέθηκε στη μετφορμίνη.[14]
Όσον αφορά τα προστατευτικά αποτελέσματά του στην καρδιακή ανεπάρκεια, αυτό αποδίδεται κυρίως σε αιμοδυναμικές επιδράσεις, όπου οι αναστολείς SGLT2 μειώνουν δραστικά τον ενδοαγγειακό όγκο μέσω της οσμωτικής διούρησης και της νατριουρίας, καθώς ο αποκλεισμός του συμμεταφορέα οδηγεί και σε απώλεια νατρίου. Αυτό συνεπώς μπορεί να οδηγήσει σε μείωση του προφορτίου και του μεταφορτίου, μειώνοντας έτσι τον καρδιακό φόρτο εργασίας και βελτιώνοντας τη λειτουργία της αριστερής κοιλίας.[15]
Το IC50 για τον SGLT2 είναι μικρότερο από το ένα χιλιοστό του IC 50 για SGLT1 (1,1 έναντι 1390 nmol / L), έτσι ώστε το φάρμακο να μην παρεμβαίνει στην εντερική απορρόφηση γλυκόζης.[16]
Ιστορία
ΕπεξεργασίαΤο 2012, η Επιτροπή Φαρμάκων για Ανθρώπινη Χρήση (CHMP) του Ευρωπαϊκού Οργανισμού Φαρμάκων (EMA) εξέδωσε θετική γνώμη για το φάρμακο.[4]
Η δαπαγλιφλοζίνη βρέθηκε αποτελεσματική σε αρκετές μελέτες σε συμμετέχοντες με διαβήτη τύπου 2 και τύπου 1.[4] Ο κύριος δείκτης μέτρησης της αποτελεσματικότητας ήταν το επίπεδο γλυκοζυλιωμένης αιμοσφαιρίνης (HbA1c), το οποίο δίνει μια ένδειξη για το πόσο καλά ελέγχεται η γλυκόζη στο αίμα.
Μια μακροχρόνια μελέτη, στην οποία συμμετείχαν περισσότεροι από 17.000 συμμετέχοντες με διαβήτη τύπου 2, εξέτασε τις επιδράσεις της δαπαγλιφλοζίνης στην καρδιαγγειακή νόσο (καρδιά και κυκλοφορία).[4] Η μελέτη έδειξε ότι οι επιδράσεις της δαπαγλιφλοζίνης ήταν σύμφωνες με εκείνες άλλων φαρμάκων για το διαβήτη που λειτουργούν επίσης εμποδίζοντας το SGLT2.
Η νταπαγλιφλοζίνη εγκρίθηκε για ιατρική χρήση στην Ευρωπαϊκή Ένωση τον Νοέμβριο του 2012.[4] Διατίθεται στο εμπόριο σε διάφορες ευρωπαϊκές χώρες.[17]
Η νταπαγλιφλοζίνη εγκρίθηκε για ιατρική χρήση στις Ηνωμένες Πολιτείες τον Ιανουάριο του 2014.[18]
Το 2020, η Αμερικανική Υπηρεσία Τροφίμων και Φαρμάκων (FDA) επέκτεινε τις ενδείξεις της δαπαγλιφλοζίνης για να συμπεριλάβει τη θεραπεία της καρδιακής ανεπάρκειας με μειωμένο κλάσμα εξώθησης λόγω της μείωσης του κινδύνου καρδιαγγειακού θανάτου και νοσηλείας για καρδιακή ανεπάρκεια.[3] Είναι η πρώτη σε αυτή τη συγκεκριμένη κατηγορία φαρμάκων, αναστολείς συν-μεταφορέα νατρίου-γλυκόζης 2 (SGLT2), που εγκρίθηκε για τη θεραπεία ενηλίκων με λειτουργική καρδιακή ανεπάρκεια κατηγορίας II-IV κατά NYHA με μειωμένο κλάσμα εξώθησης.
Τον Ιούλιο του 2020, η FDA χορήγησε στην AstraZeneca μια ταχεία άδεια στις ΗΠΑ για την ανάπτυξη της δαπαγλιφλοζίνης για τη μείωση του κινδύνου νοσηλείας για καρδιακή ανεπάρκεια ή καρδιαγγειακού θανάτου σε ενήλικες μετά από καρδιακή προσβολή.[19]
Παραπομπές
Επεξεργασία- ↑ 1,0 1,1 «Dapagliflozin (Farxiga) Use During Pregnancy». Drugs.com. 30 Αυγούστου 2018. Ανακτήθηκε στις 5 Μαΐου 2020.
- ↑ 2,0 2,1 2,2 «Farxiga- dapagliflozin tablet, film coated». DailyMed. 3 Φεβρουαρίου 2020. Ανακτήθηκε στις 5 Μαΐου 2020.
- ↑ 3,0 3,1 3,2 3,3 3,4 3,5 3,6 (5 May 2020). FDA approves new treatment for a type of heart failure. Δελτίο τύπου. Αυτό το λήμμα περιλαμβάνει κείμενο από αυτή την πηγή, που είναι κοινό κτήμα.
- ↑ 4,0 4,1 4,2 4,3 4,4 4,5 4,6 «Forxiga EPAR». European Medicines Agency (EMA). Ανακτήθηκε στις 17 Φεβρουαρίου 2020. Text was copied from this source which is © European Medicines Agency. Reproduction is authorized provided the source is acknowledged.
- ↑ «The Top 300 of 2020». ClinCalc. Ανακτήθηκε στις 11 Απριλίου 2020.
- ↑ «Dapagliflozin - Drug Usage Statistics». ClinCalc. Ανακτήθηκε στις 11 Απριλίου 2020.
- ↑ U.S. Food and Drug Administration (FDA) (8 January 2014). FDA Approves Farxiga to Treat Type 2 Diabetes. Δελτίο τύπου. Αυτό το λήμμα περιλαμβάνει κείμενο από αυτή την πηγή, που είναι κοινό κτήμα.
- ↑ «SGLT2 inhibitors for primary and secondary prevention of cardiovascular and renal outcomes in type 2 diabetes: a systematic review and meta-analysis of cardiovascular outcome trials». Lancet 393 (10166): 31–9. January 2019. doi:. PMID 30424892. «However, in patients with atherosclerotic cardiovascular disease, the effect of empagliflozin on cardiovascular death was more pro-nounced than that of canagliflozin or dapagliflozin».
- ↑ 9,0 9,1 «Dapagliflozin in Patients with Heart Failure and Reduced Ejection Fraction». New England Journal of Medicine 381 (21): 1995–2008. November 2019. doi:. PMID 31535829.
- ↑ «FDA warns about rare occurrences of a serious infection of the genital area with SGLT2 inhibitors for diabetes». U.S. Food and Drug Administration (FDA). 9 Φεβρουαρίου 2019. Αυτό το λήμμα περιλαμβάνει κείμενο από αυτή την πηγή, που είναι κοινό κτήμα.
- ↑ «SGLT2 inhibitors: Drug Safety Communication - FDA Warns Medicines May Result in a Serious Condition of Too Much Acid in the Blood». U.S. Food and Drug Administration (FDA). 15 Μαΐου 2015. Αρχειοθετήθηκε από το πρωτότυπο στις 27 Οκτωβρίου 2016. Ανακτήθηκε στις 15 Νοεμβρίου 2016.
- ↑ 12,0 12,1 «FDA revises labels of SGLT2 inhibitors for diabetes to include warning». U.S. Food and Drug Administration. 19 Μαρτίου 2020. Ανακτήθηκε στις 6 Ιουνίου 2020. Αυτό το λήμμα περιλαμβάνει κείμενο από αυτή την πηγή, που είναι κοινό κτήμα.
- ↑ «Life Sciences - Clarivate». Clarivate. Αρχειοθετήθηκε από το πρωτότυπο στις 5 Νοεμβρίου 2007.
- ↑ «UEndocrine: Internet Endocrinology Community». uendocrine.com. Αρχειοθετήθηκε από το πρωτότυπο στις 5 Φεβρουαρίου 2013.
- ↑ «The effects of sodium-glucose cotransporter 2 inhibitors on left ventricular function: current evidence and future directions». ESC Heart Fail 6 (5): 927–935. October 2019. doi:. PMID 31400090.
- ↑ Schubert-Zsilavecz, M, Wurglics, M, Neue Arzneimittel 2008/2009
- ↑ «Forxiga». Drugs.com. 4 Μαΐου 2020. Ανακτήθηκε στις 5 Μαΐου 2020.
- ↑ «Drug Approval Package: Farxiga (dapagliflozin) Tablets NDA #202293». U.S. Food and Drug Administration (FDA). 24 Δεκεμβρίου 1999. Ανακτήθηκε στις 5 Μαΐου 2020.
- ↑ «FARXIGA Granted Fast Track Designation in the US for Heart Failure Following Acute Myocardial Infarction Leveraging an Innovative Registry-Based Trial Design». www.businesswire.com (στα Αγγλικά). 16 Ιουλίου 2020. Ανακτήθηκε στις 20 Ιουλίου 2020.
