Πολυφωσφορικά
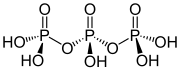
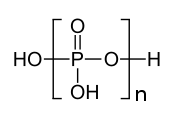
Πολυφωσφορικά (αγγλ. Polyphosphates)[1] ή αλλιώς πολυφωσφορικές ενώσεις είναι χημικώς τα άλατα (salts) ή οι εστέρες (esters) των πολυμερικών οξυανιόντων που σχηματίζονται από το τετραεδρικό PO4 (φωσφορικό ανιόν), που ως δομικές μονάδες ενώνονται συνεχώς μεταξύ τους με κοινή διαμοίραση ατόμων οξυγόνου. Δύνανται να σχηματίζουν και γραμμικές και κυκλικές πολυενώσεις.
Στη βιολογία, οι πολυφωσφορικοί εστέρες, δισφωσφορική αδενοσίνη (ADP) και δισφωσφορική αδενοσίνη (ATP), σχετίζονται άμεσα με την αποθήκευση της ενέργειας. Μια ομάδα πολυφωσφορικών ενώσεων έχουν βρει σημαντικές εφαρμογές στον καθαρισμό των αστικών υδάτων μέσω της συγκράτησης επιβλαβών μετάλλων[2]
Άλλα πολυφωσφορικά όπως λ.χ. η τριφωσφορική γουανοσίνη (GTP), η τριφωσφορική κυτιδίνη (CTP), και η τριφωσφορική ουριδίνη (UTP) είναι σημαντικά νουκλεοτίδια που σχετίζονται με τη σύνθεση πρωτεϊνών και λιπιδίων στον οργανισμό και τον μεταβολισμό των υδατανθράκων.[3] Επίσης, πολυφωσφορικά χρησιμοποιούνται κατά κόρον ως πρόσθετα σε τρόφιμα (food additives), τυπικά με τη σήμανση Ε452.[4] Ουσιαστικά είναι πολυφωσφορικά άλατα του νατρίου, του καλίου και του ασβεστίου και παράγονται με συνθετικό τρόπο, από τα αντίστοιχα ανθρακικά άλατα και το φωσφορικό οξύ, με συνηθισμένες χρήσεις ως: χηλικά αντιδραστήρια, σταθεροποιητικά και γαλακτωματοποιητές. Πρόσφατα έχει παρατηρηθεί ότι ένα πρόβλημα, που δημιουργήθηκε με τα φωσφορικά άλατα, ιδίως σε ασθενείς με νεφρικά προβλήματα που έπασχαν από υψηλό ποσοστό καρδιαγγειακών παθήσεων.[5]
-
Δομή του τριφωσφορικού οξέος
-
Δομή του πολυφωσφορικού οξέος
-
Δομή της δισφωσφορικής αδενοσίνης (ADP)
Μια άλλη πολύ σημαντική, ίσως η σημαντικότερη σε όγκο, είναι η χρήση των πολυφωσφορικών ως επιβραδυντικά φωτιάς, κν. αντιπυρικές ουσίες.[6] Εφαρμόζονται σε στερεή ή υγρή μορφή, αφού είναι ενώσεις εξαιρετικά διαλυτές στο νερό, και μέσω εμποτισμού υπό υψηλή πίεση ή μέσω επικάλυψης, παρέχουν ιδιότητες πυραντοχής σε πολυμερή, πλαστικά, βαμβακερά, πολυουρεθάνες, συμπαγή ξυλεία, καθώς και σε μοριοσανίδες και ινοσανίδες.[7][8][9][10] Συνήθως τα πολυφωσφορικά άλατα συνδυάζονται μαζί με ενώσεις του βορίου και του αζώτου, ή του αργιλίου (λ.χ. υδροξείδια).[11]
Παραπομπές
Επεξεργασία- ↑ https://www.britannica.com/science/phosphate
- ↑ «The Phosphate Method For Producing Quality Drinking Water» (PDF). Carus Chemical Company. 2001. Αρχειοθετήθηκε από το πρωτότυπο (PDF) στις 19 Απριλίου 2011. Ανακτήθηκε στις 20 Απριλίου 2011.
- ↑ https://www.vasiliadis-books.gr/Vasiliadis-books/wp-content/uploads/2018/06/%CE%94%CE%B5%CE%AF%CF%84%CE%B5-%CE%91%CF%80%CF%8C%CF%83%CF%80%CE%B1%CF%83%CE%BC%CE%B1-%CF%84%CE%BF%CF%85-%CE%92%CE%B9%CE%B2%CE%BB%CE%AF%CE%BF%CF%85-13.pdf
- ↑ http://www.food-info.net/gr/e/e452.htm
- ↑ https://www.itrofi.gr/texnologia/asfaleia/article/1953/ta-prostheta-fosforika-alata-endehetai-na-thetoyn-se-kindyno-tin
- ↑ Martinka, Jozef; Mantanis, George I.; Lykidis, Charalampos; Antov, Petar; Rantuch, Peter (2021-06-02). «The effect of partial substitution of polyphosphates by aluminium hydroxide and borates on the technological and fire properties of medium density fibreboard». Wood Material Science & Engineering (Informa UK Limited) 17 (6): 720–726. doi:. ISSN 1748-0272.
- ↑ https://www.sciencedirect.com/topics/engineering/ammonium-polyphosphate
- ↑ https://www.sciencedirect.com/topics/chemistry/polyphosphate
- ↑ «Αρχειοθετημένο αντίγραφο». Αρχειοθετήθηκε από το πρωτότυπο στις 14 Ιανουαρίου 2021. Ανακτήθηκε στις 12 Ιανουαρίου 2021.
- ↑ https://www.tandfonline.com/doi/abs/10.1080/17480272.2019.1596159?journalCode=swoo20
- ↑ https://onlinelibrary.wiley.com/doi/abs/10.1002/fam.2831