Αιθυλοκυκλοπροπυλαιθέρας
Ο αιθυλοκυκλοπροπυλαιθέρας ή αιθυξυκυκλοπροπάνιο ή αιθυλοκυκλοπροπυλοξείδιο είναι μια οργανική ένωση σύντομο συντακτικό τύπο ![]() . Είναι ένας αιθέρας. Με βάση το χημικό τύπο C4H8Ο του έχει τα ακόλουθα 71 ισομερή θέσης:
. Είναι ένας αιθέρας. Με βάση το χημικό τύπο C4H8Ο του έχει τα ακόλουθα 71 ισομερή θέσης:
- Πεντεν-1-όλη-1 (ελάσσων ταυτομερές της πεντανάλης) με σύντομο συντακτικό τύπο CH3CH2CH2CH=CHOH.
- Πεντεν-2-όλη-1 με σύντομο συντακτικό τύπο CH3CH2CH=CHCH2OH.
- Πεντεν-3-όλη-1 με σύντομο συντακτικό τύπο CH3CH=CHCH2CH2OH.
- Πεντεν-4-όλη-1 με σύντομο συντακτικό τύπο CH2=CHCH2CH2CH2OH.
- Πεντεν-1-όλη-2 (ελάσσων ταυτομερές της πεντανόνης-2) με σύντομο συντακτικό τύπο CH3CH2CH2C(ΟΗ)=CH2.
- Πεντεν-2-όλη-2 (ελάσσων ταυτομερές της πεντανόνης-2) με σύντομο συντακτικό τύπο CH3CH2CH=C(OH)CH3.
- Πεντεν-3-όλη-2 με σύντομο συντακτικό τύπο CH3CH=CHCH(OH)CH3.
- Πεντεν-4-όλη-2 με σύντομο συντακτικό τύπο CH2=CHCH2CH(OH)CH3.
- Πεντεν-1-όλη-3 με σύντομο συντακτικό τύπο CH3CH2CH(OH)CH=CH2.
- Πεντεν-2-όλη-3 (ελάσσων ταυτομερές της πεντανόνης-2) με σύντομο συντακτικό τύπο CH3CH2C(OH)=CHCH3.
- 2-μεθυλοβουτεν-1-όλη-1 (ελάσσων ταυτομερές της [2-μεθυλοβουτανάλης) με σύντομο συντακτικό τύπο CH3CH2C(CH3)=CHOH.
- 3-μεθυλοβουτεν-1-όλη-1 (ελάσσων ταυτομερές της [3-μεθυλοβουτανάλης) με σύντομο συντακτικό τύπο (CH3)2CHCH=CHOH.
- 2-μεθυλοβουτεν-2-όλη-1 με σύντομο συντακτικό τύπο CH3CH=C(CH3)CH2OH.
- 3-μεθυλοβουτεν-2-όλη-1 με σύντομο συντακτικό τύπο (CH3)2C=CHCH2OH.
- 2-μεθυλοβουτεν-3-όλη-1 με σύντομο συντακτικό τύπο CH2=CHCH(CH3)CH2OH.
- 3-μεθυλοβουτεν-3-όλη-1 με σύντομο συντακτικό τύπο CH2=C(CH3)CH2CH2OH.
- Μεθυλοβουτεν-1-όλη-2 (ελάσσων ταυτομερές της [μεθυλοβουτανόνης) με σύντομο συντακτικό τύπο (CH3)2CHC(OH)=CH2.
- Μεθυλοβουτεν-2-όλη-2 (ελάσσων ταυτομερές της [μεθυλοβουτανόνης) με σύντομο συντακτικό τύπο CH2C(CH3)=C(OH)CH3.
- Αιθυλοπροπενόλη με σύντομο συντακτικό τύπο CH2=C(CH2CH3)CH2OH.
- Κυκλοπεντανόλη με σύντομο συντακτικό τύπο
 .
. - 1-μεθυλοκυκλοβουτανόλη με σύντομο συντακτικό τύπο
 .
. - 2-μεθυλοκυκλοβουτανόλη με σύντομο συντακτικό τύπο

- 3-μεθυλοκυκλοβουτανόλη με σύντομο συντακτικό τύπο

- κυκλοβουτυλομεθανόλη με σύντομο συντακτικό τύπο

- 1-αιθυλοκυκλοπροπανόλη με σύντομο συντακτικό τύπο

- 2-αιθυλοκυκλοπροπανόλη με σύντομο συντακτικό τύπο

- 1-κυκλοπροπυλοαιθανόλη με σύντομο συντακτικό τύπο

- 2-κυκλοπροπυλοαιθανόλη με σύντομο συντακτικό τύπο

- 1,2-διμεθυλοκυκλοπροπανόλη με σύντομο συντακτικό τύπο

- 2,2-διμεθυλοκυκλοπροπανόλη με σύντομο συντακτικό τύπο

- 2,3-διμεθυλοκυκλοπροπανόλη με σύντομο συντακτικό τύπο

- (1-μεθυλοκυκλοπροπυλο)μεθανόλη με σύντομο συντακτικό τύπο

- (2-μεθυλοκυκλοπροπυλο)μεθανόλη με σύντομο συντακτικό τύπο

- Βινυλοπροπυλαιθέρας με σύντομο συντακτικό τύπο CH3CH2CH2OCH=CH2.
- Βινυλισοπροπυλαιθέρας με σύντομο συντακτικό τύπο CH3)2CHOCH=CH2.
- Αιθυλοπροπεν-1-υλαιθέρας με σύντομο συντακτικό τύπο CH3CH=CHOCH2CH3.
- Αιθυλαλλυλυλαιθέρας με σύντομο συντακτικό τύπο CH3=CHCΗ2OCH2CH3.
- Αιθυλο(μεθυλοβινυλ)αιθέρας με σύντομο συντακτικό τύπο CH2=C(CH3)OCH2CH3.
- Βουτεν-1-υλομεθυλαιθέρας με σύντομο συντακτικό τύπο CH3CH2CH=CHOCH3.
- Βουτεν-2-υλομεθυλαιθέρας με σύντομο συντακτικό τύπο CH3CH=CHCH2OCH3.
- Βουτεν-3-υλομεθυλαιθέρας με σύντομο συντακτικό τύπο CH2=CHCH2CH2OCH3.
- Μεθυλο-(1-μεθυλοπροπεν-1-υλ)αιθέρας με σύντομο συντακτικό τύπο CH3CH=C(CH3)OCH3.
- Μεθυλο-(2-μεθυλοπροπεν-1-υλ)αιθέρας με σύντομο συντακτικό τύπο (CH3)2C=CΗOCH3.
- Μεθυλο-(1-μεθυλοπροπεν-2-υλ)αιθέρας με σύντομο συντακτικό τύπο CH2=CHCΗ(CH3)OCH3.
- Μεθυλο-(2-μεθυλοπροπεν-2-υλ)αιθέρας με σύντομο συντακτικό τύπο CH2=C(CH3)CΗ2OCH3.
- (Αιθυλοβινυλ)μεθυλαιθέρας με σύντομο συντακτικό τύπο CH2=C(CΗ2CH3)OCH3.
- Κυκλοβουτυλομεθυλαιθέρας με σύντομο συντακτικό τύπο

- Μεθυλο(1-μεθυλοκυκλοπροπυλ)αιθέρας με σύντομο συντακτικό τύπο

- Μεθυλο(2-μεθυλοκυκλοπροπυλ)αιθέρας με σύντομο συντακτικό τύπο

- (Κυκλοπροπυλομεθυλο)μεθυλαιθέρας με σύντομο συντακτικό τύπο

- Οξάνιο με σύντομο συντακτικό τύπο
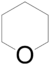
- 2-μεθυλοοξολάνιο με σύντομο συντακτικό τύπο
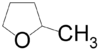
- 3-μεθυλοοξολάνιο με σύντομο συντακτικό τύπο
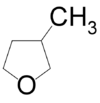
- 2-αιθυλοξετάνιο με σύντομο συντακτικό τύπο
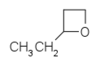
- 3-αιθυλοξετάνιο με σύντομο συντακτικό τύπο

- 2,2-διμεθυλοξετάνιο με σύντομο συντακτικό τύπο

- 2,3-διμεθυλοξετάνιο με σύντομο συντακτικό τύπο

- 2,4-διμεθυλοξετάνιο με σύντομο συντακτικό τύπο

- 3,3-διμεθυλοξετάνιο με σύντομο συντακτικό τύπο

- Προπυλοξιράνιο με σύντομο συντακτικό τύπο

- Ισοροπυλοξιράνιο με σύντομο συντακτικό τύπο
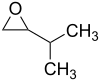
- 2-αιθυλο-2-μεθυλοξιράνιο με σύντομο συντακτικό τύπο

- 2-αιθυλο-3-μεθυλοξιράνιο με σύντομο συντακτικό τύπο

- Τριμεθυλοξιράνιο με σύντομο συντακτικό τύπο

- Πεντανάλη (μείζον ταυτομερές της πεντεν-1-όλης-1) με σύντομο συντακτικό τύπο CH3CH2CH2CH2CHO.
- 2-μεθυλοβουτανάλη (μείζον ταυτομερές της 2-μεθυλοβουτεν-1-όλης-1) με σύντομο συντακτικό τύπο CH3CH2CH(CΗ3 )CHO.
- 3-μεθυλοβουτανάλη (μείζον ταυτομερές της 3-μεθυλοβουτεν-1-όλης-1) με σύντομο συντακτικό τύπο (CH3)2CHCH2CHO.
- Διμεθυλοπροπανάλη με σύντομο συντακτικό τύπο (CH3)3CCHO.
- Πεντανόνη-2 (μείζον ταυτομερές της πεντεν-1-όλης-2 και της πεντεν-2-όλης-2) με σύντομο συντακτικό τύπο CH3CH2CH2COCH3.
- Πεντανόνη-3 (μείζον ταυτομερές της πεντεν-2-όλης-3) με σύντομο συντακτικό τύπο CH3CH2COCH2CH3.
- Μεθυλοβουτανόνη (μείζον ταυτομερές της μεθυλοβουτεν-1-όλης-2 και της μεθυλοβουτεν-2-όλης-2) με σύντομο συντακτικό τύπο (CH3)2CHCOCH2CH3.
| Αιθυλοκυκλοπροπυλαιθέρας | |
|---|---|

| |
| Γενικά | |
| Όνομα IUPAC | Αιθοξυκυκλοπροπάνιο |
| Άλλες ονομασίες | Αιθυλοκυκλοπροπυλαιθέρας Αιθυλοκυκλοπροπυλοξείδιο-1 |
| Χημικά αναγνωριστικά | |
| Χημικός τύπος | C5H10O |
| Μοριακή μάζα | 86,13amu[1] |
| Σύντομος συντακτικός τύπος |
|
| SMILES | CCOC1CC1 |
| Ισομέρεια | |
| Ισομερή θέσης | 71 |
| Φυσικές ιδιότητες | |
| Χημικές ιδιότητες | |
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |
Κυκλοπροπάνια
Επεξεργασία«Κυκλοπροπάνια» ονομάζονται τα κυκλοαλκάνια με τριμελή δακτύλιο, που αποτελεί και το χαρακτηριστικό της δομής τους. Οι πλευρικές αλυσίδες, όταν υπάρχουν, διαμορφώνονται όπως στα αλκάνια. Το ιδιαίτερο χαρακτηριστικό της μοριακής δομής τους είναι η εμφάνιση γωνίας δεσμού που είναι η συνηθισμένη γωνία δεσμού sp3-sp3 που αντιστοιχεί σε κορεσμένο. Ύστερα από ενεργειακή ανάλυση των πιθανών δομών - μοριακών μοντέλων με κβαντομηχανικές μεθόδους προέκυψε ως πιθανότερη η εκδοχή του sp2 υβριδισμού και της δημιουργίας δύο μοριακών τροχιακών τριών κέντρων (των τριών ατόμων C), σ (2sp2-2sp2-2sp2) και π (2p-2p-2p), με 3 ηλεκτρόνια ανά μοριακό τροχιακό, ώστε να χρησιμοποιηθούν τα 6 διαθέσιμα ηλεκτρόνια των 3 ατόμων C (τα άλλα 6 χρησιμοποούνται για τους 6 σ δεσμούς με τα 6 άτομα υδρογόνου ή και τα αλκύλια). Αντί δηλαδή των κλασσικών 3 ομοιοπολικών δεσμών δύο κέντρων μεταξύ των ατόμων C, υπάρχουν 2 ομοιοπολικοί δεσμοί τριών κέντρων[2].
Εξαιτίας αυτού του γεγονότος προκύπτει η λεγόμενη «ενέργεια τάσης δεσμών» που συνυπολογίζει την ενέργεια παραμόρφωσης δεσμικής γωνίας (κατά Baeyer), που οφείλεται στη διαφορά γωνίας από την κανονική, και την ενέργεια στρέψης (κατά Piltzer), που οφείλεται στην αδυναμία του συστήματος να στρέψει τους δεσμούς του και να πάρει διαμόρρφωση αποφυγής των απώσεων τύπου Van der Waals, που αναπτύσσονται από την προσέγγιση αλληλοαπωθούμενων ατόμων και ομάδων αυτών. Ενώ λοιπόν το ισομερές προπένιο έχει θερμότητα ολικής καύσης 1.971 kcal/mole το κυκλοπροπάνιο έχει 2.088 kcal/mole. Το ΔQ = 117 kJ/mole αντιστοιχεί ακριβώς στην επιπλέον ενέργεια που παγιδεύει η ιδιάζουσα δομή του τριμελή δακτυλίου[3]. Αποτέλεσμα των παραπάνω είναι τα κυκλοπροπάνια (και τα υποκατεστημένα παράγωγά τους) να δείνουν αντιδράσεις προσθηκοδιάσπασης-1,3.
- Η αιθυλοκυκλοπροπυλαιθέρας διαφέρει από το κυκλοπροάνιο έχοντας μια αιθυοξυομάδα (CH3CH2O-) αντί ενός ατόμου υδρογόνου.
Παραγωγή
ΕπεξεργασίαΑπό (2-αλο-1-αλομεθυλο)αιθυλαιθέρα
ΕπεξεργασίαΜε επίδραση ψευδαργύρου σε (2-αλο-1-αλομεθυλο)αιθυλαιθέρα παράγεται αιθυλοκυκλοπροπυλαιθέρας, με ενδομοριακή αντίδραση Wurtz [4]:
Με αλκυλίωση αλκοολικού άλατος
ΕπεξεργασίαΑκόμη, μπορεί να παραχθεί με κυκλοπροπυλίωση αιθανολικού άλατος (π.χ. CH3CH2ONa) με κυκλοπροπυλαλογονίδιο ή αιθυλίωση κυκλοπροπανολικού άλατος με αιθυλαλογονίδιο (CH3CH2X)[5]:
Χημικές ιδιότητες
Επεξεργασία- Τα αλκυλοκυκλοαλκάνια με τριμελή δακτύλιο (όπως τα «κυκλοπροπάνια») έχουν αρκετή ενέργεια τάσης δεσμών για να δώσουν προσθηκοδιάσπαση-1,3, αλλά κάτω από πιο έντονες συνθήκες και με μικρότερη ταχύτητα αντίδρασης σε σχέση με τα αλκένια. Κατά τα άλλα συμπεριφέρονται χημικά όπως τα αλκάνια[6]:
- Ο όρος «προσθηκοδιάσπαση» σημαίνει διάσπαση δακτυλίου και προσθήκη στα άκρα της αλυσίδας που προκύπτει.
- Επίσης διατηρούν τις χημικές ιδιότητες των αιθέρων.
Οξείδωση
Επεξεργασία1. Καταλυτική οξείδωση:
- 1. Χωρίς προσθηκοδιάσπαση προς 1-αιθοξυκυκλοπροπανόλη:
- 2. Με πιο έντονες συνθήκες δίνει προσθηκοδιάσπαση-1,3 προς 2-αιθοξυοξετάνιο:
2. Χημική οξείδωση: Με οξείδωση αιθυλοκυκλοπροπυλαιθέρα με υπερμαγγανικό κάλιο παράγεται 1-αιθοξυκυκλοπροπανόλη:
3. Φωτοχημική: Υπό την επίδραση φωτός (hv) και ατμοσφαιρικού οξυγόνου σχηματίζει ασταθή και εκρηκτικά υπεροξείδια[7]:
Αναφορές και σημειώσεις
Επεξεργασία- ↑ Χρησιμοποιήθηκε η μοριακή μάζα της ισομερούς κυκλοπεντανόλης
- ↑ Ν. Αλεξάνδρου, Γενική Οργανική Χημεία, ΘΕΣΣΑΛΟΝΙΚΗ 1985: Σελ.127-128, §6.2.
- ↑ Ν. Αλεξάνδρου, Γενική Οργανική Χημεία, ΘΕΣΣΑΛΟΝΙΚΗ 1985, Σελ. 125-126, §6.1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.154, §6.5.Β1
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.198, §8.3.1.
- ↑ Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991, σελ.24, §1.2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.200, §8.5.1.
Πηγές
Επεξεργασία- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
- Δημήτριου Ν. Νικολαΐδη: Ειδικά μαθήματα Οργανικής Χημείας, Θεσσαλονίκη 1983.


















