Αιθάνιο
Το αιθάνιο[1] (αγγλικά ethane) είναι οργανική χημική ένωση, που περιέχει άνθρακα και υδρογόνο, με μοριακό τύπο C2H6, αλλά παριστάνεται επίσης με τον ημισυντακό τύπο CH3CΗ3, καθώς και με τις συντομογραφίες EtH και Me2. Με βάση το σύστημα κωδικής ονομασίας που ξεκίνησε με τους φθοροχλωράνθρακες έχει τον κωδικό R-170. Είναι το δεύτερο απλούστερο αλκάνιο, δηλαδή άκυκλος κορεσμένος υδρογονάνθρακας. Το χημικά καθαρό αιθάνιο, στις συνηθισμένες συνθήκες, δηλαδή σε θερμοκρασία 25 °C και υπό πίεση 1 atm, είναι άχρωμο και άοσμο αέριο, με κρίσιμη θερμοκρασία 32,2 °C και κρίσιμη πίεση 48,36 atm. Σε βιομηχανική κλίμακα το αιθάνιο απομονώνεται από το φυσιο και από το αργό πετρέλαιο, ως ένα παραπροϊόν της διύλισής του. Το ίδιο το αιθάνιο, με τη σειρά του, χρησιμοποιείται κυρίως ως πρόδρομη ένωση για την παραγωγή αιθενίου.
| Αιθάνιο | |||
|---|---|---|---|

| |||

| |||
| |||

| |||

| |||
| Γενικά | |||
| Όνομα IUPAC | Αιθάνιο | ||
| Άλλες ονομασίες | Διμεθύλιο | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | C2H6 | ||
| Μοριακή μάζα | 30,07 amu | ||
| Σύντομος συντακτικός τύπος |
CH3CH3 | ||
| Συντομογραφίες | EtH, Me2 | ||
| Αριθμός CAS | 74-84-0 | ||
| SMILES | CC | ||
| InChI | 1/C2H6/c1-2/h1-2H3 | ||
| Αριθμός EINECS | 200-814-8 | ||
| Αριθμός RTECS | KH3800000 | ||
| Αριθμός UN | 1035 | ||
| PubChem CID | 6324 | ||
| ChemSpider ID | 6084 | ||
| Δομή | |||
| Διπολική ροπή | 0 D | ||
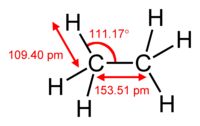
| Μήκος δεσμού | C-H: 108,7 pm C-C: 153,51 pm | ||
| Είδος δεσμού | C-H: ελαφρά πολωμένος ομοιοπολικός δεσμός σ (1s-2sp3) C-C: ομοιοπολικός δεσμός σ (2sp3-2sp3) | ||
| Πόλωση δεσμού | C-H: 3% | ||
| Γωνία δεσμού | HCC: 111,17° | ||
| Μοριακή γεωμετρία | διτετραεδρική | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | -181,76 °C | ||
| Σημείο βρασμού | -88,6 °C | ||
| Κρίσιμη θερμοκρασία | 32,2 °C | ||
| Κρίσιμη πίεση | 48,3592401 atm | ||
| Πυκνότητα | 1,283 kg/m3 | ||
| Διαλυτότητα στο νερό |
47 g/m3 (17 °C) | ||
| Τάση ατμών | 40 atm (23,6 °C) | ||
| Εμφάνιση | Άχρωμο και άοσμο αέριο | ||
| Χημικές ιδιότητες | |||
| pKa | 50 | ||
| Θερμότητα πλήρους καύσης |
1.561 kJ/mole | ||
| Βαθμός οκτανίου | 108 | ||
| Ελάχιστη θερμοκρασία ανάφλεξης |
-135 °C | ||
| Σημείο αυτανάφλεξης | 472 °C | ||
| Επικινδυνότητα | |||

| |||
| Εξαιρετικά εύφλεκτο (F+) | |||
| Φράσεις κινδύνου | R12 | ||
| Φράσεις ασφαλείας | S2, S9, S16, S33 | ||
| Κίνδυνοι κατά NFPA 704 |
|||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Ιστορία
ΕπεξεργασίαΤο αιθάνιο παρασκευάσθηκε για πρώτη φορά συνθετικά το 1834, από τον Μάικλ Φαραντέι (Michael Faraday), όταν ηλεκτρόλυσε αιθανικό κάλιο. Υπέθεσε όμως, λανθασμένα, ότι το αέριο που εκλύθηκε ήταν το μεθάνιο και δεν διερεύνησε περισσότερο την αντίδραση[2]. Τη χρονική περίοδο 1847-1849, σε μια προσπάθεια διερεύνησης της θεωρίας ελευθέρων ριζών στην Οργανική Χημεία, οι Άντολφ Βίλχελμ Χέρμαν Κόλμπε (Hermann Kolbe) και Σερ Έντουαρντ Φράνκλαντ (Sir Edward Frankland) παρήγαγαν αιθάνιο με αναγωγές αιθανονιτριλίου (CH3CN)[3] και ιωδομεθανίου (CH3Ι)[4] με μεταλλικό κάλιο (K), καθώς και με ηλεκτρόλυση διαλύματος αιθανικού καλίου, όπως ο Φαραντέι. Και αυτοί, όμως, έκαναν λάθος στο προϊόν της αντίδρασης που νόμιζαν ότι έλαβαν, θεωρώντας ότι ήταν ελεύθερη μεθυλική ρίζα (CH3●) και όχι αιθάνιο, που είναι άλλωστε το προϊόν του άμεσου διμερισμού της ασταθούς ελεύθερης μεθυλικής ρίζας. Αυτό το λάθος έγινε κατανοητό και διορθώθηκε το 1864, από τον Καρλ Σχόρλεμμερ (Carl Schorlemmer), που απέδειξε ότι το προϊόν όλων των παραπάνω αναφερόμενων αντιδράσεων είναι στην πραγματικότητα το αιθάνιο, και όχι μεθάνιο, ελεύθερη μεθυλική ρίζα ή κάτι άλλο.
Ονοματολογία
ΕπεξεργασίαΗ ονομασία «αιθάνιο» προέρχεται από την ονοματολογία κατά IUPAC. Συγκεκριμένα, το πρόθεμα «αιθ-» δηλώνει την παρουσία δύο (2) ατόμων άνθρακα ανά μόριο της ένωσης, το ενδιάμεσο «-αν-» δείχνει την παρουσία μόνο απλών δεσμών μεταξύ ατόμων άνθρακα στο μόριο και η κατάληξη «-ιο» φανερώνει ότι δεν περιέχει χαρακτηριστικές ομάδες, από αυτές που τίθενται στην κατάληξη της ονομασίας, και επομένως, επειδή δεν αναφέρονται καμία ούτε ως προθέματα - υποκαταστάτες, δηλώνεται έμμεσα ότι είναι υδρογονάνθρακας. Ο κωδικός R-170 παράγεται ως εξής: Το R προέρχεται από την αγγλόφωνη λέξη
Refrigerant. Το πρώτο ψηφίο (1) σημαίνει ότι η ένωση περιέχει 1+1 = 2 άτομα άνθρακα (ανά μόριο). Το δεύτερο ψηφίο (7) σημαίνει ότι η ένωση περιέχει 7 - 1 = 6 άτομα υδρογόνου. Και, τέλος, το τελευταίο ψηφίο (0), σημαίνει (εμμέσως) ότι η ένωση είναι υδρογονάνθρακας, αφού έχει όλα τα προβλεπόμενα άτομα υδρογόνου για δύο (2) άτομα άνθρακα ανά μόριο.
Φυσική παρουσία
ΕπεξεργασίαΤο αιθάνιο υπάρχει ως ιχναέριο στην ατμόσφαιρα της Γης, έχοντας μέση κατ' όγκο συγκέντρωση 0,5 ppb[5], στο επίπεδο της θάλασσας, αν και η προβιομηχανική συγκέντρωση του αερίου είναι πιθανό να ήταν μικρότερη, εφόσον υπάρχει μια σημαντική σύγχρονη έκλυση του αερίου, που προέρχεται από την αξιοποίηση των ορυκτών καυσίμων. Παρ' όλο που το αιθάνιο είναι ένα «αέριο του θερμοκηπίου», του δίνεται ελάχιστη περιβαλλοντική σημασία, εξαιτίας της πολύ μικρής αφθονίας του, αλλά και της μικρότερης κατά βάρος συνεισφοράς του στο φαινόμενο, σε σύγκριση με το μεθάνιο.
Είναι επίσης ιχναέριο στις ατμόσφαιρες και των τεσσάρων (4) γιγαντιαίων πλανητών (Δία, Κρόνου, Ουρανού και Ποσειδώνα), καθώς επίσης και στην ατμόσφαιρα του Τιτάνα.
Το ατμοσφαιρικό αιθάνιο είναι κυρίως αποτέλεσμα φωτοχημικής επίδρασης του ηλιακού φωτός στο ατμοσφαιρικό μεθάνιο, που επίσης υπάρχει και στις ατμόσφαιρες των παραπάνω αναφερόμενων πέντε (5) ουρανίων σωμάτων. Κάθε φωτόνιο υπεριριώδους ακτινοβολίας, με μήκος κύματος ίσο ή και μικρότερο από 160 nm, μπορεί να φωτοδιασπάσει ένα μόριο μεθανίου σε ελεύθερη μεθυλική ρίζα (CH3●) και άτομο υδρογόνου. Όταν δύο (2) ελεύθερες ρίζες μεθυλίου τύχει να συναντηθούν σχηματίζουν αιθάνιο:
Στην περίπτωση του Τιτάνα, υποτέθηκε ευρέως ότι μέρος του αιθανίου, που σχηματίζεται και εκεί όπως αναφέρθηκε παραπάνω, πέφτει με τη μορφή βροχής στην επιφάνεια του δορυφόρου και με το πέρασμα του χρόνου σχηματίζει σταδιακά λίμνες, θάλασσες, ως και ωκεανούς υγρών υδρογονανθράκων. Ωστόσο παρατηρήσεις με τηλεσκόπια υπερύθρων έδειξαν ότι είναι σημαντικά αμφίβολη αυτή η υπόθεση. Ακόμη ο διαστημικός βολιστήρας Χιούγκεν, που προσεδαφίστηκε στον Τιτάνα το 2005, απέτυχε να παρατηρήσει οποιαδήποτε υγρή επιφάνεια, αν και φωτογράφησε τοπία που μπορεί να θεωρηθούν ότι είναι αποξηραμένα κανάλια. Το Δεκέμβριο του 2007, όμως, ο διαστημικός βολιστήρας Κασσίνι, βρήκε τουλάχιστον μια λίμνη στο νότιο πόλο του Τιτάνα, που ονομάστηκε «Λάκος Οντάριο» (Ontario Lacus), επειδή θεωρήθηκε ότι έχει παρόμοιο εμβαδό με τη Λίμνη Οντάριο στη Γη (περίπου 20.000 τ.χλμ.). Παραπέρα υπέρυθρη φασματοσκοπική ανάλυση του υγρού του Λάκου Οντάριο τον Ιούλιο του 2008 απέδωσε ισχυρότερη ένδειξη για την παρουσία (υγρού) αιθανίου εκεί[6].
Το 1996 αιθάνιο ανιχνεύθηκε στον κομήτη Χυακουτέικ[7] και από τότε ανιχνεύθηκε και σε άλλους κομήτες. Η ύπαρξη αιθανίου σε ουράνια σώματα στο απώτερο ηλιακό σύστημα μπορεί να σημαίνει ότι το αιθάνιο ήταν ένα προϋπάρχον συστατικό του ηλιακού νεφελώματος, από το οποίο πιστεύεται ότι σχηματίστηκε ο Ήλιος και το υπόλοιπο ηλιακό σύστημα.
Το 2006 ο Dale Cruikshank της NASA και οι συνεργάτες του ανακοίνωσαν τη φασματοσκοπική ανακάλυψη αιθανίου στην επιφάνεια του Πλούτωνα.[8]
Δομή
ΕπεξεργασίαΤο μόριό του αποτελείται από δύο (2) πρωτοταγή[9] άτομα άνθρακα και έξι (6) άτομα υδρογόνου. Δομικά, το κάθε άτομο άνθρακα βρίσκεται στο κέντρο ενός τετραέδρου και τα τρία (3) άτομα υδρογόνου και το έτερο άτομο άνθρακα στις κορυφές του. Οι δεσμοί C-H που σχηματίζονται είναι ελαφρά πολωμένοι (~3%) ομοιοπολικοί τύπου σ (2sp³-1s), με μήκος 108,7 pm. Ο δεσμός C-C είναι ομοιοπολικός τύπου σ (2sp³-2sp³), με μήκος 154 pm. Οι δε δεσμικές γωνίες HCH και HCC είναι περίπου 109° 28΄.
| Δεσμοί[10] | ||||
| Δεσμός | τύπος δεσμού | ηλεκτρονική δομή | Μήκος δεσμού | Ιονισμός |
|---|---|---|---|---|
| C-H | σ | 2sp3-1s | 109 pm | 3% C- H+ |
| C-C | σ | 2sp3-2sp3 | 154 pm | |
| Κατανομή φορτίων σε ουδέτερο μόριο | ||||
| C | -0,09 | |||
| H | +0,03 | |||
Περιστροφή του μορίου
ΕπεξεργασίαΗ περιστροφή μιας μοριακής υποδομής γύρω από έναν περιστρέψιμο δεσμό συνήθως απαιτεί ενέργεια. Η ελάχιστη ενέργεια για την παραγωγή περιστροφής 360° σε ένα δεσμό ονομάζεται «εμπόδιο περιστροφής».
Το αιθάνιο δίνει ένα κλασσικό και απλό παράδειγμα εμποδίου περιστροφής, γνωστό με την ονομασία «εμπόδιο αιθανίου». Η πειραματική ένδειξη της ύπαρξης αυτού του εμποδίου παρατηρήθηκε για πρώτη φορά με τη μοντελοποίηση της εντροπίας[11].
Τα τρία (3) άτομα υδρογόνου κάθε μεθυλίου είναι ελεύθερα να περιστραφούν σαν πτερύγια ανεμόμυλου γύρω από τον κεντρικό δεσμό C-C, υπό την προϋπόθεση ότι υπάρχει επαρκής ενέργεια για να ξεπεραστεί το εμπόδιο περιστροφής του κάθε δεσμού άνθρακα-υδρογόνου, σε κάθε άκρο του μορίου, εμπόδιο που προκαλείται από την πρόσκρουση του καθενός σε άλλο με τρόπο που γίνεται αλληλεπικάλυψη των τροχιακών, οπότε έχουμε ανταλλαγή άπωσης[12].
Μεταξύ 1890 και 1891 το προτάθηκε για το αιθάνιο ότι «προτιμά» μια κλιμακωτή διαμόρφωση με τα δύο άκρα του μορίου λοξά το ένα από το άλλο[13][14][15].
Παραγωγή
ΕπεξεργασίαΑπομόνωση από φυσικές και βιομηχανικές πηγές
Επεξεργασία1. Απομόνωση από το φυσικό αέριο (1-15%):
Το αιθάνιο είναι το δεύτερο, μετά το μεθάνιο, σε (μέση) συγκέντρωση συστατικό του φυσικού αερίου. Πριν από τη δεκαετία του 1960, το αιθάνιο, και τα βαρύτερα συστατικά του φυσικού αερίου, τυπικά δεν διαχωρίζονταν από το μεθάνιο και τα άλλα συστατικά του φυσικού αερίου, απλά γιατί το αιθάνιο, όπως και το μεθάνιο, χρησιμοποιούνταν απλά και μόνο ως καύσιμο. Σήμερα, όμως, που η πιο ανεπτυγμένη πετροχημική βιομηχανία έχει καταστήσει το αιθάνιο μια σημαντική γι' αυτήν πρόδρομη ύλη, το αιθάνιο διαχωρίζεται από τα υπόλοιπα συστατικά του φυσικού αερίου, τουλάχιστον στις περισσότερες αναπτυγμένες εγκαταστάσεις εξόρυξης φυσικού αερίου. Το αιθάνιο μπορεί επίσης να διαχωριστεί από το «πετρελαϊκό αέριο», δηλαδή το μείγμα αέριων υδρογονανθράκων - παραπροϊόντων της διύλισης του αργού πετρελαίου. Η οικονομία, όμως, της δημιουργίας και λειτουργίας μονάδων παραγωγής, μπορεί να αλλάξει, επειδή μπορεί να αλλάξει η σχετική αξία της προώθησης ακατέργαστου φυσικού αερίου στους καταναλωτές του, όπως και το σχετικό κόστος διαχωρισμού του αιθανίου, οπότε είναι δυνατό οι σχετικές μονάδες να βρεθούν οικονομικά ασύμφορες. Από την άλλη, όμως, η διοχέτευση περισσότερου αιθανίου στους αγωγούς φυσικού αερίου δημιουργεί προβλήματα διαχείρισης και αλλαγής της ποιότητας του αερίου στους τερματικούς σταθμούς.
Η πιο αποτελεσματική μέθοδος διαχωρισμού του αιθανίου από το μεθάνιο είναι με υγροποίηση του πρώτου με ψύξη. Υπάρχουν διάφορες στρατηγικές ψύξης, αλλά η πιο οικονομική (προς το παρόν) μέθοδος χρησιμοποιεί αρχικά συμπίεση, και μετά απότομη διαφυγή. Η μέθοδος αυτή μπορεί να αφαιρέσει πάνω από το 90% του αιθανίου από το φυσικό αέριο. Σύμφωνα με αυτήν τη μέθοδο, κατεψυγμένο φυσικό αέριο (ή και πετρελαϊκό αέριο) διαφεύγει διαμέσου ενός συμπιεστή (τουρμπίνας). Καθώς διαφεύγει έχουμε αδιαβατική εκτόνωση, οπότε η θερμοκρασία του πέφτει περίπου στους −100 °C. Σ' αυτήν τη θερμοκρασία, το μεθάνιο παραμένει αέριο και μπορεί να διαχωριστεί από το υγροποιημένο (πλέον) αιθάνιο και τους επίσης υγροποιημένους (πλέον) βαρύτερους υδρογονάνθρακες, με απόσταξη. Μια επιπλέον απόσταξη διαχωρίζει με τη σειρά του το αιθάνιο από το προπάνιο και τους βαρύτερους υδρογονάνθρακες.
2. Απομονώνεται από το βιοαέριο που παράγεται με ζυμώσεις βιομάζας.
3. Απομονώνεται από αέρια μίγματα που προκύπτουν από πυρόλυση προϊόντων διύλισης πετρελαίου ή πολυμερών υδρογονανθράκων.
Παρασκευή με αντιδράσεις σύνθεσης: Από πρώτες ύλες με μικρότερη ανθρακική αλυσίδα
Επεξεργασία1. Το αιθάνιο είναι συμμετρικό αλκάνιο, δηλαδή αποτελείται από δυο συμμετρικά τμήματα μεθυλίου: (CH3-). Αυτό επιτρέπει την παραγωγή του με τη μέθοδο Würtz, από μεθυλαλογονίδιο (CH3X) και νάτριο (Να)[16]:
- όπου Χ: F, Cl, Br, I.
- Το K επίσης δίνει την αντίστοιχη αντίδραση.
- Η απόδοση είναι αρκετά καλή: ~60%.
2. Μια εναλλακτική μέθοδος είναι η αντίδραση ζεύγους μεθυλαλογονίδιου (CH3X) - μεθυλολιθίου (CH3Li) ή με χρήση οργανομαγνησιακής ένωσης[17]:
ή
3. Με παρεμβολή μεθυλενίου ([:CH2]) σε μεθάνιο (CH4)[18]:
Παρασκευή με αντιδράσεις χωρίς αλλαγή μήκους ανθρακικής αλυσίδας
ΕπεξεργασίαΑπό αιθανονιτρίλιο
ΕπεξεργασίαΜε παραλλαγή της μεθόδου Würtz με CN[19] αντί Χ, δηλαδή με αιθανονιτρίλιο (CH3CN) αντί μεθυλαλογονίδιο (CH3X)[20]:
Από αιθυλαλογονίδια
Επεξεργασία1. Με αναγωγή αιθυλαλογονιδίου από «υδρογόνο εν τω γεννάσθαι», δηλαδή μέταλλο + οξύ[21]:
2. Με αναγωγή αιθυλαλογονιδίου από LiAlH4 ή NaBH4[22]:
3. Με αναγωγή αιθυλοϊωδίδιου από HI[23]:
4. Με αναγωγή αιθυλαλογονιδίου από σιλάνιο, παρουσία τριφθοριούχου βορίου παράγεται αιθάνιo[24]:
5. Αναγωγή από ένα αλκυλοκασσιτεράνιο. Π.χ.[25]:
6. Με αναγωγή από μέταλλα και στη συνέχεια υδρόλυση των παραγόμενων οργανομεταλλικών ενώσεων:
Με καταλυτική υδρογόνωση
Επεξεργασία1. Καταλυτική υδρογόνωση αιθενίου (CH2=CH2)[30]:
2. Καταλυτική υδρογόνωση αιθινίου (HC ≡ CH) [31]:
Με ηλεκτρόλυση Kolbe
ΕπεξεργασίαΜε ηλεκτρόλυση αλκαλικού διαλύματος αιθανικού οξέος (CH3COOH) - Μέθοδος Kolbé[32]:
Με αναγωγή αιθανάλης
ΕπεξεργασίαΜε αναγωγή αιθανάλης (CH3CHO): Αντίδραση Wölf-Kishner, με υδραζίνη (NH2NH2)[33]:
Με αναγωγή θειούχων ενώσεων
Επεξεργασία1. Με αναγωγή των κατάλληλων θειολών μπορεί να παραχθεί αιθάνιο. Π.χ. από την αναγωγή της αιθανοθειόλης (μέθοδος Raney)[34]:
2. Με αναγωγή των κατάλληλων θειαιθέρων μπορεί να παραχθεί αιθάνιο. Π.χ. από την αναγωγή του διαιθυλοθειαιθέρα (μέθοδος Raney)[34]:
Παρασκευή με αντιδράσεις αποσύνθεσης: με μείωση του μήκους της ανθρακικής αλυσίδας
Επεξεργασία- Με τη θέρμανση αλκαλικού διαλύματος προπανικού οξέος (CH3CH2COOH) σε αλκαλικό περιβάλλον[35]:
Χημικές ιδιότητες και παράγωγα
ΕπεξεργασίαΟξείδωση
Επεξεργασία1. Τέλεια καύση: Αντιδρά με οξυγόνο (O2) και καίγεται παράγοντας γαλαζωπή φλόγα υψηλής θερμοκρασίας[36]:
- Αν και η αντίδραση είναι μια έντονα εξώθερμη δεν συμβαίνει σε μέτριες θερμοκρασίες, γιατί για την έναρξή της πρέπει να υπερπηδηθεί πρώτα το εμπόδιο της διάσπασης των δεσμών C-C[37], των δεσμών C-H[38] και των δεσμών (Ο=Ο)[39] του O2:
2. Παραγωγή υδραερίου (CO + H2):
3. Καταλυτική οξείδωση προς αιθανάλη (CH3CHO):
4. Το αιθάνιο οξειδώνεται από το διοξιράνιο, παράγοντας αιθανόλη:
Αλογόνωση[40]
Επεξεργασία
- Δραστικότητα των X2: F2 > Cl2 > Br2 > Ι2.
- Ανάλυση του μηχανισμού της χλωρίωσης του CH3CH3:
- 1. Έναρξη: Παράγονται ελεύθερες ρίζες.
- Η απαιτούμενη ενέργεια προέρχεται από το υπεριώδες φως (UV) ή θερμότητα (Δ).
- 2. Διάδοση: Καταναλώνονται οι παλιές ελεύθερες ρίζες, σχηματίζοντας νέες.
- 3. Τερματισμός: Καταναλώνονται μεταξύ τους οι ελεύθερες ρίζες, κατά τη στατιστικά σπάνια περίπτωση της συνάντησής τους.
- Είναι όμως πρακτικά δύσκολο να σταματήσει η αντίδραση στην παραγωγή CH3CH2X.
- Αν χρησιμοποιηθούν ισομοριακές ποσότητες CH3CH3 και Χ2 θα παραχθεί μείγμα όλων των X-παραγώγων του CH3CH3
- Αν όμως χρησιμοποιηθεί περίσσεια CH3CH3, τότε η απόδοση του CH3CH2X αυξάνεται πολύ, λόγω της αύξησης της στατιστική πιθανότητας συνάντησης CH3CH3 με X. σε σχέση με την πιθανότητα συνάντησης CH3CH2X και X., που μπορεί να οδηγήσει στην παραγωγή των υπόλοιπων X-παραγώγων.
Παρεμβολή καρβενίων
Επεξεργασία
Νίτρωση
Επεξεργασία- Αντιδρά με ατμούς HNO3 στην αέρια φάση, παράγοντας νιτραιθάνιο[43]:
Καταλυτική αφυδρογόνωση
ΕπεξεργασίαΑυτή είναι η κύρια βιομηχανική εφαρμογή του αιθανίου ως πυρόλυση με ατμό, από την οποία παράγεται αιθένιο:
Εφαρμογές
Επεξεργασία- Ως καύσιμο, με τις μορφές του φυσικού αερίου και του βιοαερίου.
- Ως πρόδρομη ύλη αιθενίου με πυρόλυση, που με τη σειρά του είναι βιομηχανική πρώτη ύλη για μια μεγάλη σειρά οργανικών ενώσεων.
- Ως πρόδρομη ύλη βινυλοχλωριδίου και άλλων αλοπαραγώγων με 2 άτομα C.
- Ως πρόδρομη ύλη διαφόρων συνθέσεων, μέσω των αλαιθανίων.
- Ως πρόδρομη ύλη οξυγονούχων ενώσεων, όπως π.χ. CH3COOH, με καταλυτική μερική οξείδωση.
- Το υγρό αιθάνιο χρησιμοποιείται για τη συντήρηση κρυστάλλων για εξέταση στο ηλεκτρονικό μικροσκόπιο.
Η κύρια χρήση του αιθανίου στη χημική βιομηχανία είναι η παραγωγή αιθενίου με πυρόλυση με ατμό. Όταν αναμιγνύονται με ατμό που θερμαίνεται σύντομα σε πολύ υψηλές θερμοκρασίες (900 °C ή και περισσότερο), οι βαρύτεροι υδρογονάνθρακες «σπάνε» σε ελαφρύτερους και οι κορεσμένοι (αλκάνια) γίνονται ακόρεστοι (αλκένια, κ.τ.λ.). Το αιθάνιο προτιμάται για παραγωγή αιθενίου, γιατί η πυρόλυσή του με ατμό οδηγεί με μεγάλη εκλεκτικότητα στην παραγωγή αιθενίου, ενώ η πυρόλυση άλλων βαρύτερων αλκανίων δίνει σχετικά πιο φτωχά σε αιθένιο μίγματα, που περιέχουν βαρύτερα αλκένια όπως προπένιο, βουταδιένια ή και αρωματικούς υδρογονάνθρακες.
Το αιθάνιο βρίσκεται υπό πειραματική έρευνα ως πρώτη ύλη και για μια σειρά άλλων χρήσιμων χημικών. Η οξειδωτική χλωρίωση του αιθανίου από καιρό φαίνεται να μπορεί να αποτελέσει μια πιο οικονομική οδό για την παραγωγή χλωραιθένιου, σε σύγκριση με τη χλωρίωση αιθενίου. Πολλές διεργασίες για την πραγματοποίηση (οξειδωτικής χλωρίωσης αιθανίου) έχουν ήδη πατενταριστεί, αλλά δυσκολίες, όπως φτωχή επιλεκτικότητα ως προς την παραγωγή σε χλωραιθένιο ή χρησιμοποιούν διαβρωτικές συνθήκες αντίδρασης (π.χ. θέρμανση μίγματος αντίδρασης που περιέχει ατμούς υδροχλωρικού οξέος σε θερμοκρασίες πάνω από 500 °C), έχουν αποθαρρύνει την εμπορική εκμετάλλευσή τους. Πρόσφατα, η εταιρεία INEOS λειτουργεί μια πιλοτική μονάδα παραγωγικής δυνατότητας 1.000 τόννων ετησίως για τη μετατροπή αιθανίου σε χλωραιθένιο στο Βιλχελμσχάφεν της Γερμανίας.
Παρομοίως, η σαουδαραβική εταιρεία SABIC ανακοίνωσε την κατασκευή μονάδας παραγωγικότητας 30.000 τόννων ετησίως αιθανικού οξέος από αιθάνιο στο Γιανμπού της Σαουδικής Αραβίας. Η οικονομική βιωσιμότητα μιας τέτοιας διεργασίας μπορεί να βασίζεται στο χαμηλό κόστος του αιθανίου κοντά στις πετρελαιοπηγές της Σαουδικής Αραβίας, αλλά μπορεί να μην είναι ανταγωνιστικές με την καρβονυλίωση μεθανόλης στον υπόλοιπο κόσμο.
Το αιθάνιο μπορεί να χρησιμοποιηθεί ως ψυκτικό υγρό σε κρυογενικά ψυγεία. Σε μια πολύ μικρότερη κλίμακα, στην επιστημονική έρευνα, το υγρό αιθάνιο χρησιμοποιήθηκε στην «υαλοποίηση» νερού για τη δημιουργία δειγμάτων για μελέτη σε κρυοηλεκτρονικά μικροσκόπια: Ένα λεπτό στρώμα μελετούμενου νερού επιδράται με υγρό αιθάνιο θερμοκρασίας −150 °C ή και ψυχρότερο, οπότε το νερό πήζει τόσο γρήγορα ώστε δεν προλαβαίνει να κρυσταλλωθεί. Αυτή η απότομη πήξη δεν καταστρέφει τη δομή τυχόν μαλακών υλικών, που μπορεί να περιέχονται στο υγρό, όπως συμβαίνει με το συνηθισμένο σχηματισμό παγοκρυστάλλων.
Υγεία και ασφάλεια
ΕπεξεργασίαΣτη «θερμοκρασία δωματίου» (20 °C), το αιθάνιο είναι ένα εύφλεκτο αέριο. Όταν αναμιγνύεται με τον αέρα σε συγκεντρώσεις 3% - 12,5%, κατ' όγκο, σχηματίζει εκρηκτικά μίγματα. Κάποιες πρόσθετες προφυλάξεις είναι αναγκαίες όταν το αιθάνιο αποθηκεύεται ως κρυογενικό υγρό. Άμεση επαφή με υγρό αιθάνιο μπορεί να έχει ως αποτέλεσμα σοβαρό κρυοπάγημα. Επιπρόσθετα, οι ατμοί εξατμιζόμενου υγρού αιθανίου είναι βαρύτεροι από τον αέρα (τουλάχιστον μέχρι να θερμανθούν στη θερμοκρασία δωματίου), οπότε μπορούν να «έρπουν» κοντά στο πάτωμα ή να συγκεντρώνονται σε χαμηλά μέρη, όπου, αν κατά λάθος αναφλεγούν, μπορούν να μεταδώσουν την ανάφλεξη και στο σώμα υγρού αιθανίου, από το οποίο είχαν εξατμιστεί.
Δοχεία που πρόσφατα αδειάστηκαν από αιθάνιο μπορεί να περιέχουν ανεπαρκές οξυγόνο για της υποστήριξη της ζωής. Πέρα όμως από τον κίνδυνο ασφυξίας, για το αιθάνιο δεν είναι γνωστός κανένας άμεσος ή χρόνιος τοξικολογικός κίνδυνος. Το αιθάνιο δεν είναι ούτε καν ύποπτο για καρκινογόνο.
Παραπομπές και σημειώσεις
Επεξεργασία- ↑ Δείτε τις εναλλακτικές ονομασίες στον παρακείμενο πίνακα πληροφοριών χημικής ένωσης.
- ↑ Faraday, Michael (1834). "Experimental researches in electricity: Seventh series". Philosophical Transactions 124: 77–122. doi:10.1098/rstl.1834.0008.
- ↑ Kolbe, Hermann; Frankland, Edward (1849). "On the products of the action of potassium on cyanide of ethyl". Journal of the Chemical Society 1: 60–74. doi:10.1039/QJ8490100060.
- ↑ Frankland, Edward (1850). "On the isolation of the organic radicals". Journal of the Chemical Society 2: 263–296. doi:10.1039/QJ8500200263.
- ↑ «Trace gases». Αρχειοθετήθηκε από το πρωτότυπο στις 22 Δεκεμβρίου 2008. Ανακτήθηκε στις 10 Δεκεμβρίου 2010.
- ↑ http://www.nature.com/nature/journal/v454/n7204/abs/nature07100.html
- ↑ Mumma, Michael J. et al. (1996). "Detection of Abundant Ethane and Methane, Along with Carbon Monoxide and Water, in Comet C/1996 B2 Hyakutake: Evidence for Interstellar Origin". Science 272 (5266): 1310–1314. Bibcode 1996Sci...272.1310M. doi:10.1126/science.272.5266.1310. PMID 8650540.
- ↑ A. Stern (1 Νοεμβρίου 2006). «Making Old Horizons New». The PI's Perspective. Johns Hopkins University Applied Physics Laboratory. Αρχειοθετήθηκε από το πρωτότυπο στις 20 Αυγούστου 2011. Ανακτήθηκε στις 12 Φεβρουαρίου 2007.
- ↑ Άτομο C ενωμένο με ένα (1) άλλο άτομο C.
- ↑ Τα δεδομένα προέρχονται εν μέρει από το «Table of periodic properties of thw Ellements», Sagrent-Welch Scientidic Company και Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, Σελ. 34.
- ↑ Kemp, J. D. and Pitzer, K. S., J. Am. Chem. Soc., 1937, 59, 276-279
- ↑ Pitzer RM, "The barrier to internal rotation in ethane". Accts. chem. Res. 16, 201–210 (1983)
- ↑ Bischoff, CA, (1890), Chem. Ber. 23, 623
- ↑ Bischoff, CA, (1891a), Chem. Ber. 24, 1074, 1086
- ↑ Bischoff, CA, (1891b), Chem. Ber. 26, 1452
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.2.2α, R = CH3
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 187, §7.3.5
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.6.3, R = CH3
- ↑ To CN συμπεριφέρεται συχνά ως «ψευδοαλογόνο».
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.2.2α, R = CH3, X = CN
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.2.1β., με R = CH3CH2
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, §6.2.1α., με R = CH3CH2
- ↑ Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991, σελ.14, §1.1
- ↑ Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991, σελ. 291-293, §19.1.
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, Σελ. 42, §4.3.
- ↑ Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991, σελ.80-82, §5.1-5.2
- ↑ όπου |Εt2Ο| : άνυδρος διαιθυλαιθέρας
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.2.4α., με R = CH3CH2
- ↑ αντιδραστήριο Grignard
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.2.5.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 158, §6.9.4α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.2.3b, R = CH3.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.7.6β.
- ↑ 34,0 34,1 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.269, §11.6B7.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.2.3α., με R = CH3CH2
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 155, §6.7.1, v = 2 και μετατροπή μονάδας ενέργειας σε kJ.
- ↑ ΔHC-C= +347 kJ/mol
- ↑ ΔHC-H = +415 kJ/mol
- ↑ ΔHO-O=+146 kJ/mol
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.7.1β., με R = CH3CH2
- ↑ καθοριστικό ταχύτητας
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 155, §6.7.3.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 244, §10.3.2
Πηγές
Επεξεργασία- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
- Μερικές από τις ενέργειες αντιδράσεων υπολογίστηκαν με χρήση κατάλληλου λογισμικού. Θα διασταυρωθούν και βιβλιογραφικά το συντομότερο για μεγαλύτερη ακρίβεια.
