Μεθάνιο
Το μεθάνιο είναι δυαδική οργανική χημική ένωση με μοριακό τύπο CH4, δηλαδή το μόριό του αποτελείται από ένα (1) άτομο άνθρακα και τέσσερα (4) άτομα υδρογόνου. Είναι η απλούστερη (σταθερή)[2] οργανική ένωση (γενικά) και ειδικότερα το απλούστερο αλκάνιο, δηλαδή άκυκλος κορεσμένος υδρογονάνθρακας.
| Μεθάνιο | |||
|---|---|---|---|

| |||
| |||

| |||

| |||

| |||
| Γενικά | |||
| Όνομα IUPAC | Μεθάνιο | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | CH4 | ||
| Μοριακή μάζα | 16,0425 amu | ||
| Συντομογραφίες | MeH | ||
| Αριθμός CAS | 74-82-8 | ||
| SMILES | C | ||
| PubChem CID | 297 | ||
| ChemSpider ID | 291 | ||
| Δομή | |||
| Διπολική ροπή | 0 D | ||
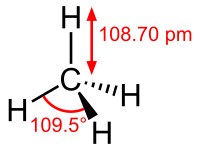
| Μήκος δεσμού | 108,7 pm | ||
| Είδος δεσμού | ελαφρά πολωμένος ομοιοπολικός δεσμός σ (1s-2sp³) | ||
| Πόλωση δεσμού | 3% | ||
| Γωνία δεσμού | 109°28' | ||
| Μοριακή γεωμετρία | τετραεδρική | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | -182,5°C (90,65 K) | ||
| Σημείο βρασμού | -161,6°C (111,55 K) | ||
| Κρίσιμη θερμοκρασία | −82,6°C (190,55 K) | ||
| Κρίσιμη πίεση | 45,3984703 atm | ||
| Πυκνότητα | 0,717 kg/m³ | ||
| Διαλυτότητα στο νερό |
35 g/m³ (17°C) | ||
| Τάση ατμών | 40 atm (-86,3°C) | ||
| Εμφάνιση | Άχρωμο και άοσμο αέριο [1] | ||
| Χημικές ιδιότητες | |||
| Θερμότητα πλήρους καύσης |
891 kJ/mole | ||
| Βαθμός οκτανίου | 120 | ||
| Βαθμός κετανίου | 0 | ||
| Ελάχιστη θερμοκρασία ανάφλεξης |
-188°C | ||
| Επικινδυνότητα | |||

| |||
| Εξαιρετικά εύφλεκτο (F+) | |||
| Φράσεις κινδύνου | R12 | ||
| Φράσεις ασφαλείας | S2, S9, S16, S33 | ||
| Κίνδυνοι κατά NFPA 704 |
|||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Γενικότερα, είναι ένα από τα υδρίδια των χημικών στοιχείων της ομάδας 14 του περιοδικού πίνακα.
Αποτελεί (συνήθως) το κύριο συστατικό του φυσικού αερίου (70-90%). Η σχετική αφθονία του στη Γη, η (σχετικά πάντα) μεγάλη ενεργειακή του απόδοση, η «καθαρή» καύση του και η χαμηλή του τιμή, το κάνουν πολύ ελκυστικό καύσιμο, ιδιαίτερα για παραγωγή ηλεκτρικής ενέργειας και οικιακή θέρμανση.
Ωστόσο, επειδή το χημικά καθαρό μεθάνιο, στις «κανονικές συνθήκες περιβάλλοντος», δηλαδή σε θερμοκρασία 25 °C και υπό πίεση 1 atm, είναι άχρωμο και άοσμο[3] αέριο, έχοντας μάλιστα κρίσιμη θερμοκρασία -82,6°C, το μεθάνιο είναι δύσκολο (και δαπανηρό) να μεταφερθεί από τις πηγές του ή και να αποθηκευθεί.
Για τη μεταφορά του χρησιμοποιούνται συχνά ειδικοί αγωγοί (συνήθως με τη μορφή του φυσικού αερίου), ή και ειδικά πλοία (μεταφορικά υγροποιημένου φυσικού αερίου, LNG carriers), που το μεταφέρουν σε υγρή μορφή υπό ψύξη, κάτω από τη θερμοκρασία βρασμού του (-161,6 °C), οπότε πλέον μπορούν να υγροποιηθούν το μεθάνιο και φυσικά και τα βαρύτερα συστατικά του φυσικού αερίου.[4]
Το μεθάνιο, μαζί με το υπόλοιπο φυσικό αέριο, συνήθως (σχηματίζεται με συνδυασμό βιολογικών και γεωλογικών διεργασιών και) παγιδεύεται με φυσικό τρόπο κάτω από το έδαφος και κάτω από το θαλάσσιο πυθμένα. Το παγιδευμένο φυσικό αέριο μερικές φορές βρίσκει τον τρόπο να φθάνει έως την επιφάνεια και την ατμόσφαιρα, όπου (μαζί με το μεθάνιο που παράγεται και εκλύεται από άλλες πηγές, οι οποίες αναφέρονται παρακάτω) είναι γνωστό ως «ατμοσφαιρικό μεθάνιο».[5] Το ατμοσφαιρικό μεθάνιο είναι ισχυρό αέριο θερμοκηπίου, με μεγάλο δυναμικό παγκόσμιας θέρμανσης, που υπολογίζεται σε 72 (αν χρησιμοποιηθεί μέσος όρος 20 ετών) ή 25 (αν χρησιμοποιηθεί μέσος όρος 100 ετών).[6] Το δυναμικό αυτό είναι πολύ μεγαλύτερο από το αντίστοιχο (μόλις 1) του διοξειδίου του άνθρακα (CO2), το οποίο είναι το πιο γνωστό αέριο θερμοκηπίου.[7] Το μεθάνιο, όμως, οξειδώνεται αργά στην ατμόσφαιρα της Γης, από το ατμοσφαιρικό οξυγόνο (O2), με τη βοήθεια της υγρασίας (H2O) και της υπεριώδους ακτινοβολίας (UV), του ηλιακού φωτός, παράγοντας (αρχικά) ελεύθερες ρίζες μεθυλίου (CH3•). Το αποτέλεσμα αυτής της οξείδωσης είναι να έχει το μεθάνιο ημιζωή επτά (7) ετών στη γήινη ατμόσφαιρα. Η μοριακή αναλογία του μεθανίου στην ατμόσφαιρα της Γης υπολογίστηκε ότι το 1750 ήταν (γύρω στα) 700 ppb. Το 1998 ανέβηκε στα 1.745 ppb. Το 2008 έφτασε τα 1.800 ppb.[8] Τέλος, το 2010 μετρήθηκε στην Αρκτική στα 1850 ppb, δηλαδή σε ένα επίπεδο που αποτελεί το υψηλότερο, εδώ και 400.000 χρόνια.[9] Ιστορικά, τα επίπεδα της μοριακής συγκέντρωσης μεθανίου στην ατμόσφαιρα της Γης κυμαίνονταν μεταξύ 300 και 400 ppb, κατά τις εποχές των παγετώνων, και μεταξύ 600 και 700 ppb, κατά τις μεσοπαγετώδεις περιόδους.
Το στρατοσφαιρικό μεθάνιο (δηλαδή όσο ατμοσφαιρικό μεθάνιο ανέρχεται έως τη στρατόσφαιρα) επηρεάζει επίσης το στρατοσφαρικό στρώμα του όζοντος.[10][11]
Επιπλέον, υπάρχουν μεγάλες ποσότητες μεθανυδριτών στους ωκεάνιους πυθμένες. Ο φλοιός της Γης περιέχει τεράστιες ποσότητες μεθανίου που δημιουργήθηκε με αναερόβια μεθανογένεση. Άλλες πηγές έκλυσης μεθανίου στην ατμόσφαιρα της Γης περιλαμβάνουν τα ηφαίστεια, οι χωματερές και η κτηνοτροφία, από την εντερική ζύμωση κυτταρινούχων τροφών, ιδιαίτερα στα μηρυκαστικά ζώα.
Το μεθάνιο έχει επίσης ανιχνευθεί και σε άλλους πλανήτες, που συμπεριλαμβάνουν τον Άρη, γεγονός το οποίο δημιουργεί στοιχείο μελέτης για την αστροβιολογική έρευνα.[12]
Ιστορικά στοιχεία
ΕπεξεργασίαΑπό τους αρχαιότατους χρόνους ο άνθρωπος χρησιμοποιούσε το μεθάνιο (με τη μορφή του φυσικού αέριου) ως μέσο θέρμανσης. Συστηματική χρήση του γινόταν από τους Κινέζους (τουλάχιστον από το 10ο αιώνα π.Χ.), που το διαβίβαζαν μέσω καλαμιών μπαμπού και το έκαιγαν, με σκοπό την εξάτμιση θαλασσινού νερού για παραγωγή αλατιού. Ήταν γνωστό ότι όσοι το ανέπνεαν έπεφταν σε κατάσταση έκστασης και μιλούσαν ασυνάρτητα. Αυτά τα φαινόμενα αποδίδονταν σε υπερφυσικές δυνάμεις, και γι' αυτό συχνά, σε πολλές περιοχές, που φυσικό αέριο εκλυόταν από σχισμές του εδάφους, χτιζόταν κοντά ναοί ή και μαντεία. Φωτιστική χρήση του μεθανίου αναφέρεται να γίνεται από το 2ο αιώνα μ.Χ.. Το μεθάνιο ήταν ένα από τα πρώτα αέρια που χαρακτηρίστηκαν ως ξεχωριστές χημικές ενώσεις. Ήταν γνωστό ως «αέριο των ελών» ή «ελογενές αέριο» (marsh gas). Το Νοέμβριο του 1776, το μεθάνιο για πρώτη φορά ταυτοποιήθηκε επιστημονικά από τον Ιταλό φυσικό Αλεσάντρο Βόλτα (Alessandro Volta 1745-1827), από αέριο που εκλύονταν στους βάλτους της λίμνης Ματζόρε (Maggiore), που βρίσκεται στα σύνορα μεταξύ Ιταλίας και Ελβετίας. Ο Βόλτα είχε εμπνευστεί από φυλλάδιο που είχε γραφεί από το Βενιαμίν Φραγκλίνο (Benjamin Franklin, 1706-1790) όπου ανέφερε περί «εύφλεκτου αέρα».[13] Ο Βόλτα εγκλώβησε δείγμα του εκλυόμενου από το βάλτο αερίου, και μέχρι το 1778 κατόρθωσε να απομονώσει από αυτό μια χημικά καθαρή αέρια χημική ένωση.[14] Επέδειξε, επίσης, την ιδιότητα ανάφλεξης του αερίου, με τη χρήση ηλεκτρικού σπινθήρα (για την έναρξη της ανάφλεξης). Ο Βόλτα έγινε αργότερα διάσημος, και στο ευρύτερο κοινό, κυρίως για τις ανακαλύψεις του στο πεδίο του ηλεκτρισμού, αλλά ωστόσο, τα πειράματά του με διάφορα αέρια, και κυρίως με το μεθάνιο, στην αρχή της επιστημονικής του σταδιοδρομίας (1778), τον είχαν καταστήσει ήδη (αρκετά) γνωστό στην επιστημονική κοινότητα της εποχής του, πριν ακόμη προχωρήσει στην κύρια και γνωστότερη εφεύρεσή του, δηλαδή την ηλεκτρική στήλη (1800).
Το μεθάνιο εκλύεται συχνά στα ανθρακωρυχεία και για το λόγο αυτό χάθηκαν εξ αιτίας του πολλές ζωές ανθρακωρύχων, αφού σε αναλογίες 5-15% κ.ό. στον αέρα αναφλέγεται εκρηκτικά. Η χρήση «γυμνής» φλόγας για το φωτισμό των στοών ήταν το σύνηθες αίτιο των αναφλέξεων αυτών. Το 1815 ο Βρετανός χημικός Χάμφρεϋ Ντάιβυ (Humphry Davy, 1778-1829) διαπίστωσε ότι το μεθάνιο αρχίζει να αναφλέγεται μόνο υπό την επίδραση υψηλών θερμοκρασιών. Η παρατήρηση αυτή τον οδήγησε στην κατασκευή φωτιστικής λυχνίας ασφαλείας, στην οποία η φλόγα περιβαλλόταν από μεταλλικό πλέγμα. Το πλέγμα επέτρεπε την είσοδο αέρα από το περιβάλλον προς τη φλόγα, οπότε, παρουσία μεθανίου γινόταν εσωτερική ανάφλεξη, αλλά το πλέγμα διέσπειρε τη θερμότητα και έτσι η ανάφλεξη αυτή δεν μεταδίδονταν εκτός της λυχνίας. Η λυχνία αυτή, γνωστή ως λυχνία ασφαλείας ή «λυχνία Davy» (Davy lamp), η οποία ήταν και ένα είδος ανιχνευτή επικίνδυνων αερίων. Παρουσία μεθανίου η φλόγα γινόταν εντονότερη και αποκτούσε κυανό χρώμα, ενώ παρουσία του ασφυκτικού (και άρα επίσης επικίνδυνου) διοξειδίου του άνθρακα, η φλόγα έσβηνε. Χάρις στη λυχνία Davy σώθηκαν πολλές ζωές ανθρακωρύχων και επαναλειτούργησαν πολλά ανθρακωρυχεία, τα οποία είχαν προηγουμένως εγκαταλειφθεί ως επικίνδυνα[15], μετά από θανατηφόρα δυστυχήματα.
Μέχρι τη δεκαετία του 1970, η επίπτωση του μεθανίου στο κλίμα του πλανήτη μας ήταν άγνωστη. Το 1976, αποδείχθηκε ότι το μεθάνιο είναι αέριο του θερμοκηπίου. Μετά την έναρξη της εξερεύνησης του διαστήματος, ανακαλύφθηκε η ευρύτατη παρουσία του στο σύμπαν.
Ονοματολογία
ΕπεξεργασίαΗ ονομασία «μεθάνιο» προέρχεται από την ονοματολογία κατά IUPAC. Συγκεκριμένα, το πρόθεμα «μεθ-» δηλώνει την παρουσία ενός (1) ατόμου άνθρακα ανά μόριο της ένωσης, το ενδιάμεσο «-αν-» δείχνει την παρουσία μόνο απλών δεσμών μεταξύ ατόμων άνθρακα στο μόριο και η κατάληξη «-ιο» φανερώνει ότι δεν περιέχει χαρακτηριστικές ομάδες, από αυτές που τίθενται στην κατάληξη της ονομασίας, και επομένως, επειδή δεν αναφέρονται καμία ούτε ως προθέματα - υποκαταστάτες, δηλώνεται έμμεσα ότι είναι υδρογονάνθρακας.
Αναλυτικότερα
ΕπεξεργασίαΤο μεθάνιο πήρε το όνομά του από τη ρίζα μεθύλιο και την κατάληξη «-ανιο», που χαρακτηρίζει τα αλκάνια (δηλαδή τους κορεσμένους αλειφατικούς υδρογονάνθρακες). Οι ονομασίες των ομάδων μεθυλένιο (−CH2−) και μεθύλιο (CH3−) χρησιμοποιήθηκαν για πρώτη φορά από τους Γάλλους χημικούς Ζαν-Μπαπτίστ Ντουμάς (Jean-Baptiste Dumas) και Ευτζέν Πελιγκότ (Eugène-Melchior Péligot), όταν κατά τη δεκαετία 1830-1840 μελετούσαν τη μεθανόλη (CH3OH), κύριο προϊόν «ξηράς απόσταξης» ξύλου. Η μεθανόλη αρχικά αναφερόταν με το εμπειρικό όνομα «ξυλόπνευμα» ή «πυροξυλικό πνεύμα» (wood alcohol, pyroxylic spirit). Θέλοντας, όμως, να της δώσουν ένα ελληνικής προέλευσης όνομα, όπως ήταν η συνήθεια της εποχής, χρησιμοποίησαν τις λέξεις «μέθη» (από τη φυσιολογική δράση της μεθανόλης) και «ὕλη» (με την έννοια του ξύλου, όπως για παράδειγμα και στην ελληνική λέξη υλοτομία), και τελικά ονόμασαν τη μελετούμενη από αυτούς αλκοόλη «μεθυλική αλκοόλη» (methyl alcohol). Από τότε η κατάληξη «-υλιο» γενικεύτηκε για τις ονομασίες, αρχικά όλων των οργανικών, αλλά αργότερα και μερικών ανόργανων ριζών.[15]
Κωδική ονομασία ως (εν δυνάμει) ψυκτικό
ΕπεξεργασίαΜε βάση το σύστημα κωδικής ονομασίας που ξεκίνησε με τους φθοροχλωράνθρακες, έχει τον κωδικό R-50.
Ο κωδικός R-50 παράγεται ως εξής: Το R προέρχεται από την αγγλόφωνη λέξη Refrigerant, δηλαδή ψυκτικό. Το πρώτο ψηφίο (εννοείται το 0) σημαίνει ότι η ένωση περιέχει 0 + 1 = 1 άτομα άνθρακα (ανά μόριο). Το δεύτερο ψηφίο (5) σημαίνει ότι η ένωση περιέχει 5 - 1 = 4 άτομα υδρογόνου. Και, τέλος, το τελευταίο ψηφίο (0), σημαίνει (εμμέσως) ότι η ένωση είναι υδρογονάνθρακας, αφού έχει όλα τα προβλεπόμενα άτομα υδρογόνου για κορεσμένη ένωση με ένα (1) άτομο άνθρακα ανά μόριο της ένωσης.
Δομή, δεσμολογία και ιδιότητες
ΕπεξεργασίαΤο μόριο του μεθανίου έχει τη δομή κανονικού τετραέδρου, με τέσσερις (4) ισοδύναμους δεσμούς C-H. Οι δεσμοί που σχηματίζονται είναι ελαφρά πολωμένοι (~3% C- H+) ομοιοπολικοί τύπου σ, οι οποίοι παραδοσιακά θεωρούνταν τύπου (2sp³-1s), με μήκος 108,7 pm. Οι γωνίες των τεσσάρων δεσμών C-Η είναι 109° 28΄ [για την ακρίβεια ισούνται με το τόξσυν(-1/3), δηλαδή τη λύση της τριγωνομετρικής εξίσωσης συνx = -1/3.].
| Δεσμοί[16] | ||||
| Δεσμός | τύπος δεσμού | ηλεκτρονική δομή | Μήκος δεσμού | Ιονισμός |
|---|---|---|---|---|
| C-H | σ | 2sp³-1s | 109 pm | 3% C- H+ |
| Κατανομή φορτίων σε ουδέτερο μόριο | ||||
| C | -0,12 | |||
| H | +0,03 | |||
Η ηλεκτρονιακή του δομή, μετά από πιο πρόσφατες εκτιμήσεις, περιγράφεται με τέσσερα (4) μοριακά τροχιακά τύπου σ, ως αποτέλεσμα της επικάλυψης των ατομικών τροχιακών του άνθρακα και του υδρογόνου. Το χαμηλότερης ενέργειας μοριακό τροχιακό είναι το αποτέλεσμα της επικάλυψης κάθε 2s τροχιακού του άνθρακα με τον κατά φάση συνδυασμό των 1s τροχιακών των τεσσάρων (4) ατόμων υδρογόνου. Πάνω από αυτό το ενεργειακό επίπεδο βρίσκεται ένα σύνολο από τριπλά εκφυλισμένα μοριακά τροχιακά που περιλαμβάνουν την επικάλυψη των 2p τροχιακών του άνθρακα με διάφορους γραμμικούς συνδυασμούς των 1s τροχιακών του υδρογόνου. Η συνεπαγόμενη «3 προς 1» δεσμολογία φαίνεται να τεκμηριώνεται με φωτοηλεκτρονιακές φασματοσκοπικές μετρήσεις.
Το χημικό καθαρό μεθάνιο, στις «κανονικές συνθήκες περιβάλλοντος» (25 °C, 1 atm) είναι αέριο άχρωμο και άοσμο,[17] ελάχιστα διαλυτό στο νερό. Η χαρακτηριστική οσμή τόσο του φυσικού αερίου όσο και του παλαιότερου φωταερίου (που επίσης περιείχε μεθάνιο) δεν προέρχεται από το ίδιο μεθάνιο, αλλά από συνδυασμό φυσικών οσμηρών προσμείξεων και τεχνητής προσθήκης πρόσθετων οσμοθετών, οι οποίοι είναι οσμηρές ουσίες, συνήθως χρησιμοποιούνται για το λόγο αυτό μείγματα που περιέχουν 2-μεθυλο-2-προπανοθειόλη. Οι οσμοθέτες συνηθίζεται να προστίθενται τεχνητά στο φυσικό αέριο, στο φωταέριο ή και στο καθαρό μεθάνιο, αν προορίζεται για καύσιμο, ώστε να ανιχνεύεται πιο εύκολα, σε ενδεχόμενες, αλλά ανεπιθύμητες, διαρροές. Βέβαια, και το ίδιο το φυσικό αέριο συνήθως περιέχει και από τη φύση του θειούχες ουσίες, οπότε έχει και φυσική οσμή. Το μεθάνιο έχει θερμοκρασία βρασμού -161 °C, υπό πίεση 1 atm[18]. Είναι εύφλεκτο μόνο σε ένα (σχετικά) στενό εύρος συγκεντρώσεών του (5–15%), στον ατμοσφαιρικό αέρα. Το υγροποιημένο μεθάνιο δεν καίγεται, παρά μόνο υπό την επίδραση υψηλής πίεσης, συνήθως 4 - 5 atm.[19]
Το στερεοποιημένο μεθάνιο υπάρχει σε αρκετές δομικές μορφές. Προς το παρόν είναι γνωστές εννέα (9) από αυτές.[20] Αν το μεθάνιο ψυχθεί υπό κανονική πίεση σχηματίζεται η δομική μορφή μεθάνιο I. Αυτή η δομική μορφή κρυσταλλώνεται στο κυβικό σύστημα (ομάδα διαστήματος F m - 3 m). Οι θέσεις των ατόμων υδρογόνου στο μόριο του μεθανίου δεν είναι σταθεροποιημένες. Τα μόρια του μεθανίου μπορούν να περιστρέφονται ελεύθερα. Πρόκειται για κατάσταση «πλαστικού κρυστάλλου»[21], όπως ονομάζεται.
Διαλύεται ευκολότερα σε οργανικούς διαλύτες. Η ύπαρξή του δεν ανιχνεύεται εύκολα, ενώ με τον αέρα σχηματίζει εκρηκτικά μείγματα. Αυτός είναι ο λόγος που συχνά αναφέρονται εκρήξεις σε ανθρακωρυχεία.
Φυσική παρουσία
ΕπεξεργασίαΕίναι αρκετά διαδεδομένο στη φύση, καθώς αποτελεί το κύριο συστατικό του φυσικού αερίου (περίπου 87% κατ' όγκο, κατά μέσο όρο). Η κύρια πηγή του μεθανίου είναι από εξόρυξη γεωλογικών αποθεμάτων, που είναι γνωστά ως «κοιτάσματα φυσικού αερίου». Τα κοιτάσματα αυτά συχνά συνδέονται με κοιτάσματα και άλλων υδρογονανθράκων, ενώ επίσης συνήθως συνοδεύονται και από κάποια (τουλάχιστον) από τα ακόλουθα αέρια: υδρόθειο, υδρογόνο, ήλιο ή και άζωτο. Τα υλικά αυτά, που είναι αέρια υπό χαμηλή πίεση, προέρχονται από αναεροβική διάσπαση οργανικών υλικών και ανάδυση μεθανίου από βαθύτερα στρώματα του φλοιού της Γης. Γενικά, τα προερχόμενα υλικά θάφτηκαν αρχικά βαθύτερα και υπό υψηλότερες θερμοκρασίες και πιέσεις, από αυτά που περιέχουν φυσικό αέριο που δημιουργήθηκε μαζί με πετρέλαιο. Απαντάται επίσης σε ανθρακωρυχεία (αέριο ορυχείων) καθώς και σε περιοχές όπως έλη ή πυθμένες λιμνών, όπου γίνεται αποσύνθεση οργανικών υλών και εκλύεται υπό μορφή φυσαλίδων. Η εξόρυξη και μεθανίου από ανθρακωρυχεία γίνεται όλο και πιο σημαντική πηγή μεθανίου. Η μέθοδος εξόρυξης μεθανίου από ανθρακωρυχεία χρησιμοποιείται συνήθως σε μη εξορύξιμα κοιτάσματα άνθρακα.
Γενικά μεταφέρεται με αγωγούς φυσικού αερίου ή με ειδικά LNG μεταγωγικά πλοία, ενώ λίγες χώρες το μεταφέρουν με φορτηγά οχήματα.
Στην ατμόσφαιρα της Γης
ΕπεξεργασίαΣτην αρχή της ιστορίας της Γης (περίπου πριν 3.500.000.000 χρόνια) υπήρχε 1000πλάσια συγκέντρωση CH4 στην ατμόσφαιρα του πλανήτη. Αυτό το αρχικό CH4 θεωρείται ότι απελευθερώθηκε στην ατμόσφαιρα από την ηφαιστειακή δραστηριότητα. Κατά τη διάρκεια αυτής της εποχής πρωτοεμφανίστηκε η ζωή. Αυτά τα πρώτα αρχαϊκά βακτήρια αύξαναν ακόμη περισσότερο το CH4, μεταβολίζοντας (υδρογόνο) (Η2) και διοξείδιο του άνθρακα (CO2) σε CH4 και νερό (H2O):
Το οξυγόνο (O2) δεν είχε ακόμη μεγάλη συγκέντρωση στην ατμόσφαιρα. Αυτό έγινε αργότερα, όταν άρχισε η φωτοσυνθετική δραστηριότητα. Έτσι το CH4 παρέμενε άθικτο για πολύ μεγαλύτερα χρονικά διαστήματα και σε πολύ μεγαλύτερες συγκεντρώσεις από ότι σήμερα.
Αργότερα, όταν άρχισε να αυξάνεται η συγκέντρωση του οξυγόνου (O2), άρχισε μια αργή οξείδωση του CH4, με αποτέλεσμα τη σταδιακή μείωση της συγκέντρωσής του στην ατμόσφαιρα. Σ' αυτό συνέβαλε και η άπλετη υπεριώδης ακτινοβολία από τον ήλιο, αφού ούτε το στρώμα του όζοντος (O3) υπήρχε ακόμη. Συνέβαιναν, λοιπόν, αντιδράσεις της μορφής:
Στη διάσπαση του CH4 έπαιρνε μέρος και η υγρασία:
Φθάνοντας στη σύγχρονη με τον άνθρωπο εποχή, χάρη στην αύξηση του οξυγόνου, η συγκέντρωση του CH4 μειώθηκε δραστικά, αλλά κατά τον τελευταίο αιώνα τείνει να αυξηθεί και πάλι από έντονες ανθρωπογενείς δραστηριότητες και κυρίως τη μαζική κτηνοτροφία βοοειδών.
Το μεθάνιο γενικά παράγεται κοντά στο έδαφος και σταδιακά ανέρχεται στη στρατόσφαιρα με ανοδικά ρεύματα στις τροπικές ζώνες. Σ' αυτά τα στρώματα παράγεται ατομικό οξυγόνο, (O.) που αντιδρώντας με την υγρασία της ατμόσφαιρας παράγει πρόσθετα OH. που αποικοδομούν το CH4
Το μεθάνιο έχει σημαντική συνεισφορά στο φαινόμενο του θερμοκηπίου με σχετικά υψηλό δυναμικό θέρμανσης. Άλλωστε, σταδιακά οξειδώνεται στην οξυγονούχα ατμόσφαιρα, παράγοντας διοξείδιο του άνθρακα (CO2) και υγρασία (H2O), από τα οποία το πρώτο είναι επίσης αέριο του φαινομένου. Η ημιζωή του στην ατμόσφαιρα ανέρχεται σε 7 χρόνια.
Η συγκέντρωση του μεθανίου στη γήινη ατμόσφαιρα το 1998 ήταν 1745 ppb, από 700 ppb το 1750. Την ίδια περίοδο, το CO2 αυξήθηκε αντίστοιχα στα 365 ppm από 278 ppm. Επιπλέον όμως υπάρχει μια μεγάλη, αν και όχι υπολογισμένη, ποσότητα μεθανίου διαλυμένης στους ωκεανούς και τους «αιώνιους πάγους», και η οποία, με την αύξηση της μέσης θερμοκρασίας λόγω του φαινομένου του θερμοκηπίου αρχίζει να επανεκλύεται στην ατμόσφαιρα, γιατί η διαλυτότητα του μεθανίου, όπως και του διοξειδίου του άνθρακα (CO2), στο νερό (Η2O) μειώνεται με την αύξηση της θερμοκρασίας. Η επιπλέον αυτή ποσότητα μεθανίου θα έχει επιπλέον συνεισφορά στο φαινόμενο, επιταχύνοντας τη διαδικασία.
Ο φλοιός της Γης επίσης περιέχει μεγάλες ποσότητες μεθανίου, που συνεχίζουν να παράγονται με τη διαδικασία της αναερόβιας μεθανοσύνθεσης. Άλλες πηγές μεθανίου περιλαμβάνουν τα ηφαίστεια.
Εξωγήινο μεθάνιο
ΕπεξεργασίαΤο μεθάνιο έχει ανιχνευθεί σε αρκετές περιοχές του ηλιακού συστήματος. Πιστεύεται ότι έχει συντεθεί με αβιοτικές διεργασίες, με πιθανή εξαίρεση στον Άρη και στον Τιτάνα, όπου δεν έχει αποκλειστεί η ύπαρξη ζωής στο παρελθόν.
- Αφροδίτη: Η ατμόσφαιρά της περιέχει μια μεγάλη ποσότητα μεθανίου από τα 60 χιλιόμετρα από την επιφάνεια του πλανήτη, σύμφωνα με δεδομένα που συλλέχθηκαν από το Pioneer Venus Large Probe Neutral Mass Spectrometer[23].
- Σελήνη: Εντοπίστηκαν ίχνη που εκλύονται από την επιφάνεια[24].
- Άρης: Στην ατμόσφαιρά του περιέχει 10 ppb μεθάνιο[25]. Η προέλευση του μεθανίου στον Άρη δεν έχει ακόμη αποσαφηνιστεί. Πρόσφατες έρευνες προτείνουν ότι το μεθάνιο μπορεί να εκλύεται από τα ηφαίστεια του πλανήτη, από ρήγματα, μεθανογόνα[26], ότι είναι παραπροϊόν από ηλεκτρικές εκκενώσεις που προκαλούνται από διαβόλους σκόνης ή αμμoθύελλες[27], ή τέλος ότι μπορεί να είναι αποτέλεσμα φωτοχημιικών αντιδράσεων στην ατμόσφαιρα του πλανήτη από την ηλιακή υπεριώδη ακτινοβολία[28]. Τον Ιανουάριο του 2009, επιστήμονες της NASA ανακοίνωσαν ότι ανακάλυψαν ότι στον πλανήτη εκλύεται από αεραγωγούς μεθάνιο στην ατμόσφαιρα σε συγκεκριμένες περιοχές, οδηγώντας σε κάποιες εικασίες ότι μπορεί να συμβαίνει κάποια βιολογική δραστηριότητα κάτω από την επιφάνεια του πλανήτη[29]. Ανάλυση των παρατηρήσεων έγιναν από ένα μετεωρολογικό μοντέλο για τον Άρη (Weather Research and Forecasting model for Mars - MarsWRF) και το συγγενικό μοντέλο γενικής κυκλοφορίας ατμόσφαιρας (Mars general circulation model - MGCM)[30] προτείνουν ότι είναι πιθανό να απομονώσουν περιοχές έκλυσης μεθανίου, με ακρίβεια δεκάδων χιλιομέτρων. Αυτές μπορούν να εξερευνηθούν από ρομποτικά οχήματα που σχεδιάζεται να αποσταλούν στον πλανήτη[30]. Το Curiosity rover, που προσεδαφίστηκε στον Άρη τον Αύγουστο του 2012, είναι ικανό να εκτελέσει μετρήσεις που μπορούν να διαχωρίσουν τα διαφορετικά ισοτοπολόγια του μεθανίου[31][32], αλλά ακόμη και αν η αποστολή του είναι να καθοριστεί αν η μικροσκοπική ζωή του Άρη (υπάρχει και) είναι η πηγή του μεθανίου, οι ιθαγενείς μορφές ζωής είναι πιθανό κατοικούν μακριά κάτω από την επιφάνειά του, δηλαδή εκτός της εμβέλειας του εξερευνητικού ρομποτικού οχήματος[33]. Το σύστημα ανάλυσης δειγμάτων του Curiosity rover (Sample Analysis at Mars - SAM) είναι ικανό να προσδιορίσει τις μεταβολές της συγκέντρωσης μεθανίου σε συνάρτηση με το χρόνο, ώστε να καθοριστεί αν είναι σταθερή ή μεταβαλλόμενη, περιοδική ή τυχαία, προσφέροντας έται πληροφορίες πέρα από μια απλή μέτρηση[34]. Οι πρώτες μετρήσεις με το φασματοφωτόμετρο συντονισμού λέιζερ (Tunable Laser Spectrometer - TLS) έδειξαν ότι υπάρχουν λιγότερα από 5 ppb μεθανίου στο σημείο προσεδάφισης και σημείου αναφοράς των μετρήσεων[35][36][37][38]. Το 2016 σχεδιάζεται να εκτοξευθεί η αποστολή τεχνητού δορυφόρου μελέτης ιχναερίων (Mars Trace Gas Mission orbiter) στον Άρη, που θα βοηθήσει στην επιπλέον μελέτη του μεθανίου στον πλανήτη[39][40], αλλά και πιθανά παράγωγα προϊόντα του, όπως μεθανόλη και μεθανάλη. Εναλλακτικά, αυτές οι ενώσεις μπορεί να αναπληρώνονται από δράση ηφαιστείων και άλλων γεωλογικών μέσων, όπως η serpentinization[41].
- Δίας: Η ατμόσφαιρά του περιέχει περίπου 0,3% μεθάνιο.
- Κρόνος: Η ατμόσφαιρά του περιέχει περίπου 0,4% μεθάνιο.
- Ιαπετός.
- Τιτάνας: Η ατμόσφαιρά του περιέχει περίπου 1,6% μεθάνιο[42]., ενώ έχουν ανιχνευθεί χιλιάδες λίμνες μεθανίου στην επιφάνεια του πλανήτη[43]. Στην ανώτερη ατμόσφαιρα του Τιτάνα το μεθάνιο συμπυκνώνεται σε πιο πολύπλοκα μόρια, που περιλαμβάνουν το ακετυλένιο, μια διεργασία που παράγει επίσης μοριακό υδρογόνο. Υπάρχουν ενδείξεις ότι το ακετυλένιο και το υδρογόνο ξαναμετατρέπονται σε μεθάνιο, κοντά στην επιφάνεια του δορυφόρου. Αυτό είναι αρκετά περίεργο, γιατί για να πραγματοποιηθεί μια τέτοια μετατροπή απαιτεί την παρουσία κάποιου «εξωτικού» καταλύτη ή κάποια άγνωστη μορφή ζωής, που την πραγματοποιεί[44]. Μία (τουλάχιστον) εμφανής λίμνη υγρού μεθανίου έχει εντοπιστεί από το διαστημικό βολιστήρα Κασσίνι-Χόυχενς, που προκαλεί στους ερευνητές να κάνουν υποθέσεις σχετικά με την πιθανότητα ύπαρξης μορφών ζωής στον Τιτάνα[45]. Βροχές μεθανίου έχουν επίσης παρατηρηθεί, πιθανώς προκαλούμενες από την αλλαγές εποχών[46].
- Εγκέλαδος: Η ατμόσφαιρά του περιέχει περίπου 1,7% μεθάνιο[47].
- Ουρανός: Η ατμόσφαιρά του περιέχει περίπου 2,3% μεθάνιο.
- Άριελ: Το μεθάνιο πιστεύεται ότι είναι συστατικό του επιφανειακού της πάγου.
- Μιράντα.
- Όμπερον: Περίπου το 20% του επιφανειακού του πάγου πιστεύεται ότι αποτελείται από μεθάνιο ή και αζωτούχα παράγωγά του.
- Τιτάνια - Περίπου το 20% του επιφανειακού του πάγου πιστεύεται ότι αποτελείται από μεθάνιο ή και άλλα οργανικά παράγωγά του.
- Ουμβριήλ: Το μεθάνιο πιστεύεται ότι είναι συστατικό του επιφανειακού της πάγου.
- Ποσειδώνας: Η ατμόσφαιρά του περιέχει περίπου 1,6% μεθάνιο.
- Πλούτωνας: φασματοσκοπική ανάλυση της επιφάνειάς του αποκαλύπτει ότι περιέχει ίχνη μεθανίου[50][51].
- Έρις: Η υπέρυθρη ακτινοβολία από το αντικείμενο αποκαλύπτει την παρουσία παγωμένου μεθανίου[53].
- Κομήτης του Χάλεϋ.
- Κομήτης Χιακουτάκε: Αστεροσκοπεία επιφανείας έχουν εντοπίσει αιθάνιο και μεθάνιο στον κομήτη[54].
- Εξωηλιακός πλανήτης HD 189733b: Περιέχει την πρώτη ανίχνευση οργανικής ουσίας σε πλανήτη εκτός του ηλιακού συστήματος. Είναι άγνωστο από πού προήλθε, δεδομένου ότι η υψηλή θερμοκρασία των 700 °C ευνοεί έντονα τη διάσπαση κάθε οργανικής ένωσης προς σχηματισμό CO[55].
- Διαστρικά νεφελώματα[56].
Παραγωγή
ΕπεξεργασίαΒιολογική παραγωγή
ΕπεξεργασίαΤο μεθάνιο που βρίσκεται στη φύση από μη ανθρωπογενείς αιτίες παράγεται κυρίως από μια βιοχημική διεργασία που ονομάζεται «μεθανογένεση». Είναι το συνολικό αποτέλεσμα διεργασιών που χρησιμοποιούνται από μικροοργανισμούς για την παραγωγή ενέργειας απουσία οξυγόνου. Η καθαρή αντίδραση αποδίδεται στοιχειομετρικά ως εξης:
Το τελικό βήμα της διεργασίας καταλύεται από το ένζυμο αναγωγάση του μεθυλοσυνενζυμου Μ. Η μεθανογενεση είναι μια μορφή αναερόβιου μεταβολισμού, που χρησιμοποιείται τόσο από ελεύθερους όσο και από συμβιωτικούς μικροοργανισμούς, οι οποίοι μεταξύ άλλων ζουν σε χωματερές, έντερα θηλαστικών και τερμιτών.
Είναι αβέβαιο αν τη χρησιμοποιούν και κάποια φυτά[57][58][59].
Απομόνωση από φυσικές και βιομηχανικές πηγές
ΕπεξεργασίαΤο μεθάνιο στο φυσικό αέριο
ΕπεξεργασίαΤο φυσικό αέριο αποτελεί την κύρια πηγή απομόνωσης μεθανίου. Πρόκειται για μείγμα αερίων που βρίσκεται σε φυσικά κοιτάσματα εγκλεισμένα στο φλοιό της Γης. Συνήθως αποτελείται από μείγμα αερίων υδρογονανθράκων, κυρίως μεθανίου και αιθανίου, και υδρογόνου. Μερικές φορές περιέχει επίσης ήλιο, άζωτο και υδρόθειο. Το αέριο αυτό θεωρείται γενικά ότι παράγεται με αναερόβια αποσύνθεση οργανικών υλικών υπό πίεση βαθιά κάτω από τη γήινη επιφάνεια.
Βιοαέριο
ΕπεξεργασίαΠέρα από τα αποθέματα φυσικού αερίου, μια εναλλακτική πηγή μεθανίου είναι το βιοαέριο. Αυτό παράγεται από την επίσης αναερόβια αποσύνθεση οργανικών υλικών που προέρχονται από ανθρώπινα λύματα παραχωμένα σε χωματερές, από υπονόμους, βόθρους, ημιτελείς βιολογικούς καθαρισμούς και από βιοδιασπώμενα υπολείμματα ζωοτροφών.
Μια εναλλακτική πηγή βιοαερίου αποτελούν τα βουστάσια, τα χοιροστάσια και τα εκτροφεία πουλερικών: Τα ζώα αυτά αποβάλλουν αέρια ως παραπροϊόντα της πέψης τους. Ειδικά τα πρώτα θεωρείται ότι παράγουν το 16% της ετήσιας διαφυγής μεθανίου στην ατμόσφαιρα του πλανήτη μας[60]. Αν προσθέσουμε τα χοιροστάσια και τα εκτροφεία πουλερικών φτάνουμε στο 37%[61] [62][63][64]. Το υπόλοιπο προέρχεται από το αντίστοιχο αέριο που παράγουν οι άνθρωποι, το υπόλοιπο ζωικό βασίλειο, οι ορυζώνες (που επίσης μπορούν να χρησιμοποιηθούν σαν πηγή βιοαερίου και άρα μεθανίου) και διάφορες γεωλογικής προέλευσης πηγές.
Οι μεθανυδρίτες
ΕπεξεργασίαΑκόμη υπάρχουν αποθέματα μεθανυδριτών (methane hydrates/clathrates), ένα είδος «διαλύματος» (δηλαδή ομογενούς μείγματος) αερίου μεθανίου σε κρυστάλλους πάγου στο οποίο μόρια μεθανίου εγκλωβίζονται στο κενό που δημιουργούν τα μόρια του νερού, κατά την πήξη του σε πάγο, στο εσωτερικό των κρυστάλλων του. Αυτά καταβυθίζονται στον πυθμένα του ωκεανού ψυχρών περιοχών ή σχηματίζονται στο παγωμένο έδαφος τούνδρας. Το μεθάνιο αυτό εγκλωβίστηκε στο μακρινό παρελθόν, σε εποχές που η Γη είχε πάθει εκτεταμένη παγογένεση και ταυτόχρονα περιείχε ακόμη μεγάλες συγκεντρώσεις μεθανίου στην ατμόσφαιρά της. Τα αποθέματα αυτά αποτελούν μεγάλη πηγή μεθανίου, για το μέλλον, αλλά ταυτόχρονα απειλούν τον πλανήτη με επιπλέον οικολογική καταστροφή στην περίπτωση που λιώσουν και απελευθερώσουν το μεθάνιό τους εξαιτίας της υπερθέρμανσης του πλανήτη από το φαινόμενο του θερμοκηπίου.
Μετά την ενεργειακή επανάσταση του σχιστολιθικού αερίου (shale gas)[65], οι υδρίτες μεθανίου[66] αποτελούν μία από τις πολλά υποσχόμενες πηγές ενέργειας του 21ου αιώνα. Τα παγκόσμια αποθέματα υδριτών αερίου είναι τεράστια κι εκτιμώνται σε τετράκις εκατομμύρια (δηλαδή 1015) κυβικά μέτρα τα οποία αντιστοιχούν σε 100 και πλέον φορές τα μέχρι σήμερα γνωστά αποθέματα φυσικού αερίου παγκοσμίως.[67]
Τεράστιες ποσότητες υδριτών μεθανίου βρίσκονται στους πυθμένες των ωκεανών ή και κάτω από αυτούς, όπως επίσης και στο μόνιμα παγωμένο έδαφος (permafrost) των πολικών περιοχών της Αλάσκας, του Καναδά και κυρίως της Σιβηρίας. Οι αποθέσεις των υδριτών μπορεί να έχουν πάχος μέχρι και μερικές εκατοντάδες μέτρα και είναι αποτέλεσμα τόσο βιολογικών δραστηριοτήτων στα ιζήματα, όσο και γεωλογικών διεργασιών. Εξαιτίας του συνδυασμού υψηλών πιέσεων και χαμηλών θερμοκρασιών, οι υδρίτες αυτοί διατηρούνται σταθεροί εδώ και εκατοντάδες εκατομμύρια χρόνια.[68]
Έχει προταθεί η αξιοποίηση των υδριτών μεθανίου ως εναλλακτικής πηγής φυσικού αερίου. Μόνο στους ωκεανούς εκτιμάται ότι βρίσκονται περίπου 6,4 τρισεκατομμύρια τόννοι μεθανίου στη μορφή υδριτών. Τα αποδεδειγμένα αποθέματα πετρελαίου και φυσικού αερίου είναι 1,1 έως 1,3 τρισεκατομμύρια βαρέλια πετρελαίου και 170 τρισεκατομμύρια κυβικά μέτρα φυσικού αερίου. Αν οι ποσότητες αυτές μετατραπούν σε ισοδύναμη ενέργεια (θερμότητα), μπορεί να εκτιμηθεί ότι η ενέργεια που εμπεριέχουν τα αποθέματα υδριτών του μεθανίου είναι σχεδόν 30 φορές μεγαλύτερη από τη συνολική ενέργεια που εμπεριέχουν τα αποδεδειγμένα αποθέματα πετρελαίου και φυσικού αερίου.[68][69]
Βιομηχανικές πηγές
ΕπεξεργασίαΒιομηχανικά το μεθάνιο μπορεί να παραχθεί από ατμοσφαιρικό αέρα (που περιέχει διοξείδιο του άνθρακα) και υδρογόνο μέσω ειδικών χημικών αντιδράσεων όπως οι ακόλουθες:
Η διεργασία Sabatier ή αντίδραση Sabatier περιλάμβανε αρχικά την καταλυτική αναγωγή διοξειδίου του άνθρακα (CO2) από διυδρογόνο (H2), παρουσία νικελίου, (Ni) στο ρόλο του καταλύτη, και σε αυξημένη θερμοκρασία. Ανακαλύφθηκε από το Γάλλο χημικό Πωλ Σαμπατιέρ (Paul Sabatier). Αργότερα βρέθηκε ότι άλλοι καταλύτες, όπως το ρουθήνιο (Ru) ή η αλουμίνα (Al2O3), είναι πιο αποτελεσματικοί γι' αυτήν την αντίδραση από το νικέλιο. Η αντίδραση περιγράφεται από την ακόλουθη στοιχειομετρική εξίσωση:
Έχει προταθεί να χρησιμοποιηθεί η παραπάνω αντίδραση για την αποθήκευση ενέργειας που προέρχεται από πλεόνασμα αυτής από σύστημα ανανεώσιμων πηγών, όπως η αιολική, η φωτοβολταϊκή, η υδροηλεκτρική, κ.τ.λ., με την παραγωγή μεθανίου, δηλαδή συνθετικού φυσικού αερίου[70],[71].
2. Απομονώνεται από το φωταέριο.
3. Απομονώνεται από αέρια μείγματα που προκύπτουν από πυρόλυση προϊόντων διύλισης πετρελαίου ή πολυμερών υδρογονανθράκων.
Με ειδικές μεθόδους
Επεξεργασία1. Με απευθείας ένωση άνθρακα (C) και διυδρογόνου (H2) (απουσία αέρα) σε υψηλή θερμοκρασία και πίεση και παρουσία καταλυτών[15]:
2. Με την επίδραση νερού (Η2O) σε ανθρακαργίλιο (Al4C3)[72]:
3. Με καταλυτική αναγωγή μονοξειδίου του άνθρακα (CO) από υδρογόνο (H2)[15]:
Παρασκευή με αντιδράσεις χωρίς αλλαγή μήκους ανθρακικής αλυσίδας
ΕπεξεργασίαΜε αναγωγή αλογονούχων ενώσεων
Επεξεργασία1. Με αναγωγή αλομεθάνιου (CH3X) από «υδρογόνο εν τω γεννάσθαι» (|H|), δηλαδή μέταλλο[73] + οξύ[74][75]:
2. Με αναγωγή αλομεθάνιου από αργιλιολιθιοϋδρίδιο (LiAlH4) ή νατριοβοριοϋδρίδιο (NaBH4) [76]:
3. Με αναγωγή ιωδομεθάνιου (CH3I) από υδροϊώδιο (ΗΙ)[77]:
4. Με αναγωγή μεθυλαλογονιδίου από σιλάνιο, παρουσία τριφθοριούχου βορίου παράγεται μεθάνιo[78]:
5. Αναγωγή από ένα αλκυλοκασσιτεράνιο. Π.χ.[79]:
6. Με αναγωγή από μέταλλα, συνήθως λίθιο ή μαγνήσιο, και στη συνέχεια υδρόλυση των παραγόμενων οργανομεταλλικών ενώσεων:
Με αναγωγή οξυγονούχων ενώσεων
ΕπεξεργασίαΜε αναγωγή μεθανάλης (HCHO): Αντίδραση Wölf-Kishner, με υδραζίνη (NH2NH2)[84]:
Με αναγωγή θειούχων ενώσεων
Επεξεργασία1. Με αναγωγή των κατάλληλων θειολών μπορεί να παραχθεί μεθάνιο. Π.χ. από την αναγωγή της μεθανοθειόλης (μέθοδος Raney)[85]:
2. Με αναγωγή των κατάλληλων θειαιθέρων μπορεί να παραχθεί μεθάνιο. Π.χ. από την αναγωγή του διμεθυλοθειαιθέρα (μέθοδος Raney)[85]:
Αντιδράσεις αποσύνθεσης: Μείωση του μήκους της ανθρακικής αλυσίδας
ΕπεξεργασίαΜε τη θέρμανση αιθανικό οξύ (CH3COOH) σε αλκαλικό περιβάλλον[86]:
- Μια άλλη στοιχειομετρική εξίσωση που αποδίδει την αντίδραση είναι η ακόλουθη[15]:
Χημικές ιδιότητες και παράγωγα
ΕπεξεργασίαΟι κύριες αντιδράσεις του μεθανίου είναι:
Γενικά, οι αντιδράσεις του μεθανίου είναι τέτοιας φύσης (με μηχανισμούς ελευθέρων ριζών), ώστε είναι δύσκολο να ελεγχθούν, τουλάχιστον όσων αφορά τη συμπαραγωγή όχι καλά προβλεπόμενων και επιθυμητών παραπροϊόντων.
Εκλεκτική οξείδωση
ΕπεξεργασίαΗ μερική οξείδωση του μεθανίου σε μεθανόλη (CH3OH) είναι μια πρόκληση, γιατί κανονικά η διεργασία της οξείδωσης του μεθανίου τείνει να δώσει τα τελικά προϊόντα της, δηλαδή διοξείδιο του άνθρακα (CO2) και νερό (H2O), ακόμη και όταν υπάρχει σχετική έλλειψη οξυγόνου. Υπάρχει όμως το ένζυμο μονοξυγενάση του μεθανίου, που μπορεί να παραγάγει βιοχημικά μεθανόλη από μεθάνιο, αλλά (προς το παρόν τουλάχιστον) δεν μπορεί να χρησιμοποιηθεί για παραγωγή βιομηχανικής κλίμακας[87]. Επιπλέον, έχουν αναπτυχθεί κάποια καταλυτικά συστήματα, τόσο ομογενή όσο και ετερογενή, αλλά ακόμη όλα τους έχουν σημαντικά μειονεκτήματα. Αυτά γενικά λειτουργούν παράγοντας προστατευμένα προϊόντα μερικής οξείδωσης του μεθανίου, με την έννοια ότι παρεμποδίζεται η υπεροξείδωσή τους. Παραδείγματα τέτοιων συστημάτων αποτελούν το σύστημα Καταλύτικα ( Catalytica system), οι ζεόλιθοι χαλκού και οι ζεόλιθοι σιδήρου που σταθεροποιούν την περιοχή γύρω από το προσωρινά σχηματιζόμενο ενεργό α-οξυγόνο.[88]
Μια ομάδα βακτηρίων καθοδηγούν την οξείδωση του μεθανίου, χρησιμοποιώντας νιτρώδη ανιόντα (NO2–) ως οξειδωτικό μέσο, απουσία οξυγόνου, προκαλώντας έτσι αναεροβική οξείδωση του μεθανίου.[89]
Οξεοβασική συμπεριφορά
ΕπεξεργασίαΌπως και οι άλλοι υδρογονάνθρακες, το μεθάνιο είναι πολύ ασθενές οξύ. Σε διμεθυλοσουλφοξείδιο εκτιμάται ότι έχει pKa = 56[90]. Δεν μπορεί να αποπρωτονιωθεί σε διάλυμα, αλλά είναι γνωστό, για παράδειγμα, το μεθυλολίθιο, που περιέχει ανιόν μεθυλίου (CH3–, το οποίο μπορεί να θεωρηθεί ως η συζυγής βάση του μεθανίου.
Έχει, ακόμη, παρατηρηθεί μια ποικιλία θετικών ιόντων που μπορεί να παραχθεί από το μεθάνιο, κυρίως ως ασταθή χημικά είδη, σε χαμηλής πυκνότητας αέρια μείγματα. Αυτά περιλαμβάνουν τα ακόλουθα, κάποια από τα οποία έχουν επίσης ανιχνευθεί και στο διάστημα:
- «Κατιόν μεθυλίου» (CH3+).
- «Κατιόν μεθανίου» (CH4+).
- «Μεθανοϊόν» (CH5+), με πρωτονίωση του μεθανίου από χρήση σουπεροξέων[91].
- Κατιόντα με υψηλότερο φορτίο, όπως CH62+ και CH73+ έχουν μελετηθεί θεωρητικά και συζυγοποιήθηκαν, για να γίνουν σταθερά[92].
Παρ' όλη την ισχύ των τεσσάρων (4) δεσμών C-H που διαθέτει, υπάρχει έντονο (ερευνητικό) ενδιαφέρον για ενεργοποίηση των δεσμών αυτών στο μεθάνιο και τα άλλα ελαφρά αλκάνια[93].
Καύση
ΕπεξεργασίαΤο μεθάνιο αντιδρά με οξυγόνο και καίγεται παράγοντας γαλαζωπή φλόγα υψηλής θερμοκρασίας. Η θερμότητα καύσης του μεθανίου είναι 55,5 MJ/kg[94]. Η καύση του μεθανίου είναι στην πραγματικότητα μια σύνθετη χημική αντίδραση, είναι δηλαδή το συνολικό αποτέλεσμα πολλών απλούστερων αντιδράσεων. Πιο συγκεκριμένα, οι στοιχειομετρικές εξισώσεις των επιμέρους αντιδράσεων της καύσης μεθανίου είναι οι ακόλουθες:
Αν και η αντίδραση είναι έντονα εξώθερμη δεν συμβαίνει σε μέτριες θερμοκρασίες, γιατί για την έναρξή της πρέπει να υπερπηδηθεί πρώτα το εμπόδιο της διάσπασης των δεσμών C-H[95] και των δεσμών (Ο=Ο)[96] του O2. Γι' αυτό, το σύμβολο M* αντιπροσωπεύει κάποιο ενεργητικό μέσο που μεταφέρει με κάποιον τρόπο την απαιτούμενη θερμότητα, για παράδειγμα με τη θερμική μοριακή σύγκρουση. Η μεθανάλη (HCHO, αντίδραση #7) είναι μια αρχική ενδιάμεση ένωση. Η οξείδωση της μεθανάλης δίνει ρίζα φορμυλίου (CHO, αντιδράσεις #8-#10), που δίνει με τη σειρά της ως άλλη ενδιάμεση ένωση το μονοξείδιο του άνθρακα (CO, αντιδράσεις #11-#13). Κάθε ενδιάμεσα παραγόμενο υδρογόνο (H2) οξειδώνεται σε νερό (H2Ο ή άλλα ενδιάμεσα, αντιδράσεις #14 και #15). Τελικά, το μονοξείδιο του άνθρακα οξειδώνεται σε διοξείδιο του άνθρακα (CO2, αντίδραση #16). Οι τελευταίες αντιδράσεις, #17-#19, παράγουν ενέργεια που μεταδίδεται σε ενεργητικά μέσα (M*), που συνεχίζουν την αντίδραση μέχρι να εξαντληθεί το καύσιμο ή και το οξειδωτικό. Η συνολική ταχύτητα αντίδρασης είναι μια συνάρτηση της συγκέντρωσης διαφόρων παραγόντων κατά τη διάρκεια της καύσης. Σε υψηλότερη θερμοκρασία είναι μεγαλύτερη η συγκέντρωση των ελευθέρων ριζών και γι' αυτό αυξάνεται και η ταχύτητα της διεργασίας της καύσης.
Τελικά, η συνολική στοιχειομετρική αντίδραση της τέλειας καύσης του μεθανίου είναι[97]:
Σε αέρια κατάσταση είναι εύφλεκτο μόνο σε ένα μικρό εύρος συγκεντρώσεων (5–15%) στον ατμοσφαιρικό αέρα. Το υγροποιημένο μεθάνιο δεν καίγεται παρά μόνο κάτω από υψηλή πίεση (4 - 5 ατμόσφαιρες)[98].
Καταλυτική οξυγόνωση μεθανίου σε μεθανάλη
ΕπεξεργασίαΤο μεθάνιο μπορεί να οξυγονωθεί καταλυτικά σε μεθανάλη, εφόσον η τελευταία είναι ένα προϊόν μερικής καύσης του μεθανίου. Το πρόβλημα με αυτήν τη μέθοδο είναι ότι η ίδια η μεθανάλη είναι πιο εύφλεκτη από το μεθάνιο, οπότε είναι πολύ πιθανό η παραγώμενη μεθανάλη να οξειδωθεί πριν από το υπόλοιπο μεθάνιο[99]:
Παραγωγή υδραερίου
Επεξεργασία
Οξειδωτικό ζευγάρωμα
ΕπεξεργασίαΟξειδωτικό ζευγάρωμα προς αιθυλένιο και ακετυλένιο[100][101][102]:
Αντίδραση με διοξιράνιο
ΕπεξεργασίαΤο μεθάνιο οξειδώνεται από το διοξιράνιο, παράγοντας μεθανόλη:
Αλογόνωση[103]
Επεξεργασία
- Δραστικότητα των X2: F2 > Cl2 > Br2 > Ι2.
- Ανάλυση του μηχανισμού της χλωρίωσης του CH4:
- 1. Έναρξη: Παράγονται ελεύθερες ρίζες.
- Η απαιτούμενη ενέργεια προέρχεται από το υπεριώδες φως (UV) ή θερμότητα (Δ).
- 2. Διάδοση: Καταναλώνονται οι παλιές ελεύθερες ρίζες, σχηματίζοντας νέες.
- 3. Τερματισμός: Καταναλώνονται μεταξύ τους οι ελεύθερες ρίζες, κατά τη στατιστικά σπάνια περίπτωση της συνάντησής τους.
- Είναι, όμως, πρακτικά δύσκολο να σταματήσει η αντίδραση στην παραγωγή CH3X.
- Αν χρησιμοποιηθούν ισομοριακές ποσότητες CH4 και Χ2 θα παραχθεί μείγμα CH3X, CH2X2, CHX3, ακόμη και CX4.
- Αν χρησιμοποιηθει περίσσεια CH4, τότε η απόδοση του CH3X αυξάνεται πολύ, λόγω της αύξησης της στατιστικής πιθανότητας συνάντησης CH4 με X• σε σχέση με την πιθανότητα συνάντησης CH3X και X•, που μπορεί να οδηγήσει στην παραγωγή CH2X2, κ.τ.λ.
Νίτρωση
Επεξεργασία- Αντιδρά με ατμούς HNO3 στην αέρια φάση, παράγοντας νιτρομεθάνιο[105]:
Παρεμβολή καρβενίων
Επεξεργασία
Σύνοψη
ΕπεξεργασίαΕφαρμογές
ΕπεξεργασίαΤο μεθάνιο χρησιμοποιήθηκε για βιομηχανικές χημικές διεργασίες και μπορεί να μεταφερθεί υγροποιημένο υπό ψύξη (συνήθως ως υγροποιημένο φυσικό αέριο, LNG). Παρόλο που τυχόν διαφυγές από υγροποιημένο μεθάνιο είναι προσωρινά βαρύτερες από τον αέρα, με τη σταδιακή εξισορρόπηση της θερμοκρασίας, το μεθάνιο γίνεται ελαφρύτερο από τον ατμοσφαιρικό αέρα. Επίσης, αγωγοί φυσικού αερίου διανέμουν μεγάλες ποσότητες φυσικού αερίου, του οποίου το μεθάνιο είναι το κύριο συστατικό.
Ως καύσιμο
ΕπεξεργασίαΤο μεθάνιο, με τη μορφή του φυσικού αερίου, είναι σημαντικό για την παραγωγή ηλεκτρικής ενέργειας τόσο με καύση σε αεριοστρόβιλο, όσο και σε λέβητα ατμοστροβίλου. Σε σύγκριση με άλλα καύσιμα υδρογονανθράκων, το μεθάνιο παράγει λιγότερο διοξείδιο του άνθρακα για κάθε μονάδα ενέργειας που αποδίδει. Περίπου 891 kJ/mol είναι η μοριακή θερμότητα τέλειας καύσης του μεθανίου, χαμηλότερη από κάθε άλλον υδρογονάνθρακα. Όμως, έχει μοριακή μάζα ~16 g/mol, από την οποία τα ~12 g/mol είναι ο άνθρακας. Αυτό δείχνει ότι το μεθάνιο αποδίδει 55,7 kJ/g, δηλαδή πολύ περισσότερη από κάθε άλλο υδρογονάνθρακα. Σε πολλές πόλεις παγκοσμίως χρησιμοποιείται φυσικό αέριο (δηλαδή κυρίως μεθάνιο) στα σπίτια για θέρμανση και μαγείρεμα, με μέση ενεργειακή απόδοση ~39 MJ/m³ ή ~1.000 BTU/ft³.
Ακόμη, το μεθάνιο, με τη μορφή συμπιεσμένου φυσικού αερίου, χρησιμοποιήθηκε ως καύσιμο οχημάτων και θεωρήθηκε ως περιβαλλοντολογικά φιλικότερο από άλλα ορυκτά καύσιμα, όπως η βενζίνη και το ντίζελ[107]. Η έρευνα σε μεθόδους προσρόφησης για την αποθήκευση μεθανίου για ευκολότερη χρήση του ως καύσιμο οχημάτων συνεχίζεται[108].
Το μεθάνιο που εκλύεται από ανθρακωρυχεία αξιοποιείται επίσης για την παραγωγή ηλεκτρικής ενέργειας[109].
Υγροποιημένο μεθάνιο ως καύσιμο πυραύλων
ΕπεξεργασίαΣε μορφή υψηλής καθαρότητας, το υγροποιημένο μεθάνιο έχει ερευνηθεί ως καύσιμο πυραύλων[110]. Ένας αριθμός από ρωσικούς πυραύλους έχουν προταθεί να χρησιμοποιήσουν υγροποιημένο μεθάνιο από τη δεκαετία του 1990[111]. Ακόμη, αμερικανικές εταιρίες, όπως η Orbitech και η XCOR Aerospace, έχουν αναπτύξει προωθητικούς κινητήρες πυραύλων υγροποιημένου μεθανίου - υγροποιημένου οξυγόνου το 2005[112]. Αργότερα, το 2007, ανέπτυξαν ένα μεγαλύτερο προωθητικό κινητήρα ώθησης 33 kN, ως εν δυνάμει προωθητήρα CEV, για χρήση σε διαστημόπλοια που θα επιστρέφουν από τη Σελήνη[113]. Ακόμη πιο πρόσφατα, το 2012, η αμερικανική ιδιωτική διαστημική εταιρεία SpaceX ανακοίνωσε μια καινοτομία για ανάπτυξη προωθητικών κινητήρων πυραύλων υγροποιημένου μεθανίου[114], περιλαμβάνοντας τελικά, τον κινητήρα δευτέρου σταδίου Raptor[115].
Έως το 2009 έγινε έρευνα, που αφορούσε το υγροποιημένο μεθάνιο ως εν δυνάμει καύσιμο προώθησης πυραύλων, από τη NASA[116].
Ένα πλεονέκτημα της χρήσης του μεθανίου ως καύσιμο πυραύλων είναι ότι είναι (σχετικά) άφθονο σε πολλά τμήματα του ηλιακού μας συστήματος και έτσι θα μπορούσε (υποθετικά) να συλλεχθεί και από άλλα ουράνια σώματα του συστήματος και να χρησιμοποιηθεί, παρέχοντας έτσι καύσιμο για την (οικονομικότερη) επιστροφή από αυτά[117]. Οι μέχρι τώρα προωθητήρες μεθανίου αποδίδουν έως και 33 kN ώθησης, αν και αυτή απέχει πολύ από την ισχύ των 31 ΜΝ ώση, που απαιτεί η εκτόξευση ενός διαστημικού λεωφορείου. Έτσι, προς το παρόν, τέτοιοι προωθητικοί κινητήρες είναι πιο πιθανό να χρησιμεύσουν σε ταξίδια από τη Σελήνη ή να στείλουν ρομποτικές εξερευνήσεις σε άλλους πλανήτες του ηλιακού συστήματος[118].
Ως χημική πρόδρομη ύλη
ΕπεξεργασίαΈχει χρησιμοποιηθεί κατά καιρούς ως πρόδρομη ύλη των ακολούθων παραγώγων:
- Υδραέριο (CO + H2)
- Μεθανόλη (CH3OH)
- Νιτρομεθάνιο (CH3NO2)
- Αλομεθάνια (CH4-xXx, όπου X: αλογόνο[119], αλλά όχι απαραίτητα το ίδιο για κάθε X, και x : 1-4)
- Μεθανάλη (HCHO)
- Ακετυλένιο (ΗC≡CH)
- Αιθυλένιο [CH2=CH2)
- Αιθάνιο (CH3CH3)
Υδραέριο
ΕπεξεργασίαΠαρόλο που υπάρχει μεγάλο ενδιαφέρον μετατροπής του μεθανίου σε πιο χρήσιμες, ή τουλάχιστον πιο εύκολα υγροποιήσιμες και επομένως πιο εύχρηστες χημικές ενώσεις (ή και μείγματα αυτών), η μόνη προς το παρόν υπάρχουσα πρακτική διεργασία είναι σχετικά ανεπιθύμητη: Στη χημική βιομηχανία το μεθάνιο με επίδραση υδρατμών μετατρέπεται σε υδραέριο, ένα μείγμα μονοξειδίου του άνθρακα και υδρογόνου. Πρόκειται, όμως, για μια ενεργοβόρα διεργασία, που χρησιμοποιεί νικέλιο ως καταλύτη και απαιτεί υψηλές θερμοκραίες, γύρω στους 700–1100 °C:
Αμμωνία
ΕπεξεργασίαΑνάλογες χημικές διεργασίες ερευνήθηκαν και αξιοποιήθηκαν στη σύνθεση αμμωνίας Haber-Bosch, στην οποία το μεθάνιο (προερχόμενο από το φυσικό αέριο) αντιδρά με το άζωτο και το οξυγόνο του ατμοσφαιρικού αέρα σχηματίζοντας διοξείδιο του άνθρακα, νερό και αμμωνία. Συνολικά, με πρόσθεση κατά μέρη των στοιχειομετρικών εξισώσεων:
Αλομεθάνια
ΕπεξεργασίαΤο μεθάνιο μπορεί ακόμη να υποστεί αλογόνωση (συνήθως χλωρίωση) με το μηχανισμό των ελευθέρων ριζών (δείτε παραπάνω), για την παραγωγή αλομεθανίων [συνήθως χλωρομεθανίου (CH3Cl, R-40), διχλωρομεθάνιου (CH2Cl2, R-30), τριχλωρομεθανίου (CHCl3, R-20) και τετραχλωράνθρακα (CCl4, R-10), αν και για την παραγωγή του πρώτου χρησιμοποιείται περισσότερο η μεθανόλη, ως πρόδρομη ύλη][120].
Ασφάλεια
ΕπεξεργασίαΤο ίδιο το μεθάνιο δεν είναι τοξικό. Είναι, όμως, εξαιρετικά εύφλεκτο και μπορεί να προκαλέσει έκρηξη σε μείγματα με αέρα. Επίσης, το μεθάνιο αντιδρά βίαια με οξειδωτικές ουσίες, στις οποίες συμπεριλαμβάνονται τα αλογόνα και μερικές αλογονούχες ενώσεις. Επίσης είναι δυνατό να προκαλέσει ασφυξία, γιατί απλά μπορεί να μειώσει τη συγκέντρωση του οξυγόνου σε κλειστούς χώρους. Η ασφυξία μπορεί να συμβεί αν η συγκέντρωση οξυγόνου μειωθεί κάτω από το επίπεδο του 16% κατ' όγκο. Οι περισσότεροι άνθρωποι μπορούν να ανεχθούν τη μείωση της συγκέντρωσης του οξυγόνου από το φυσιολογικό 21% ως το 16%, χωρίς συμπτώματα αδιαθεσίας. Έτσι, η συγκέντρωση μεθανίου στην οποία γίνεται σημαντικός κίνδυνος ασφυξίας για ανθρώπους είναι πολύ υψηλότερη από το 5-15%, συγκέντρωση στην οποία υπάρχει κίνδυνος ανάφλεξης του μεθανίου. Πιθανά προβλήματα υγείας που παρατηρήθηκαν από την εισπνοή μεθανίου σε υψηλές συγκεντρώσεις, είναι ουσιαστικά εξαιτίας της μείωσης της συγκέντρωσης οξυγόνου και όχι εξαιτίας της ίδιας της παρουσίας του μεθανίου. Πάντως, τα συμπτώματα είναι (σε κλιμάκωση) αυξημένος ρυθμός αναπνοής, υψηλότεροι καρδιακοί παλμοί, έλλειψη μυϊκού συντονισμού, συναισθηματική αναστάτωση, ναυτία, εμετός, απώλεια της συνείδησης, αναπνευστική κατάρρευση και θάνατος[121]. Το μεθάνιο που τυχόν βρίσκεται στον εξωτερικό χώρο μπορεί να διεισδύσει στο εσωτερικό ενός κτιρίου, π.χ. κοντά σε χωματερές και να εκθέσει τους ενοίκους του (κτιρίου) σε σημαντικά επίπεδα συγκέντρωσης μεθανίου. Κάποια κτίρια έχουν εφοδιαστεί με ειδικά συστήματα κάτω από τα υπόγειά τους, για να συλλαμβάνουν το μεθάνιο και να το απομακρύνουν από το κτήριο.
Εκρήξεις από μεθάνιο είναι υπεύθυνες για πολλά θανατηφόρα δυστυχήματα σε ορυχεία[122]. Έκρηξη μεθανίου προκάλεσε δυστύχημα στο ανθρακωρυχείο Upper Big Branch της Δυτική Βιρτζίνια στις 5 Απριλίου 2010, με 25 νεκρούς[123].
Δείτε ακόμη
ΕπεξεργασίαΠηγές
Επεξεργασία- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
- ΕΚΠΑ-Τμήμα Χημείας: Η χημική ένωση του μήνα: Μεθάνιο, Βαλαβανίδης-Ευσταθίου, Ιούλιος 2008 Αρχειοθετήθηκε 2008-12-10 στο Wayback Machine.
- Μερικές από τις ενέργειες αντιδράσεων υπολογίστηκαν με χρήση κατάλληλου λογισμικού. Θα διασταυρωθούν και βιβλιογραφικά το συντομότερο για μεγαλύτερη ακρίβεια.
Παρατηρήσεις, υποσημειώσεις και αναφορές
Επεξεργασία- ↑ Η χαρακτηριστική οσμή του φυσικού αερίου δεν προέρχεται από το μεθάνιο, αλλά από πρόσθετες οσμηρές ουσίες που συχνά προστίθενται τεχνητά στο φυσικό αέριο για να ανιχνεύεται πιο εύκολα σε ανεπιθύμητες διαρροές.
- ↑ Σημείωση: Τυπικά, η απλούστερη, έστω και ασταθής, οργανική ένωση είναι το μεθυλένιο, εφόσον το μόριό του περιέχει δύο (2) άτομα υδρογόνου αντί των τεσσάρων (4) του μεθανίου.
- ↑ Σημείωση: Η χαρακτηριστική οσμή του φυσικού αερίου οφείλεται σε οσμοθέτες και όχι στο μεθάνιο. Το χημικά καθαρό μεθάνιο είναι άοσμο.
- ↑ Διαχωρίζεται όμως το υδρογόνο, που είναι επίσης συστατικό του φυσικού αερίου, αλλά έχει κρίσιμη θερμοκρασία -240°C.
- ↑ Khalil, M. A. K. (1999). "Non-Co2 Greenhouse Gases in the Atmosphere". Annual Review of Energy and the Environment 24: 645. doi:10.1146/annurev.energy.24.1.645. edit
- ↑ IPCC Fourth Assessment Report.
- ↑ NON-CO2 GREENHOUSE GASES IN THE ATMOSPHERE, Annual Review of Energy and the Environment, Vol. 24: 645-661 (Volume publication date November 1999, DOI: 10.1146/annurev.energy.24.1.645.
- ↑ «Carbon Dioxide, Methane Rise Sharply in 2007». Αρχειοθετήθηκε από το πρωτότυπο στις 11 Αυγούστου 2011. Ανακτήθηκε στις 15 Αυγούστου 2011.
- ↑ «Methane seen as growing climate risk». Αρχειοθετήθηκε από το πρωτότυπο στις 7 Μαρτίου 2010. Ανακτήθηκε στις 7 Μαρτίου 2010.
- ↑ «Ozon – wpływ na życie człowieka, Ozonowanie/Ewa Sroka, Group: Freony i inne związki, Reakcje rozkładu ozonu». Αρχειοθετήθηκε από το πρωτότυπο στις 1 Ιανουαρίου 2011. Ανακτήθηκε στις 15 Αυγούστου 2011.
- ↑ Twenty Questions And Answers About The Ozone Layer, UNEP/D.W. Fahey 2002 Αρχειοθετήθηκε 2011-06-15 στο Wayback Machine., pp. 12, 34, 38
- ↑ Etiope, Giuseppe; Lollar, Barbara Sherwood (2013). «Abiotic Methane on Earth» (στα αγγλικά). Reviews of Geophysics 51 (2): 276–299. doi:. ISSN 1944-9208. Bibcode: 2013RvGeo..51..276E.
- ↑ Volta, Alessandro (1777) Lettere del Signor Don Alessandro Volta … Sull' Aria Inflammabile Nativa delle Paludi [Letters of Signor Don Alessandro Volta … on the flammable native air of the marshes], Milan, Italy: Giuseppe Marelli.
- ↑ "Methane". BookRags. Retrieved January 26, 2012.
- ↑ 15,0 15,1 15,2 15,3 15,4 «ΕΚΠΑ-Τμήμα Χημείας: Η χημική ένωση του μήνα: Μεθάνιο, Βαλαβανίδης-Ευσταθίου, Ιούλιος 2008». Αρχειοθετήθηκε από το πρωτότυπο στις 10 Δεκεμβρίου 2008. Ανακτήθηκε στις 28 Ιουνίου 2009.
- ↑ Τα δεδομένα προέρχονται εν μέρει από το «Table of periodic properties of the Ellements», Sagrent-Welch Scientidic Company και Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, Σελ. 34.
- ↑ David A. Hensher, Kenneth J. Button (2003). Handbook of transport and the environment. Emerald Group Publishing. p. 168. ISBN 0-08-044103-3.
- ↑ NIST Chemistry Webbook. Webbook.nist.gov. Retrieved on 2012-05-24.
- ↑ Ayhan Demirbas (2010). Methane Gas Hydrate. Springer. p. 102. ISBN 1-84882-871-3.
- ↑ R. Bini & G. Pratesi (1997): High-pressure infrared study of solid methane: Phase diagram up to 30 GPa. Physical Review B, 55 (22), 14800-14809.
- ↑ Kristallgitter
- ↑ "AIRS and Composition Science". Retrieved March 19, 2012.
- ↑ Donahue, T.M.; Hodges, R.R. (1993). «Venus methane and water». Geophysical Research Letters 20 (7): 591–594. doi:. Bibcode: 1993GeoRL..20..591D.
- ↑ Stern, S.A. (1999). «The Lunar atmosphere: History, status, current problems, and context». Rev. Geophys. 37 (4): 453–491. doi:. Bibcode: 1999RvGeo..37..453S.
- ↑ ESA Press release. «Mars Express confirms methane in the Martian atmosphere». ESA. Αρχειοθετήθηκε από το πρωτότυπο στις 24 Φεβρουαρίου 2006. Ανακτήθηκε στις 17 Μαρτίου 2006.
- ↑ Michael Schirber (15 Ιανουαρίου 2009). «Methane-spewing Martians?». NASA’s Astrobiology Magazine. Αρχειοθετήθηκε από το πρωτότυπο στις 2 Ιουνίου 2013. Ανακτήθηκε στις 31 Ιανουαρίου 2013.
- ↑ Nancy Atkinson (11 Σεπτεμβρίου 2012). «Methane on Mars may be result of electrification of dust devils». Universe Today.
- ↑ «Methane on Mars is not an indication of life: UV radiation releases methane from organic materials from meteorites». Max-Planck-Gesellschaft. 31 Μαΐου 2012.
- ↑ Mars Vents Methane in What Could Be Sign of Life, Washington Post, January 16, 2009
- ↑ 30,0 30,1 «Atmospheric Modeling of Martian Methane Plumes: The Debate Continues». NASA Solar System Exploration. 3 Απριλίου 2012. Αρχειοθετήθηκε από το πρωτότυπο στις 8 Ιανουαρίου 2013. Ανακτήθηκε στις 31 Ιανουαρίου 2013.
- ↑ Δηλαδή όλους τους δυνατούς συνδυασμούς ισοτόπων του άνθρακα και του υδρογόνου, που περιέχει.
- ↑ Tenenbaum, David (9 Ιουνίου 2008). «Making Sense of Mars Methane». Astrobiology Magazine. Αρχειοθετήθηκε από το πρωτότυπο στις 23 Σεπτεμβρίου 2008. Ανακτήθηκε στις 8 Οκτωβρίου 2008.
- ↑ Steigerwald, Bill (January 15, 2009). «Martian Methane Reveals the Red Planet is not a Dead Planet». NASA's Goddard Space Flight Center (NASA). Αρχειοθετήθηκε από το πρωτότυπο στις 2009-01-17. https://web.archive.org/web/20090117141425/http://www.nasa.gov/mission_pages/mars/news/marsmethane.html. Ανακτήθηκε στις January 24, 2009.
- ↑ Leonard David (23 Οκτωβρίου 2012). «Mars methane mystery: Curiosity rover may find new clues». Space.com.
- ↑ «Mars Curiosity Rover News Telecon -November 2, 2012».
- ↑ Kerr, Richard A. (2 Νοεμβρίου 2012). «Curiosity Finds Methane on Mars, or Not». Science (journal). Αρχειοθετήθηκε από το πρωτότυπο στις 9 Δεκεμβρίου 2012. Ανακτήθηκε στις 3 Νοεμβρίου 2012.
- ↑ Wall, Mike (2 Νοεμβρίου 2012). «Curiosity Rover Finds No Methane on Mars —Yet». Space.com. Ανακτήθηκε στις 3 Νοεμβρίου 2012.
- ↑ Chang, Kenneth (November 2, 2012). «Hope of Methane on Mars Fades». New York Times. http://www.nytimes.com/2012/11/03/science/space/hopes-for-methane-on-mars-deflated.html. Ανακτήθηκε στις November 3, 2012.
- ↑ Rincon, Paul (July 9, 2009). «Agencies outline Mars initiative». BBC News. http://news.bbc.co.uk/2/hi/science/nature/8130393.stm. Ανακτήθηκε στις July 26, 2009.
- ↑ «NASA orbiter to hunt for source of Martian methane in 2016». Thaindian News. March 6, 2009. Αρχειοθετήθηκε από το πρωτότυπο στις 2018-10-05. https://web.archive.org/web/20181005142406/http://www.thaindian.com/newsportal/health/nasa-orbiter-to-hunt-for-source-of-martian-methane-in-2016_100163335.html. Ανακτήθηκε στις July 26, 2009.
- ↑ Oze, C.; Sharma, M. (2005). "Have olivine, will gas: Serpentinization and the abiogenic production of methane on Mars". Geophysical Research Letters 32 (10): L10203. Bibcode 2005GeoRL..3210203O. doi:10.1029/2005GL022691.
- ↑ H. B. Niemann, et al. (2005). «The abundances of constituents of Titan’s atmosphere from the GCMS instrument on the Huygens probe». Nature 438: 779–784. doi:.
- ↑ Niemann, HB; Atreya, SK; Bauer, SJ; Carignan, GR; Demick, JE; Frost, RL; Gautier, D; Haberman, JA και άλλοι. (2005). «The abundances of constituents of Titan's atmosphere from the GCMS instrument on the Huygens probe». Nature 438 (7069): 779–784. doi:. PMID 16319830. Bibcode: 2005Natur.438..779N.
- ↑ Chris Mckay (2010). «Have We Discovered Evidence For Life On Titan». SpaceDaily. Ανακτήθηκε στις 10 Ιουνίου 2010. Space.com. March 23, 2010.
- ↑ Duncan Geere (14 Ιουνίου 2012). «Methane lakes raise hopes of life on Titan». Wired UK.
- ↑ Lisa Grossman (17 Μαρτίου 2011). «Seasonal methane rain discovered on Titan». Wired Science.
- ↑ Waite, J. H.; et al.; (2006); Cassini Ion and Neutral Mass Spectrometer: Enceladus Plume Composition and Structure, Science, Vol. 311, No. 5766, pp. 1419–1422
- ↑ Broadfoot, A. L.; Atreya, S. K.; Bertaux, J. L. και άλλοι. (1989-12-15). «Ultraviolet Spectrometer Observations of Neptune and Triton». Science 246: 1459–1466. ISSN 0036-8075. http://adsabs.harvard.edu/abs/1989Sci...246.1459B. Ανακτήθηκε στις 2008-01-15.
- ↑ Ron Miller· William K. Hartmann (Μάιος 2005). The Grand Tour: A Traveler's Guide to the Solar System (3η έκδοση). Thailand: Workman Publishing. σελίδες 172–173. ISBN 0-7611-3547-2.
- ↑ Tobias C. Owen, Ted L. Roush et al. (6 August 1993). «Surface Ices and the Atmospheric Composition of Pluto». Science 261 (5122): 745–748. doi:. http://www.sciencemag.org/cgi/content/abstract/261/5122/745. Ανακτήθηκε στις 2007-03-29.
- ↑ «Pluto». SolStation. 2006. Ανακτήθηκε στις 28 Μαρτίου 2007.
- ↑ B. Sicardy et al (2006). «Charon’s size and an upper limit on its atmosphere from a stellar occultation». Nature 439: 52. doi:. http://www.nature.com/nature/journal/v439/n7072/abs/nature04351.html.
- ↑ Mumma, M.J.; Disanti, M.A., dello Russo, N., Fomenkova, M., Magee-Sauer, K., Kaminski, C.D., and D.X. Xie (1996). «Detection of Abundant Ethane and Methane, Along with Carbon Monoxide and Water, in Comet C/1996 B2 Hyakutake: Evidence for Interstellar Origin». Science 272 (5266): 1310. doi:. PMID 8650540. Bibcode: 1996Sci...272.1310M.
- ↑ Mumma, M.J.; Disanti, M.A., dello Russo, N., Fomenkova, M., Magee-Sauer, K., Kaminski, C.D., and D.X. Xie (1996). «Detection of Abundant Ethane and Methane, Along with Carbon Monoxide and Water, in Comet C/1996 B2 Hyakutake: Evidence for Interstellar Origin». Science 272 (5266): 1310–4. doi:. PMID 8650540. Bibcode: 1996Sci...272.1310M.
- ↑ Stephen Battersby (11 Φεβρουαρίου 2008). «Organic molecules found on alien world for first time». Αρχειοθετήθηκε από το πρωτότυπο στις 13 Φεβρουαρίου 2008. Ανακτήθηκε στις 12 Φεβρουαρίου 2008.
- ↑ J. H. Lacy, J. S. Carr, N. J. Evans, II, F. Baas, J. M. Achtermann, J. F. Arens (1991). «Discovery of interstellar methane — Observations of gaseous and solid CH4 absorption toward young stars in molecular clouds». Astrophysical Journal 376: 556–560. doi:. http://adsabs.harvard.edu/abs/1991ApJ...376..556L.
- ↑ Hamilton JT, McRoberts WC, Keppler F, Kalin RM, Harper DB (July 2003). «Chloride methylation by plant pectin: an efficient environmentally significant process». Science 301 (5630): 206–9. doi:. PMID 12855805. Bibcode: 2003Sci...301..206H.
- ↑ "Methane Emissions? Don't Blame Plants" Αρχειοθετήθηκε 2009-03-12 στο Wayback Machine., ScienceNOW, 14 January 2009
- ↑ «Plants do emit methane after all». New Scientist. 2 Δεκεμβρίου 2007. Αρχειοθετήθηκε από το πρωτότυπο στις 8 Οκτωβρίου 2008. Ανακτήθηκε στις 31 Δεκεμβρίου 2011.
- ↑ Miller, G. Tyler. Sustaining the Earth: An Integrated Approach. U.S.A.: Thomson Advantage Books, 2007. 160.
- ↑ «Livestock's Long Shadow–Environmental Issues and Options». Ανακτήθηκε στις 27 Οκτωβρίου 2009.
- ↑ California Cows Fail Latest Emissions Test
- ↑ New Zealand Tries to Cap Gaseous Sheep Burps
- ↑ «Research on use of bacteria from the stomach lining of kangaroos (who don't emit methane) to reduce methane in cattle». Αρχειοθετήθηκε από το πρωτότυπο στις 28 Αυγούστου 2009. Ανακτήθηκε στις 28 Οκτωβρίου 2009.
- ↑ «"Σχιστολιθικό Αέριο (shale gas): πολλά υπέρ και πολλά κατά..": Πύλη για τον Ελληνικό Ορυκτό Πλούτο, www.oryktosploutos.net».
- ↑ «"Υδρίτες Μεθανίου: το νέο shale gas": Πύλη για τον Ελληνικό Ορυκτό Πλούτο, www.oryktosploutos.net».
- ↑ «Proceedings of the 7th International Conference on Gas Hydrates (ICGH 2011)». Αρχειοθετήθηκε από το πρωτότυπο στις 22 Ιουνίου 2014. Ανακτήθηκε στις 5 Δεκεμβρίου 2014.
- ↑ 68,0 68,1 «Office of Oil and Natural Gas». Energy.gov (στα Αγγλικά). Ανακτήθηκε στις 12 Νοεμβρίου 2020.
- ↑ «International - U.S. Energy Information Administration (EIA)». www.eia.gov. Ανακτήθηκε στις 12 Νοεμβρίου 2020.
- ↑ Bioenergy and renewable power methane in integrated 100% renewable energy system, [1] Αρχειοθετήθηκε 2011-12-02 στο Wayback Machine.,
- ↑ scénario négaWatt 2011 (France), [2] Αρχειοθετήθηκε 2012-01-05 στο Wayback Machine.,
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.2.4β.
- ↑ Το μέταλλο πρέπει να είναι ηλεκτροθετικότερο του υδρογόνου.
- ↑ Ο συνδυασμός θεωρούνταν παλαιότερα ότι παρήγαγε ατομικό υδρογόνο και σ' αυτό απέδειδαν την αυξημένη δραστικότητά του. Ωστόσο, αποδείχθηκε ότι απλά σχηματίζει πολλές και πολύ μικρές φυσαλίδες του αερίου, που διευκολύνουν την προσρόφησή τους στην επιφάνεια του μετάλλου, για να γίνει η αναγωγή του υδρογόνου από το μέταλλο.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.7.1β., με R = CH3
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, §6.7.1α., με R = CH3
- ↑ Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991, σελ.14, §1.1
- ↑ Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991, σελ. 291-293, §19.1.
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, Σελ. 42, §4.3.
- ↑ Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991, σελ.80-82, §5.1-5.2
- ↑ όπου |Εt2Ο| : άνυδρος διαιθυλαιθέρας
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.7.4α., με R = CH3
- ↑ αντιδρασήριο Grignard
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.7.6β.
- ↑ 85,0 85,1 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.269, §11.6B7.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.2.3α., με R = CH3
- ↑ Baik, Mu-Hyun; Newcomb, Martin; Friesner, Richard A.; Lippard, Stephen J. (2003). "Mechanistic Studies on the Hydroxylation of Methane by Methane Monooxygenase". Chemical Reviews 103 (6): 2385–419. doi:10.1021/cr950244f. PMID 12797835.
- ↑ Snyder, Benjamin E. R.; Bols, Max L.; Schoonheydt, Robert A.; Sels, Bert F.; Solomon, Edward I. (2017-12-19). «Iron and Copper Active Sites in Zeolites and Their Correlation to Metalloenzymes» (στα αγγλικά). Chemical Reviews 118 (5): 2718–2768. doi:. ISSN 0009-2665. PMID 29256242.
- ↑ Reimann, Joachim· Jetten, Mike S.M.· Keltjens, Jan T. (2015). «Chapter 7 Metal Enzymes in "Impossible" Microorganisms Catalyzing the Anaerobic Oxidation of Ammonium and Methane». Στο: Peter M.H. Kroneck and Martha E. Sosa Torres. Sustaining Life on Planet Earth: Metalloenzymes Mastering Dioxygen and Other Chewy Gases. Metal Ions in Life Sciences. 15. Springer. σελίδες 257–313. doi:10.1007/978-3-319-12415-5_7. ISBN 978-3-319-12414-8. PMID 25707470.
- ↑ Equilibrium acidities in dimethyl sulfoxide solution Frederick G. Bordwell Acc. Chem. Res.; 1988; 21(12) pp 456 – 463; doi:10.1021/ar00156a004
- ↑ Wesley H. Bernskoetter, Cynthia K. Schauer, Karen I. Goldberg and Maurice Brookhart "Characterization of a Rhodium(I) σ-Methane Complex in Solution" Science 2009, Vol. 326, pp. 553–556. doi:10.1126/science.1177485
- ↑ Golam Rasul, G.K. Surya Prakash, George A. Olah (2011), "Comparative study of the hypercoordinate carbonium ions and their boron analogs: A challenge for spectroscopists". Chemical Physics Letters, volume 517, issues 1–3, pages 1–8 doi:10.1016/j.cplett.2011.10.020
- ↑ Bernskoetter, W. H.; Schauer, C. K.; Goldberg, K. I.; Brookhart, M. (2009). "Characterization of a Rhodium(I) σ-Methane Complex in Solution". Science 326 (5952): 553–6. Bibcode:2009Sci...326..553B. doi:10.1126/science.1177485. PMID 19900892.
- ↑ «Energy Content of some Combustibles (in MJ/kg)». Αρχειοθετήθηκε από το πρωτότυπο στις 9 Ιανουαρίου 2014. Ανακτήθηκε στις 31 Ιανουαρίου 2014.
- ↑ ΔHC-H = +415 kJ/mol
- ↑ ΔHO-O=+146 kJ/mol
- ↑ Drysdale, Dougal (2008). "Physics and Chemistry of Fire". In Cote, Arthur E. Fire Protection Handbook 1 (20th ed.). Quincy, MA: National Fire Protection Association. pp. 2–18. ISBN 978-0-87765-758-3.
- ↑ http://books.google.com/books?id=WFefWAq1Sh0C&pg=PA102%7Cpage=102%7Ctitle=Methane Gas Hydrate|author=Ayhan Demirbas|publisher=Springer|year= 2010|isbn=1-84882-871-3
- ↑ Günther Reuss, Walter Disteldorf, Armin Otto Gamer, Albrecht Hilt “Formaldehyde” in Ullmann's Encyclopedia of Industrial Chemistry, 2002, Wiley-VCH, Weinheim.
- ↑ Zhang, Q. (2003). «Recent Progress in Direct Partial Oxidation of Methane to Methanol». J. Natural Gas Chem. 12: 81–89.
- ↑ Olah, G., Molnar, A. “Hydrocarbon Chemistry” John Wiley & Sons, New York, 2003. ISBN 9780471417828.
- ↑ Lunsford, J.H. (1995). «The catalytic coupling of methane». Angew. Chem., Int. Ed. Engl. 34: 970–980. doi:.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 155, §6.7.2, R = CH3.
- ↑ καθοριστικό ταχύτητας
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 244, §10.3.2
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 155, §6.7.3.
- ↑ Clayton B. Cornell (April 29, 2008). «Natural Gas Cars: CNG Fuel Almost Free in Some Parts of the Country». Αρχειοθετήθηκε από το πρωτότυπο στις 2019-01-20. https://web.archive.org/web/20190120033852/http://gas2.org/2008/04/29/natural-gas-cars-cng-fuel-almost-free-in-some-parts-of-the-country/. Ανακτήθηκε στις 2012-01-01. «Compressed natural gas is touted as the 'cleanest burning' alternative fuel available, since the simplicity of the methane molecule reduces tailpipe emissions of different pollutants by 35 to 97%. Not quite as dramatic is the reduction in net greenhouse-gas emissions, which is about the same as corn-grain ethanol at about a 20% reduction over gasoline»
- ↑ Düren, Tina; Sarkisov, Lev; Yaghi, Omar M.; Snurr, Randall Q. (2004). «Design of New Materials for Methane Storage». Langmuir 20 (7): 2683–9. doi:. PMID 15835137.
- ↑ A Global First: Coal Mine Turns Greenhouse Gas into Green Energy
- ↑ Huzel, Dieter K. (1992). Modern engineering for design of liquid-propellant rocket engines. Washington, DC: American Institute of Aeronautics and Astronautics.
- ↑ "Lox/LCH4". Encyclopedia Astronautica. Retrieved 2012-12-04.
- ↑ "XCOR Aerospace Completes Successful Development of Methane Rocket Engine" (Press release). XCOR Aerospace. 20050830. Retrieved 20121203.
- ↑ "XCOR Aerospace Begins Test Firing of Methane Rocket Engine" (Press release). XCOR Aerospace. 20070116. Retrieved 20121203.
- ↑ Todd, David (2012-11-20). "Musk goes for methane-burning reusable rockets as step to colonise Mars". FlightGlobal Hyperbola. Retrieved 2012-11-22. ""We are going to do methane." Musk announced as he described his future plans for reusable launch vehicles including those designed to take astronauts to Mars within 15 years, "The energy cost of methane is the lowest and it has a slight Isp (Specific Impulse) advantage over Kerosene" said Musk adding, "And it does not have the pain in the ass factor that hydrogen has"."
- ↑ Todd, David (2012-11-20). "Musk goes for methane-burning reusable rockets as step to colonise Mars". FlightGlobal Hyperbola. Retrieved 2012-11-22. ""SpaceX's initial plan will be to build a lox/methane rocket for a future upper stage codenamed Raptor. ... The new Raptor upper stage engine is likely to be only the first engine in a series of lox/methane engines. ... "."
- ↑ Morring, Jr., Frank, ed. (7/13/2009). "Lunar Engines". Aviation Week & Space Technology 171 (2): 16.
- ↑ "Methane Blast". NASA. 5/4/2007. Retrieved 7/7/2012.
- ↑ Green, V. (September 2007). "Hit the Gas: NASA's methane rocket could make long distance space travel possible, on the cheap". Popular Science 271 (3): 16–17. ISSN 0161-7370.
- ↑ Σημείωση: Δεν εννοείται και το αστάτιο, το οποίο έχει ελάχιστα μελετηθεί.
- ↑ M. Rossberg et al. “Chlorinated Hydrocarbons” in Ullmann’s Encyclopedia of Industrial Chemistry 2006, Wiley-VCH, Weinheim. doi:10.1002/14356007.a06_233.pub2
- ↑ «Health Effects of Methane». Canadian Centre for Occupational Health & Safety. 11 Δεκεμβρίου 2006. Αρχειοθετήθηκε από το πρωτότυπο στις 27 Νοεμβρίου 2012. Ανακτήθηκε στις 4 Μαρτίου 2013.
- ↑ Philippe Dozolme. «Common Mining Accidents». About.com. Αρχειοθετήθηκε από το πρωτότυπο στις 11 Νοεμβρίου 2012. Ανακτήθηκε στις 4 Μαρτίου 2013.
- ↑ Andrew Moseman (6 Απριλίου 2010). «Methane gas explosion blamed for West Virginia coal mining accident». Discover Magazine. Αρχειοθετήθηκε από το πρωτότυπο στις 19 Απριλίου 2012. Ανακτήθηκε στις 4 Μαρτίου 2013.
