Χημικό στοιχείο
Χημικό στοιχείο, συχνά αποκαλούμενο ως στοιχείο, είναι οποιαδήποτε ουσία αποτελείται αποκλειστικά από άτομα με τον ίδιο αριθμό πρωτονίων στους πυρήνες τους (ατομικό αριθμό). Για παράδειγμα, η χημική ουσία που αποτελείται μόνο από άτομα με δύο πρωτόνια στους πυρήνες τους, είναι ένα χημικό στοιχείο, το οποίο μάλιστα ονομάζεται ήλιο. Τα χημικά στοιχεία διακρίνονται σε μέταλλα, μεταλλοειδή και αμέταλλα.
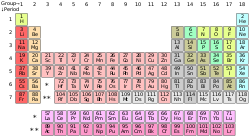






Τα πιο γνωστά παραδείγματα χημικών στοιχείων είναι ο άνθρακας, το υδρογόνο, το οξυγόνο (αμέταλλα), το πυρίτιο, το αρσενικό (μεταλλοειδή), και, το αλουμίνιο, ο σίδηρος, ο χαλκός, ο χρυσός, ο υδράργυρος και ο μόλυβδος (μέταλλα).
Τα ελαφρύτερα χημικά στοιχεία, που περιλαμβάνουν το υδρογόνο, το ήλιο, και σε μικρότερες ποσότητες, το λίθιο, το βηρύλλιο και το βόριο, θεωρείται ότι έχουν παραχθεί με διάφορες κοσμικές διεργασίες κατά τη διάρκεια της Μεγάλης Έκρηξης και τον βομβαρδισμό με κοσμικές ακτίνες. Η παραγωγή των βαρύτερων χημικών στοιχείων, από τον άνθρακα ως τα πολύ βαρύτερα χημικά στοιχεία, παράχθηκαν με αστρική πυρηνοσύνθεση, και έγιναν διαθέσιμα για τα μεταγενέστερα ηλιακά συστήματα και τον σχηματισμό των πλανητών με πλανητικά νεφελώματα και υπερκαινοφανείς αστέρες, που εκτοξεύουν τέτοια χημικά στοιχεία στο διάστημα[1]. Η υψηλή αφθονία του οξυγόνου, του πυριτίου και του σιδήρου στη Γη αντανακλά τη συνηθισμένη παραγωγή τους σε τέτοια άστρα. Ενώ τα περισσότερα χημικά στοιχεία είναι γενικά «σταθερά», μια μικρή ποσότητα φυσικής μετατροπής του ενός χημικού στοιχείου σε ένα άλλο επίσης συμβαίνει με τη διάσπαση των ραδιενεργών χημικών στοιχείων, καθώς επίσης και με άλλες πυρηνικές διεργασίες που συμβαίνουν στη φύση.
Η ιστορία της ανακάλυψης και της χρήσης των χημικών στοιχείων άρχισε μαζί με τις πρωτόγονες ανθρώπινες κοινωνίες που έβρισκαν κάποια φυσικά χημικά στοιχεία που υπάρχουν στη φύση, όπως ο χαλκός, ο χρυσός και ο συντηγμένος σίδηρος και λἰγα άλλα μέταλλα από τα ορυκτά τους. Αρχικά οι αλχημιστές και οι χημικοί, μεταγενέστερα, ταυτοποίησαν πολλά περισσότερα, με σχεδόν όλα τα φυσικά υπάρχοντα χημικά στοιχεία να είναι ήδη γνωστά μέχρι 1900. Οι ιδιότητες των χημικών στοιχείων συχνά συνοψίστηκαν με τη σταδιακή ανάπτυξη του περιοδικού πίνακα των χημικών στοιχείων, που οργανώνει τα χημικά στοιχεία κατά αύξοντα ατομικό αριθμό σε περιόδους και ομάδες που μοιράζονται ορισμένες «περιοδικές» φυσικές και χημικές ιδιότητες. Με εξαίρεση κάποια ασταθή και βραχύβια ραδιενεργά χημικά στοιχεία, όλα τα υπόλοιπα χημικά στοιχεία είναι (πλέον) διαθέσιμα βιομηχανικά, τα περισσότερα σε υψηλούς βαθμούς καθαρότητας.
Το υδρογόνο και το ήλιο είναι ασυζητητί τα πιο άφθονα χημικά στοιχεία στο σύμπαν. Ωστόσο, ο σίδηρος είναι το πιο άφθονο χημικό στοιχείο (κατά μάζα) στη Γη, ενώ το οξυγόνο είναι το πιο άφθονο χημικό στοιχείο στον γήινο φλοιό[2]. Παρόλο που όλες οι γνωστές χημικές ουσίες αποτελούνται από αυτά τα χημικά στοιχεία, η ίδια η ύλη υποθέτεται ότι αποτελεί μόλις το 15% της συνολικής ποσότητας μάζας του σύμπαντος. Το υπόλοιπο πιστεύεται ότι αποτελείται από σκοτεινή ύλη, ένα εύρος ουσιών με σύνθεση σε μεγάλο βαθμό άγνωστη και μη μη αποτελούμενη από χημικά στοιχεία (τουλάχιστον όπως τα ξέρουμε και τα ορίζουμε ως τώρα), εφόσον δεν περιέχουν πρωτόνια, νετρόνια και ηλεκτρόνια[3]. Η σκοτεινή ύλη μπορεί επίσης να περιλαμβάνει κανονική βαρυονική μάζα και νετρίνα.
Όταν δύο (2) ή περισσότερα διακριτά χημικά στοιχεία ενώνονται χημικά, με τα άτομά τους να συγκρατούνται μαζί με χημικούς δεσμούς, το αποτέλεσμα είναι μια χημική ένωση. Τα 2/3 των χημικών στοιχείων που βρίσκονται με φυσικό τρόπο στη Γη, μπορούν να βρεθούν στη φύση μὀνο με τη μορφή χημικών ενώσεών τους, αλλά και στο υπόλοιπο 1/3, συνήθως είναι πιο συνηθισμένο να βρεθούν και πάλι με τη μορφή χημικών ενώσεών τους. Οι χημικές ενώσεις αποτελούνται από χημικά στοιχεία που συνδυάζονται μόνο σε αναλογίες φυσικών αριθμών, όπως στο νερό, στο μαγειρικό αλάτι και σε ορυκτά, όπως ο χαλαζίας και ο ασβεστίτης. Αυτό επιτρέπει την εξαγωγή χημικών τύπων που αντιπροσωπεύουν αυτές τις χημικές ενώσεις. Ωστόσο, οι χημικοί δεσμοί ανάμεσα σε πολλούς τύπους χημικών στοιχείων έχουν ως αποτέλεσμα σε ορισμένα κρυσταλλικά στερεά και σε ορισμένα μεταλλικά κράματα, οι αναλογίες ατόμων τους να μη δίνουν συγκεκριμένους χημικούς τύπους. Σχετικά καθαρά δείγματα ελεύθερων χημικών στοιχείων είναι ασυνήθιστα στη φύση. Σχετικά καθαρά δείγματα απομονωμένων στοιχείων είναι ασυνήθιστα στη φύση. Ενώ όλα τα 94 φυσικά υπάρχοντα χημικά στοιχεία έχουν ταυτοποιηθεί σε δείγματα ορυκτών προερχόμενα από τον γήινο φλοιό, μόνο μια μικρή μειοψηφία των χημικών στοιχείων είναι αναγνωρίσιμα, ως σχετικά καθαρά χημικά στοιχεία. Ανάμεσα στα πιο συνηθισμένα από αυτά τα «εγγενή στοιχεία» είναι ο χαλκός, ο άργυρος, ο χρυσός, ο άνθρακας (σε τρεις αλλομορφές: γαιάνθρακας, γραφίτης και διαμάντι), το θείο και ο υδράργυρος. Όλα αυτά, εκτός από λίγα από τα πιο αδρανή χημικά στοιχεία, όπως τα ευγενή αέρια και μερικά από τα ευγενή μέταλλα, συνήθως βρίσκονται στη Γη στη μορφή χημικών ενώσεών τους. Ενώ περίπου 32 από τα χημικά στοιχεία υπάρχουν στη Γη σε μορφή (ελεύθερου) χημικού στοιχείου, τα περισσότερα από αυτά βρίσκονται σε μίγματα. Για παράδειγμα, ο ατμοσφαιρικός αέρας (της Γης) αποτελείται κυρίως από ένα μείγμα αζώτου, οξυγόνου και αργού, και τα εγγενή στερεά στοιχεία βρίσκονται σε κράματα, όπως ο σίδηρος με το νικέλιο.
Επί του παρόντος 118 χημικά στοιχεία έχουν ταυτοποιηθεί[4]. Από αυτά τα 118 γνωστά χημικά στοιχεία, μόνο τα πρώτα 94 είναι γνωστό ότι έχουν βρεθεί με φυσικό τρόπο στη Γη. Επίσης, μόνο τα 80 από αυτά είναι σταθερά, ενώ τα άλλα είναι ραδιενεργά, διασπώμενα σε ελαφρύτερα χημικά στοιχεία, με διάφορες ημιζωές, που κυμαίνονται από κλάσματα του δευτερολέπτου ως και δισεκατομμύρια έτη. Τα 24 βαρύτερα χημικά στοιχεία που δεν έχουν βρεθεί με φυσικό τρόπο στη Γη, ταυτοποιήθηκαν αφού παράχθηκαν τεχνητά ως συνθετικά προϊόντα με ανθρωπογενείς πυρηνικές αντιδράσεις.
Περιγραφή Επεξεργασία
Τα ελαφρύτερα από τα χημικά στοιχεία είναι το υδρογόνο και το ήλιο, που δημιουργήθηκαν από τη Μεγάλη Έκρηξη, με πυρηνοσύνθεση κατά τα πρώτα 20 λεπτά του σύμπαντος[5] σε μια αναλογία 3:1 κατά μάζα (ή 12:1 σε αναλογία αριθμού ατόμων)[6][7]. Σχεδόν όλα τα άλλα χημικά στοιχεία που βρίσκονται στη φύση δημιουργήθηκαν με διάφορες φυσικές μεθόδους πυρηνοσύνθεσης[8]. Στη Γη, μικρές ποσότητες νέων ατόμων παράγονται στη φύση με πυρηνογενικές αντιδράσεις, ή με κοσμογενικές διεργασίες, όπως ο βομβαρδισμός με κοσμικές ακτίνες. Νέα άτομα στη φύση της Γης επίσης παράγονται με ραδιογενή παράγωγα ισότοπα κατά τη διάρκεια των συνεχιζόμενων ραδιενεργών διασπάσεων με διεργασίες όπως η διάσπαση άλφα, η διάσπαση βήτα, η αυθόρμητη σχάση, η διάσπαση συμπλέγματος ή και άλλες σπανιότερες μορφές ραδιενεργών διασπάσεων.
Ατομικός αριθμός Επεξεργασία
Ο ατομικός αριθμός ενός χημικού στοιχείου είναι ίσος με τον αριθμό των πρωτονίων κάθε ατόμου του χημικού στοιχείου, και καθορίζει το χημικό στοιχείο[9]. Για παράδειγμα, όλα τα άτομα άνθρακα περιέχουν 6 πρωτόνια στον ατομικό πυρήνα τους, οπότε ο ατομικός αριθμός του άνθρακα είναι 6[10]. Κάποια άτομα άνθρακα μπορεί να έχουν διαφορετικούς αριθμούς νετρονίων στον ατομικό πυρήνα τους. Τα διακριτά είδη χημικών στοιχείων που έχουν άτομα με διαφορετικό αριθμό νετρονίων είναι γνωστά ως ισότοπα του χημικού στοιχείου[11].
Ο αριθμός των πρωτονίων στον ατομικό πυρήνα καθορίζει επίσης και το ηλεκτρικό φορτίο του, που με τη σειρά του καθορίζει και τον αριθμό των ηλεκτρονίων του ατόμου, εφόσον δεν βρίσκεται στην κατάσταση ιόντος. Τα ηλεκτρόνια τοποθετούνται σε ατομικά τροχιακά, που καθορίζουν τις διάφορες χημικές ιδιότητες του χημικού στοιχείου. Ο αριθμός των νετρονίων του πυρήνα συνήθως έχει πολύ λίγη επίδραση στις χημικές ιδιότητες του χημικού στοιχείου, εκτός από την περίπτωση του δευτερίου, που είναι ισότοπο του υδρογόνου. Έτσι, όλα τα ισότοπα του άνθρακα έχουν σχεδόν ταυτόσημες χημικές ιδιότητες, επειδή όλα έχουν 6 πρωτόνια και 6 ηλεκτρόνια, ακόμη και αν ο ατομικός πυρήνας τους περιέχει 6 - 8 νετρόνια[12]. Να για ποιον λόγο ο ατομικός αριθμός, και όχι το ατομικό βάρος, θεωρείται ότι ταυτοποιεί τα χαρακτηριστικά ενός χημικού στοιχείου.
Το διεθνές σύμβολο για τον ατομικό αριθμό είναι το Z.
Μαζικός αριθμός, ισοτοπική μάζα και ατομικό βάρος Επεξεργασία
Ο μαζικός αριθμός ενός νουκλιδίου, που συμβολίζεται διεθνώς με το A, είναι ο (συνολικός) αριθμός των νουκλεονίων (δηλαδή των πρωτονίων και των νετρονίων) στον ατομικό του πυρήνα. Τα διαφορετικά ισότοπα ενός δεδομένου χημικού στοιχείου έχουν διαφορετικούς μαζικούς αριθμούς, που συμβατικά γράφονται ως εκθέτες πάνω αριστερά από το χημικό σύμβολο του στοιχείου, για παράδειγμα 238U. Ο μαζικός αριθμός είναι πάντα ένας απλός φυσικός αριθμός. Ένα παράδειγμα αναφοράς σε ένα μαζικό αριθμό είναι το «μαγνήσιο-24», που είναι ένα ισότοπο με άτομο που περιέχει 24 νουκλεόνια (δηλαδή 12 πρωτόνια + 12 νετρόνια).
Ενώ ο μαζικός αριθμός απλά μετρά το συνολικό αριθμό των νετρονίων και των πρωτονίων και έτσι είναι ένας φυσικός αριθμός, η ισοτοπική μάζα ενός μοναδικού ατόμου είναι ένας πραγματικός αριθμός για τη μάζα ενός συγκεκριμένου ισοτόπου του χημικού στοιχείου, χρησιμοποιώντας ως μονάδα μέτρησης την ατομική μονάδα μάζας (atomic mass unit - amu). Γενικά, όταν εκφράζεται σε ατομικές μονάδα μάζας, η ισοτοπική μάζα διαφέρει αριθμητικά ελάχιστα από τον μαζικό αριθμό ενός δεδομένου νουκλιδίου ή ισοτόπου, εφόσον η μάζα ενός πρωτονίου ή ενός νετρονίου δεν είναι ακριβώς 1 amu και αφού τα ηλεκτρόνια συνεισφέρουν κι αυτά (έστω) ένα ελάχιστο μερίδιο στην ατομική μάζα. Επιπλέον, με τη δημιουργία ενός ατομικού πυρήνα, χάνεται μέρος του αθροίσματος της μάζας των πρωτονίων και των νετρονίων που το αποτελούν, με τη μορφή της πυρηνικής ενέργειας σύνδεσης (αφού E = mc²). Για παράδειγμα, η ισοτοπική μάζα του χλωρίου-35, εκφρασμένη με πέντε (5) σημαντικά ψηφία, είναι 34,969 amu, ενώ η αντίστοιχη του χλωρίου-37 είναι 36,966 amu. Ωστόσο η ισοτοπική μάζα σε amu των καθαρών ισοτοπικών ατόμων είναι πολύ κοντά στον απλό μαζικό τους αριθμό και για την ακρίβεια η σχετική τους διαφορά τους ποτέ δεν ξεπερνά το 1%. Ως μόνη εξαίρεση στα παραπάνω αποτελεί η ισοτοπική μάζα του ισοτόπου άνθρακα-12 είναι η μόνη που είναι εξορισμού φυσικός αριθμός, γιατί η amu ορίστηκε ως το 1/12 της μάζας ενός ελεύθερου και ουδέτερου ατόμου άνθρακα-12, στη βασική του κατάσταση.
Η «σχετική ατομική μάζα», που για ιστορικούς λόγους και λόγους συνήθειας, αποκαλείται επίσης «ατομικό βάρος» ενός χημικού στοιχείου, είναι ο μέσος όρος των ισοτοπικών μαζών όλων των φυσικών ισοτοτόπων του χημικού στοιχείου, με βάση την ισοτοπική τους αφθονία, και πάλι σύγκριση με την amu. Αυτός ο αριθμός μπορεί να είναι ένας ρητός αριθμός, που δεν είναι και τόσο κοντά σε ένα φυσικό αριθμό, εξαιτίας της διεργασίας υπολογισμού του μέσου όρου. Για παράδειγμα, η σχετική ατομική μάζα του χλωρίου είναι 35,453 amu, που διαφέρει πολύ από κάθε φυσικό αριθμό, γιατί παράγεται από τον μέσο όρο του χλωρίου-35, με ισοτοπική αφθονία 76%, και του χλωρίου-37, με ισοτοπική αφθονία 24%.
Όποτε μια σχετική ατομική μάζα χημικού στοιχείου έχει τιμή που διαφέρει περισσότερο από 1% από ένα φυσικό αριθμό, είναι εξαιτίας του αποτελέσματος που παράγεται από την απόκληση που προκαλεί στον υπολογισμό του μέσου όρου η ύπαρξη σημαντικών ποσοστών περισσότερων του ενός ισοτόπων στη φυσική παρουσία του εξεταζόμενου χημικού στοιχείου.
Ισότοπα Επεξεργασία
Τα ισότοπα είναι είδος ατόμων του ίδιου χημικού στοιχείου, οπότε έχουν τον ίδιο αριθμό πρωτονίων στον ατομικό τους πυρήνα, αλλά έχουν διαφορετικούς αριθμούς νετρονίων. Τα περισσότερα, για την ακρίβεια τα 66 από τα 94 φυσικά υπάρχοντα χημικά στοιχεία, έχουν ένα τουλάχιστον σταθερό ισότοπο. Έτσι, για παράδειγμα, υπάρχουν τρία (3) κύρια ισότοπα για τον άνθρακα. Όλα τα άτομα άνθρακα έχουν 6 πρωτόνια στον πυρήνα τους, αλλά μπορεί να έχουν 6 - 8 νετρόνια. Εφόσον οι μαζικοί αριθμοί αυτών των ισοτόπων είναι 12 - 14, αντίστοιχα, τα τρία κύρια ισότοπα του άνθρακα είναι γνωστά ως άνθρακας-12, άνθρακας-13 και άνθρακας-14, ενώ συχνά παριστάνονται ως 12C, 13C και 14C, αντίστοιχα. Ο άνθρακας που γνωρίζουμε στην καθημερινή ζωή και στη χημεία είναι ένα μίγμα από άτομα 12C, 13C, και σε ένα πολύ μικρό ποσοστό, 14C.
Εκτός από την περίπτωση των ισοτόπων του υδρογόνου, που διαφέρουν πολύ το καθένα από το άλλο σε σχετική μάζα, αρκετά ώστε να προκαλούνται παρατηρήσιμες χημικές συνέπειες από τη χρήση ενός ισοτόπου αντί άλλου, τα ισότοπα ενός δεδομένου χημικού στοιχείου είναι σχεδόν μη διακριτά από χημικής πλευράς.
Ολα τα χημικά στοιχεία έχουν κάποια ισότοπα που είναι ραδιενεργά, και ονομάζονται ραδιοϊσότοπα, παρόλο που δεν έχουν βρεθεί στη φύση όλα αυτά τα ραδιοϊσότοπα. Τα ραδιοϊσότοπα τυπικά διασπώνται σε άλλα χημικά στοιχεία, σε συνδυασμό με τη ραδιενεργή εκπομπή σωματιδίων α ή σωματιδίων β. Αν ένα χημικό στοιχείο έχει ισότοπα που δεν είναι ραδιενεργά, τότε λέμε ότι τα ισότοπα αυτά είναι «σταθερά». Όλα τα γνωστά σταθερά ισότοπα έχουν βρεθεί στη φύση, και λέγονται αρχέγονα ισότοπα. Πολλά από τα ραδιοϊσότοπα, που δεν έχουν βρεθεί στη φύση, χαρακτηρίστηκαν αφού δημιουργήθηκαν τεχνητά. Ορισμένα χημικά στοιχεία δεν έχουν καθόλου σταθερά ισότοπα, και αποτελούνται μόνο από ραδιοϊσότοπα. Ειδικά, χημικά στοιχεία χωρίς κανένα σταθερό ισότοπο είναι το τεχνήτιο, το προμήθειο, και όλα τα χημικά στοιχεία με ατομικό αριθμό μεγαλύτερο από 82.
Από τα 80 χημικά στοιχεία με τουλάχιστον ένα σταθερό ισότοπο, τα 26 έχουν μόνο ένα σταθερό ισότοπο. Ο μέσος όρος των σταθερών ισοτόπων για τα 80 χημικά στοιχεία με τουλάχιστον ένα σταθερό ισότοπο είναι 3,1 ισότοπα ανά χημικό στοιχείο. Ο μεγαλύτερος αριθμός σταθερών ισοτόπων για ένα συγκεκριμένο χημικό στοιχείο είναι 10 και ισχύει για τον κασσίτερο.
Συμβολισμός χημικών στοιχείων Επεξεργασία
Για τον συμβολισμό του κάθε στοιχείου, χρησιμοποιείται το αρχικό γράμμα της λατινικής του ονομασίας (με κεφαλαίο). Στις περιπτώσεις που το αρχικό γράμμα είναι ίδιο στα ονόματα δύο ή περισσότερων στοιχείων χρησιμοποιείται και δεύτερο γράμμα του ονόματος του στοιχείου (αναγράφεται με μικρό). Έτσι, το υδρογόνο συμβολίζεται ως Η (αρχικό της λέξης Hydrogenium), το ήλιο ως He (από τη λατινική ονομασία του Helium) και ο υδράργυρος ως Hg (Hydrargyrum).
Αφθονία χημικών στοιχείων Επεξεργασία
Στον φλοιό της Γης απαντώνται 92 διαφορετικά χημικά στοιχεία. Εξ αυτών τη μεγαλύτερη αφθονία παρουσιάζουν κατά σειρά το οξυγόνο, το πυρίτιο, το αργίλιο, ο σίδηρος, το ασβέστιο, το νάτριο, το κάλιο και το μαγνήσιο.
Επίσης εκ του συνόλου των 92 στοιχείων, απαραίτητα για τη ζωή κρίνονται μόνο τα 27. Τέσσερα δε από αυτά, ο άνθρακας, το υδρογόνο, το οξυγόνο και το άζωτο αποτελούν το 96% της κατά βάρος σύστασης των έμβιων οργανισμών, παρότι, πλην του οξυγόνου, θεωρούνται αυτά ως σπάνια στοιχεία.
Το υπόλοιπο 4% της κατά βάρος σύστασης των οργανισμών καταλαμβάνεται από τα στοιχεία φωσφόρο, νάτριο, κάλιο, ασβέστιο, μαγνήσιο, χλώριο και από κάποια "ίχνη" άλλων στοιχείων, (περίπου το 0,1%) που και εκ του λόγου αυτού καλούνται εν προκειμένω ιχνοστοιχεία των οποίων όμως η παρουσία τους κρίνεται απαραίτητη σε πληθώρα λειτουργιών των οργανισμών.
Ατομικός και μαζικός αριθμός Επεξεργασία
Σε κάθε άτομο ο αριθμός των πρωτονίων είναι ίσος με τον αριθμό των ηλεκτρονίων του. Ο αριθμός των πρωτονίων του καθορίζει το είδος του στοιχείου, λέγεται ατομικός αριθμός και συμβολίζεται με "Ζ". Αποτελεί κατά κάποιο τρόπο τον αριθμό ταυτότητας του στοιχείου. Όλα τα άτομα ενός στοιχείου έχουν τον ίδιο ατομικό αριθμό. Το άθροισμα πρωτονίων "Ζ" και νετρονίων "Ν" που υπάρχουν στον πυρήνα ενός ατόμου, δηλαδή ο αριθμός των νουκλεονίων ενός χημικού στοιχείου, λέγεται μαζικός αριθμός και συμβολίζεται με "Α".
Κάτω από ορισμένες συνθήκες τα άτομα μπορούν να προσλάβουν ή να αποβάλλουν ένα ή περισσότερα ηλεκτρόνια. Τα φορτισμένα άτομα ονομάζονται ιόντα των στοιχείων. Τα ιόντα με θετικό φορτίο ονομάζονται κατιόντα και με αρνητικό φορτίο ανιόντα.
Προτάσεις Επεξεργασία
Για τα νουκλίδια των χημικών στοιχείων ισχύουν οι εξής προτάσεις:
- Νουκλίδια με ίδιο ατομικό αριθμό έχουν τον ίδιο αριθμό πρωτονίων και ανήκουν στο ίδιο χημικό στοιχείο.
- Τα νουκλίδια του ίδιου χημικού στοιχείου έχουν πάντα τον ίδιο ατομικό αριθμό Z, ενώ μπορούν να μην έχουν τον ίδιο αριθμό νετρονίων N και επομένως ούτε τον ίδιο μαζικό αριθμό A=Z+N.
- Νουκλίδια με ίδιο αριθμό πρωτονίων και νετρονίων, δηλ. ίδια Z, N και A, αλλά διαφορετική ενεργειακή κατάσταση ανήκουν στο ίδιο χημικό στοιχείο και τα άτομα ονομάζονται ισομερή. Π.χ.: τεχνήτιο-99 και τεχνήτιο-99-μετασταθές(m)
- Νουκλίδια με ίδιο αριθμό πρωτονίων και διαφορετικό αριθμό νετρονίων, δηλ. ίδιο Z, διαφορετικό N και διαφορετικό A, ανήκουν στο ίδιο χημικό στοιχείο και τα άτομα ονομάζονται ισότοπα. Π.χ.: άνθρακας-12, άνθρακας-13, άνθρακας-14.
- Νουκλίδια με ίδιο αριθμό νετρονίων και διαφορετικό αριθμό πρωτονίων, δηλ. διαφορετικό Z, ίδιο N και διαφορετικό A, δεν ανήκουν στο ίδιο χημικό στοιχείο και τα άτομα ονομάζονται ισότονα. Π.χ.: άνθρακας-13, άζωτο-14, οξυγόνο-15.
- Νουκλίδια με ίδιο μαζικό αριθμό και διαφορετικό ατομικό αριθμό, δηλ. διαφορετικό Z, διαφορετικό N και ίδιο A(=Z+N), δεν ανήκουν στο ίδιο χημικό στοιχείο και τα άτομα ονομάζονται ισοβαρή (αντπρβ. παράγωγα της διάσπασης βήτα). Π.χ.: άζωτο-17, οξυγόνο-17, φθόριο-17.
- Ειδικότερα, δύο πυρήνες με ίδιο μαζικό αριθμό και αριθμό πρωτονίων του ενός ίσο με τον αριθμό των νετρονίων του άλλου ονομάζονται κατοπτρικοί πυρήνες (αντπρβ. ενέργειες σύνδεσης κατοπτρικών πυρήνων). Π.χ.: υδρογόνο-3 και ήλιο-3.
- Νουκλίδια με ίση περίσσεια νετρονίων (διαφορά αριθμού νετρονίων μείον αριθμό πρωτονίων), δηλ. ίδιο (N-Z), δεν ανήκουν στο ίδιο χημικό στοιχείο και τα άτομα ονομάζονται ισοδιαφορικά (αντπρβ. παράγωγα της διάσπασης άλφα). Π.χ.: άνθρακας-13, άζωτο-15, οξυγόνο-17 (περίσσεια ενός νετρονίου).
Η ατομική θεωρία του Ντάλτον Επεξεργασία
Η ατομική θεωρία του Ντάλτον υποστηρίζει ότι:
- Κάθε στοιχείο αποτελείται από πολύ μικρά σωματίδια, τα οποία ονομάζονται άτομα.
- Όλα τα άτομα ενός στοιχείου είναι όμοια μεταξύ τους, ενώ τα άτομα διαφορετικών στοιχείων διαφέρουν μεταξύ τους (κατά μέγεθος, κατά μάζα).
- Τα άτομα ενός στοιχείου δεν μετατρέπονται σε άλλου είδους άτομα, ούτε καταστρέφονται, ούτε δημιουργούνται κατά τα χημικά φαινόμενα.
- Όταν διαφορετικά άτομα ενώνονται μεταξύ τους, σχηματίζονται χημικές ενώσεις.
- Σε κάθε χημική ένωση, το είδος των ατόμων και η μεταξύ τους αναλογία είναι σταθερή.
Σημαντικότεροι ερευνητές στοιχείων Επεξεργασία
Σημανικότεροι ερευνητές στην ανακάλυψη των χημικών στοιχείων θεωρούνται οι:
Δείτε επίσης Επεξεργασία
Εξωτερικοί σύνδεσμοι Επεξεργασία
Παραπομπές και σημειώσεις Επεξεργασία
- ↑ E. M. Burbidge, G. R. Burbidge, W. A. Fowler, F. Hoyle (1957). "Synthesis of the Elements in Stars". Reviews of Modern Physics 29 (4): 547–650. Bibcode:1957RvMP...29..547B. doi:10.1103/RevModPhys.29.547.
- ↑ Los Alamos National Laboratory (2011). "Periodic Table of Elements: Oxygen". Los Alamos, New Mexico: Los Alamos National Security, LLC. Retrieved 7 May 2011.
- ↑ Oerter, Robert (2006). The Theory of Almost Everything: The Standard Model, the Unsung Triumph of Modern Physics. Penguin. p. 223. ISBN 978-0-452-28786-0.
- ↑ Oganessian, Yu. Ts.; Abdullin, F. Sh.; Bailey, P. D.; Benker, D. E.; Bennett, M. E.; Dmitriev, S. N.; Ezold, J. G.; Hamilton, J. H. et al. (2010). "Synthesis of a New Element with Atomic Number Z=117". Physical Review Letters (142502 ed.) (Physical Review Letter) 104 (14): 142502. Bibcode:2010PhRvL.104n2502O. doi:10.1103/PhysRevLett.104.142502. PMID 20481935.
- ↑ See the timeline on p.10 in Oganessian, Yu. Ts.; Utyonkov, V.; Lobanov, Yu.; Abdullin, F.; Polyakov, A.; Sagaidak, R.; Shirokovsky, I.; Tsyganov, Yu. et al. (2006). "Evidence for Dark Matter". Physical Review C 74 (4): 044602. Bibcode:2006PhRvC..74d4602O. doi:10.1103/PhysRevC.74.044602.
- ↑ lbl.gov (2005). "The Universe Adventure Hydrogen and Helium". Lawrence Berkeley National Laboratory U.S. Department of Energy.
- ↑ astro.soton.ac.uk (January 3, 2001). "Formation of the light elements". University of Southampton.
- ↑ foothill.edu (October 18, 2006). "How Stars Make Energy and New Elements". Foothill College.
- ↑ ATOMIC NUMBER AND MASS NUMBERS". ndt-ed.org. Retrieved 17 February 2013.
- ↑ periodic.lanl.gov. "PERIODIC TABLE OF ELEMENTS: LANL Carbon". Los Alamos National Laboratory.
- ↑ Katsuya Yamada. "Atomic mass, isotopes, and mass number.". Los Angeles Pierce College.
- ↑ Για τα φυσικά ισότοπα του άνθρακα.