Οκτρεοτίδη
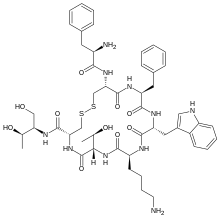
Η οκτρεοτίδη, που πωλείται με την εμπορική ονομασία Sandostatin μεταξύ άλλων, είναι οκταπεπτίδιο που μιμείται τη φυσική σωματοστατίνη φαρμακολογικά, αν και είναι πιο ισχυρός αναστολέας της αυξητικής ορμόνης, της γλυκαγόνης και της ινσουλίνης από τη φυσική ορμόνη. Συντέθηκε για πρώτη φορά το 1979 από τον χημικό Βίλφριντ Μπάουερ και συνδέεται κυρίως με τους υποδοχείς σωματοστατίνης SSTR2 και SSTR5.[3] Εγκρίθηκε για χρήση στις Ηνωμένες Πολιτείες το 1988.[2][1]
 | |
 | |
| Ονομασία IUPAC | |
|---|---|
(4R,7S,10S,13R,16S,19R)-10-(4-aminobutyl)-19- [[(2R)-2-amino-3-phenyl-propanoyl]amino]-16- benzyl-N-[(2R,3R)-1,3-dihydroxybutan-2-yl]-7- (1-hydroxyethyl)-13-(1H-indol-3-ylmethyl)-6,9,12, 15,18-pentaoxo-1,2-dithia-5,8,11,14,17- pentazacycloicosane-4-carboxamide | |
| Κλινικά δεδομένα | |
| Εμπορικές ονομασίες | Sandostatin, Bynfezia Pen, Mycapssa, άλλες |
| AHFS/Drugs.com | monograph |
| MedlinePlus | a693049 |
| Δεδομένα άδειας |
|
| Κατηγορία ασφαλείας κύησης |
|
| Οδοί χορήγησης | Υποδόρια, ενδομυικά, ενδοφλέβια, από το στόμα |
| Κυκλοφορία | |
| Κυκλοφορία |
|
| Φαρμακοκινητική | |
| Βιοδιαθεσιμότητα | 60% (IM), 100% (SC) |
| Πρωτεϊνική σύνδεση | 40–65% |
| Μεταβολισμός | Ήπαρ |
| Βιολογικός χρόνος ημιζωής | 1,7–1,9 ώρες |
| Απέκκριση | Ούρα (32%) |
| Κωδικοί | |
| Αριθμός CAS | 83150-76-9 135467-16-2 (pamoate) |
| Κωδικός ATC | H01CB02 |
| PubChem | CID Octreotide |
| IUPHAR/BPS | 2055 |
| DrugBank | DB00104 |
| ChemSpider | 395352 |
| UNII | RWM8CCW8GP |
| KEGG | D00442 |
| ChEBI | CHEBI:7726 |
| ChEMBL | CHEMBL1680 |
| Χημικά στοιχεία | |
| Χημικός τύπος | C49H66N10O10S2 |
| Μοριακή μάζα | 1.019,25 g·mol−1 |
C[C@H]([C@H]1C(=O)N[C@@H](CSSC[C@@H](C(=O)N[C@H](C(=O)N[C@@H](C(=O)N[C@H](C(=O)N1)CCCCN)Cc2c[nH]c3c2cccc3)Cc4ccccc4)NC(=O)[C@@H](Cc5ccccc5)N)C(=O)N[C@H](CO)[C@@H](C)O)O | |
InChI=1S/C49H66N10O10S2/c1-28(61)39(25-60)56-48(68)41-27-71-70-26-40(57-43(63)34(51)21-30-13-5-3-6-14-30)47(67)54-37(22-31-15-7-4-8-16-31)45(65)55-38(23-32-24-52-35-18-10-9-17-33(32)35)46(66)53-36(19-11-12-20-50)44(64)59-42(29(2)62)49(69)58-41/h3-10,13-18,24,28-29,34,36-42,52,60-62H,11-12,19-23,25-27,50-51H2,1-2H3,(H,53,66)(H,54,67)(H,55,65)(H,56,68)(H,57,63)(H,58,69)(H,59,64)/t28-,29-,34-,36+,37+,38-,39-,40+,41+,42+/m1/s1 Key:DEQANNDTNATYII-OULOTJBUSA-N | |
| (verify) | |
Ιατρικές χρήσεις
ΕπεξεργασίαΌγκοι
ΕπεξεργασίαΗ οκτρεοτίδη χρησιμοποιείται για τη θεραπεία όγκων που παράγουν αυξητική ορμόνη (ακρομεγαλία και γιγαντισμός), όταν η χειρουργική επέμβαση αντενδείκνυται, όγκων της υπόφυσης που εκκρίνουν θυρεοτρόπο ορμόνη (θυρεοτροπίνωμα), διάρροια και επεισόδια έξαψης που σχετίζονται με καρκινοειδές σύνδρομο και διάρροια σε άτομα με εντερικούς όγκους που παράγουν αγγειοδραστικό εντερικό πεπτίδιο ( Βιπώματα). Η οκτρεοτίδη χρησιμοποιείται επίσης σε ήπιες περιπτώσεις γλυκαγονώματος όταν η χειρουργική επέμβαση δεν είναι επιλογή.[4][5]
Αιμορραγικοί κιρσοί του οισοφάγου
ΕπεξεργασίαΗ οκτρεοτίδη χορηγείται συχνά ως έγχυση για τη διαχείριση της οξείας αιμορραγίας από κιρσούς οισοφάγου στην κίρρωση του ήπατος με βάση ότι μειώνει την πίεση της πυλαίας φλέβας, αν και τα τρέχοντα στοιχεία υποδηλώνουν ότι αυτή η επίδραση είναι παροδική και δεν βελτιώνει την επιβίωση.[6]
Ραδιοσήμανση
ΕπεξεργασίαΗ οκτρεοτίδη χρησιμοποιείται στην απεικόνιση πυρηνικής ιατρικής με σήμανση με ίνδιο-111 (Octreoscan) για την μη επεμβατική απεικόνιση των νευροενδοκρινών και άλλων όγκων που εκφράζουν υποδοχείς σωματοστατίνης.[7] Έχει ραδιοσημανθεί επίσης με άνθρακα-11[8] καθώς και γάλλιο-68 (χρησιμοποιώντας εδοτρεοτίδη), επιτρέποντας την απεικόνιση με τομογραφία εκπομπής ποζιτρονίων (PET), η οποία παρέχει υψηλότερη ανάλυση και ευαισθησία.
Η οκτρεοτίδη (συνήθως ως το παράγωγο εδοτρεοτίδη ή DOTATOC) μπορεί επίσης να επισημανθεί με μια ποικιλία θεραπευτικών ραδιονουκλεϊδίων, όπως το ύττριο-90 ή το λουτέτιο-177, για να επιτρέψει τη θεραπεία με ραδιονουκλεϊδικούς υποδοχείς πεπτιδίου (PRRT) για τη θεραπεία μη εξαιρέσιμων νευροενδοκρινών όγκων.
Ακρομεγαλία
ΕπεξεργασίαΗ οκτρεοτίδη μπορεί επίσης να χρησιμοποιηθεί στη θεραπεία της ακρομεγαλίας, μιας διαταραχής που οφείλεται σε περίσσεια αυξητικής ορμόνης (ΑΟ). Η οκτρεοτίδη, ως ανάλογο σωματοστατίνης, αναστέλλει την απελευθέρωση ΑΟ από την υπόφυση μέσω μιας διαδικασίας που συνήθως εμπλέκεται σε αρνητική ανάδραση.
Τον Ιούνιο του 2020, το Mycapssa (οκτρεοτίδη) εγκρίθηκε για ιατρική χρήση στις Ηνωμένες Πολιτείες με ένδειξη για τη μακροχρόνια θεραπεία συντήρησης σε ασθενείς με ακρομεγαλία που έχουν ανταποκριθεί και ανεχτεί τη θεραπεία με οκτρεοτίδη ή λανρεοτίδη.[9][10] Το Mycapssa είναι το πρώτο και μοναδικό από του στόματος ανάλογο σωματοστατίνης (SSA) που έχει εγκριθεί από τον FDA.[10]
Γαστρεντερικά συρίγγια
ΕπεξεργασίαΗ οκτρεοτίδη βοηθά στη διαχείριση του συριγγίου μειώνοντας τις γαστρεντερικές εκκρίσεις και αναστέλλοντας την κινητικότητα του γαστρεντερικού συστήματος, ελέγχοντας και μειώνοντας έτσι την παροχή του. Η αξία στην επούλωση των εντερικών συριγγίων δεν έχει ακόμη αποδειχθεί και η χρήση ρουτίνας είναι περιορισμένη λόγω των παρενεργειών.
Υπογλυκαιμία
ΕπεξεργασίαΗ οκτρεοτίδη χρησιμοποιείται επίσης στη θεραπεία της ανθεκτικής υπογλυκαιμίας σε νεογνά και της υπογλυκαιμίας που προκαλείται από σουλφονυλουρίες σε ενήλικες.
Είναι χρήσιμο στη διαχείριση της υπερδοσολογίας αντιδιαβητικών φαρμάκων τύπου σουλφονυλουρίας, όταν είναι υποτροπιάζουσες ή ανθεκτικές στην παρεντερική δεξτρόζη. Μηχανισμός δράσης είναι η καταστολή της έκκρισης ινσουλίνης.
Γαστρεντερικές εκκρίσεις
ΕπεξεργασίαΗ οκτρεοτίδη χρησιμοποιείται στο πλαίσιο της παρηγορητικής φροντίδας για τη μείωση των γαστρεντερικών εκκρίσεων, με σκοπό την ανακούφιση του εμετού που σχετίζεται με την απόφραξη του εντέρου.
Αντενδείξεις
ΕπεξεργασίαΗ οκτρεοτίδη δεν έχει μελετηθεί επαρκώς για τη θεραπεία παιδιών καθώς και εγκύων και θηλαζουσών γυναικών. Το φάρμακο χορηγείται σε αυτές τις ομάδες μόνο εάν η ανάλυση κινδύνου-οφέλους είναι θετική.[11][12]
Παρενέργειες
ΕπεξεργασίαΟι πιο συχνές ανεπιθύμητες ενέργειες είναι πονοκέφαλος, υποθυρεοειδισμός, αλλαγές στην καρδιακή αγωγιμότητα, γαστρεντερικές αντιδράσεις (που συμπεριλαμβάνουν κράμπες, ναυτία/έμετο και διάρροια ή δυσκοιλιότητα), πέτρες στη χολή, μείωση της απελευθέρωσης ινσουλίνης, υπεργλυκαιμία[13] ή μερικές φορές υπογλυκαιμία και (συνήθως παροδική) αντίδραση στην περιοχή έγχυσης. Ο αργός καρδιακός ρυθμός, οι δερματικές αντιδράσεις όπως κνησμός, η υπερχολερυθριναιμία, ο υποθυρεοειδισμός, η ζάλη και η δύσπνοια είναι επίσης αρκετά συχνές (πάνω από 1%). Οι σπάνιες ανεπιθύμητες ενέργειες περιλαμβάνουν οξείες αναφυλακτικές αντιδράσεις, παγκρεατίτιδα και ηπατίτιδα.[11][12]
Ορισμένες μελέτες ανέφεραν αλωπεκία σε όσους υποβλήθηκαν σε θεραπεία με οκτρεοτίδη.[14] Σε μελέτη του 1998 αρουραίοι που υποβλήθηκαν σε θεραπεία με οκτρεοτίδη παρουσίασαν στυτική δυσλειτουργία.[15]
Παρατηρήθηκε παράταση του διαστήματος QT, αλλά δεν είναι βέβαιο εάν αυτό είναι αντίδραση στο φάρμακο ή αποτέλεσμα υπάρχουσας ασθένειας.[11]
Αλληλεπιδράσεις
ΕπεξεργασίαΗ οκτρεοτίδη μπορεί να μειώσει την εντερική επαναρρόφηση της κυκλοσπορίνης, καθιστώντας πιθανώς απαραίτητη την αύξηση της δόσης.[16] Τα άτομα με σακχαρώδη διαβήτη μπορεί να χρειάζονται λιγότερη ινσουλίνη ή από του στόματος αντιδιαβητικά όταν λαμβάνουν οκτρεοτίδη, καθώς αναστέλλει την έκκριση γλυκαγόνης πιο έντονα και για μεγαλύτερο χρονικό διάστημα από την έκκριση ινσουλίνης.[11] Η βιοδιαθεσιμότητα της βρωμοκρυπτίνης είναι αυξημένη:[12] εκτός από αντιπαρκινσονικό, η βρωμοκρυπτίνη χρησιμοποιείται επίσης για τη θεραπεία της ακρομεγαλίας.
Φαρμακολογία
ΕπεξεργασίαΔεδομένου ότι η οκτρεοτίδη μοιάζει με τη σωματοστατίνη σε φυσιολογικές δραστηριότητες, μπορεί να:
- αναστείλει την έκκριση πολλών ορμονών, όπως η γαστρίνη, η χολοκυστοκινίνη, η γλυκαγόνη, η αυξητική ορμόνη, η ινσουλίνη, η εκκριτίνη, το παγκρεατικό πολυπεπτίδιο, η TSH και το αγγειοδραστικό εντερικό πεπτίδιο,
- μειώσει της έκκρισης υγρών από το έντερο και το πάγκρεας,
- μειώσει της γαστρεντερικής κινητικότητας και αναστολή της συστολής της χοληδόχου κύστης,
- αναστείλει τη δράση ορισμένων ορμονών από την πρόσθια υπόφυση,
- προκαλέσει αγγειοσυστολή στα αιμοφόρα αγγεία και
- μειώσει τις πιέσεις των πυλαίων αγγείων σε αιμορραγικούς κιρσούς.
Έχει επίσης αποδειχθεί έχει αναλγητική δράση, πιθανότατα δρώντας ως μερικός αγωνιστής στον μ-υποδοχέα οπιοειδών.[17][18]
Φαρμακοκινητική
ΕπεξεργασίαΗ οκτρεοτίδη απορροφάται γρήγορα και πλήρως μετά από υποδόρια έγχυση. Η μέγιστη συγκέντρωση στο πλάσμα επιτυγχάνεται μετά από 30 λεπτά. Ο χρόνος ημιζωής αποβολής είναι 100 λεπτά (1,7 ώρες) κατά μέσο όρο όταν εφαρμόζεται υποδόρια. Μετά από ενδοφλέβια ένεση, η ουσία αποβάλλεται σε δύο φάσεις με χρόνο ημιζωής 10 και 90 λεπτά, αντίστοιχα.[11][12]
Ιστορία
ΕπεξεργασίαΤο οξικό οκτρεοτίδιο εγκρίθηκε για χρήση στις Ηνωμένες Πολιτείες το 1988.[1][2]
Έρευνα
ΕπεξεργασίαΗ οκτρεοτίδη έχει επίσης χρησιμοποιηθεί εκτός ετικέτας για τη θεραπεία σοβαρής, ανθεκτικής διάρροιας από άλλες αιτίες. Χρησιμοποιείται στην τοξικολογία για τη θεραπεία της παρατεταμένης υποτροπιάζουσας υπογλυκαιμίας μετά από σουλφονυλουρία και πιθανώς υπερδοσολογία μεγλιτινίδης. Έχει επίσης χρησιμοποιηθεί με διάφορους βαθμούς επιτυχίας σε βρέφη με νησιδιοβλάστωση για να βοηθήσει στη μείωση της υπερέκκρισης ινσουλίνης. Αρκετές κλινικές δοκιμές έχουν δείξει την επίδραση της οκτρεοτίδης ως οξείας θεραπείας στην αθροιστική κεφαλαλγία, όπου έχει αποδειχθεί ότι η χορήγηση υποδόριας οκτρεοτίδης είναι αποτελεσματική σε σύγκριση με το εικονικό φάρμακο.[19]
Η οκτρεοτίδη έχει επίσης διερευνηθεί σε άτομα με πόνο από χρόνια παγκρεατίτιδα.[20]
Έχει χρησιμοποιηθεί στη θεραπεία κακοήθους εντερικής απόφραξης.[21]
Η οκτρεοτίδη μπορεί να χρησιμοποιηθεί σε συνδυασμό με μιδοδρίνη για την μερική αναστροφή της περιφερικής αγγειοδιαστολής στο ηπατονεφρικό σύνδρομο. Αυξάνοντας τη συστηματική αγγειακή αντίσταση, αυτά τα φάρμακα μειώνουν τη διαφυγή και βελτιώνουν τη νεφρική αιμάτωση, παρατείνοντας την επιβίωση μέχρι την οριστική θεραπεία με μεταμόσχευση ήπατος.[22] Ομοίως, η οκτρεοτίδη μπορεί να χρησιμοποιηθεί για τη θεραπεία της ανθεκτικής χρόνιας υπότασης.[23]
Ενώ ορισμένα περιστατικά έχουν θεραπευτεί επιτυχώς,[24][25] μεγαλύτερες μελέτες απέτυχαν να αποδείξουν την αποτελεσματικότητα στη θεραπεία του χυλοθώρακα.[26]
Μια μικρή μελέτη έδειξε ότι η οκτρεοτίδη μπορεί να είναι αποτελεσματική στη θεραπεία της ιδιοπαθούς ενδοκρανιακής υπέρτασης.[27]
Παχυσαρκία
ΕπεξεργασίαΗ οκτρεοτίδη έχει χρησιμοποιηθεί πειραματικά για τη θεραπεία της παχυσαρκίας, ιδιαίτερα της παχυσαρκίας που προκαλείται από βλάβες στα κέντρα πείνας και κορεσμού του υποθαλάμου, μια περιοχή του εγκεφάλου που είναι κομβική για τη ρύθμιση της πρόσληψης τροφής και της ενεργειακής δαπάνης.[28]
Το κύκλωμα ξεκινά με μια περιοχή του υποθαλάμου, τον τοξοειδή πυρήνα, που έχει εξόδους στον πλευρικό υποθάλαμο (LH) και στον κοιλιακό υποθάλαμο (VMH), τα κέντρα τροφοδοσίας και κορεσμού του εγκεφάλου, αντίστοιχα.[29][30] Ο VMH μερικές φορές τραυματίζεται από συνεχιζόμενη θεραπεία για οξεία λεμφοβλαστική λευχαιμία (ΟΛΛ) ή χειρουργική επέμβαση ή ακτινοβολία για τη θεραπεία όγκων του οπίσθιου κρανιακού βόθρου.[28] Με τον VMH απενεργοποιημένο και να μην ανταποκρίνεται πλέον στα σήματα του περιφερειακού ενεργειακού ισοζυγίου, «η δραστηριότητα του απαγωγού συμπαθητικού πέφτει, με αποτέλεσμα αδιαθεσία και μειωμένη ενεργειακή δαπάνη, και η δραστηριότητα του πνευμονογαστρικού συστήματος αυξάνεται, με αποτέλεσμα αυξημένη έκκριση ινσουλίνης και λιπογένεση.»[31] «Η δυσλειτουργία του VMH προάγει την υπερβολική πρόσληψη θερμίδων και τη μειωμένη θερμιδική δαπάνη, οδηγώντας σε συνεχή και αδιάκοπη αύξηση βάρους. Προσπάθειες για περιορισμό των θερμίδων ή φαρμακοθεραπεία με αδρενεργικούς ή σεροτονινεργικούς παράγοντες είχαν προηγουμένως συναντήσει μικρή ή μόνο σύντομη επιτυχία στη θεραπεία αυτού του συνδρόμου.»[28]
Σε αυτό το πλαίσιο, η οκτρεοτίδη καταστέλλει την υπερβολική απελευθέρωση ινσουλίνης και μπορεί να αυξήσει τη δράση της, αναστέλλοντας έτσι την υπερβολική αποθήκευση λίπους. Σε μια μικρή κλινική δοκιμή σε δεκαοκτώ παιδιατρικούς ασθενείς με δυσεπίλυτη αύξηση βάρους μετά από θεραπεία για ΟΛΛ ή όγκους εγκεφάλου και άλλες ενδείξεις δυσλειτουργίας του υποθαλάμου, η οκτρεοτίδη μείωσε τον δείκτη μάζας σώματος (ΔΜΣ) και την ανταπόκριση ινσουλίνης κατά τη διάρκεια του τεστ ανοχής γλυκόζης, ενώ αυξήθηκε η αναφερόμενη από τους γονείς σωματική δραστηριότητα και ποιότητα ζωής (QoL) σε σχέση με το εικονικό φάρμακο.[28]
Σε μια ξεχωριστή ελεγχόμενη με εικονικό φάρμακο δοκιμή παχύσαρκων ενηλίκων χωρίς γνωστές βλάβες του υποθαλάμου, τα παχύσαρκα άτομα που έλαβαν οκτρεοτίδη μακράς δράσης έχασαν βάρος και μείωσαν τον ΔΜΣ τους σε σύγκριση με άτομα που έλαβαν εικονικό φάρμακο. Η εκ των υστέρων ανάλυση πρότεινε μεγαλύτερες επιδράσεις σε ασθενείς που έλαβαν την υψηλότερη δόση του φαρμάκου και μεταξύ «καυκάσιων ατόμων με έκκριση ινσουλίνης μεγαλύτερη από τη διάμεση τιμή της κοόρτης». «Δεν υπήρξαν στατιστικά σημαντικές αλλαγές στις βαθμολογίες ποιότητας ζωής, στο σωματικό λίπος, στη συγκέντρωση λεπτίνης, στο Απογραφή κατάθλιψης Beck ή στην πρόσληψη μακροθρεπτικών συστατικών», αν και τα άτομα που έλαβαν οκτρεοτίδη είχαν υψηλότερη γλυκόζη στο αίμα μετά από μια δοκιμασία ανοχής γλυκόζης από εκείνα που έλαβαν εικονικό φάρμακο.[32]
Παραπομπές
Επεξεργασία- ↑ 1,0 1,1 1,2 «Sandostatin Lar Depot- octreotide acetate kit». DailyMed. 11 Απριλίου 2019. Αρχειοθετήθηκε από το πρωτότυπο στις 24 Μαρτίου 2021. Ανακτήθηκε στις 16 Φεβρουαρίου 2020.
- ↑ 2,0 2,1 2,2 «Bynfezia Pen- octreotide acetate injection». DailyMed. 19 Φεβρουαρίου 2020. Αρχειοθετήθηκε από το πρωτότυπο στις 19 Σεπτεμβρίου 2022. Ανακτήθηκε στις 19 Απριλίου 2021.
- ↑ Hofland, L. J.; Lamberts, S. W. (January 1996). «Somatostatin receptors and disease: role of receptor subtypes». Bailliere's Clinical Endocrinology and Metabolism 10 (1): 163–176. doi:. ISSN 0950-351X. PMID 8734455. Αρχειοθετήθηκε από το πρωτότυπο στις 11 August 2022. https://web.archive.org/web/20220811220307/https://pubmed.ncbi.nlm.nih.gov/8734455/. Ανακτήθηκε στις 9 March 2021.
- ↑ Octreotide monograph
- ↑ «Somatostatin analogue in treatment of coexisting glucagonoma and pancreatic pseudocyst: dissociation of responses». Surgery 108 (3): 581–7. 1990. PMID 2168587. https://archive.org/details/sim_surgery_1990-09_108_3/page/581.
- ↑ «Somatostatin analogues for acute bleeding oesophageal varices». The Cochrane Database of Systematic Reviews (3): CD000193. July 2008. doi:. PMID 18677774.
- ↑ «Medscape: Octreoscan review». Αρχειοθετήθηκε από το πρωτότυπο στις 12 Φεβρουαρίου 2017. Ανακτήθηκε στις 28 Οκτωβρίου 2010.
- ↑ «Direct one-step labeling of cysteine residues on peptides with [(11)C]methyl triflate for the synthesis of PET radiopharmaceuticals». Amino Acids 45 (5): 1097–108. November 2013. doi:. PMID 23921782.
- ↑ «Octreotide Capsules - Our Research». Chiasma. 24 Ιανουαρίου 2020. Αρχειοθετήθηκε από το πρωτότυπο στις 2 Ιουλίου 2020. Ανακτήθηκε στις 30 Ιουνίου 2020.
- ↑ 10,0 10,1 (26 June 2020). Chiasma Announces FDA Approval of Mycapssa (Octreotide) Capsules, the First and Only Oral Somatostatin Analog. Δελτίο τύπου.
- ↑ 11,0 11,1 11,2 11,3 11,4 Haberfeld, H, επιμ. (2009). Austria-Codex (στα Γερμανικά) (2009/2010 έκδοση). Vienna: Österreichischer Apothekerverlag. ISBN 978-3-85200-196-8.
- ↑ 12,0 12,1 12,2 12,3 Dinnendahl, V, επιμ. (2010). Arzneistoff-Profile (στα Γερμανικά). 8 (23 έκδοση). Eschborn, Germany: Govi Pharmazeutischer Verlag. ISBN 978-3-7741-9846-3.
- ↑ «Decreased leg glucose uptake during exercise contributes to the hyperglycaemic effect of octreotide». Clinical Physiology and Functional Imaging 30 (2): 141–5. March 2010. doi:. PMID 20132129.
- ↑ «A risk-benefit assessment of octreotide in the treatment of acromegaly». Drug Safety 17 (5): 317–24. November 1997. doi:. PMID 9391775.
- ↑ «Inhibition of penile erection in rats by a long-acting somatostatin analogue, octreotide (SMS 201-995)». British Journal of Urology 81 (1): 142–5. January 1998. doi:. PMID 9467491.
- ↑ Klopp, T, επιμ. (2010). Arzneimittel-Interaktionen (στα Γερμανικά) (2010/2011 έκδοση). Arbeitsgemeinschaft für Pharmazeutische Information. ISBN 978-3-85200-207-1.
- ↑ «Opiate antagonistic properties of an octapeptide somatostatin analog». Proceedings of the National Academy of Sciences of the United States of America 79 (15): 4815–7. August 1982. doi:. PMID 6126877. Bibcode: 1982PNAS...79.4815M.
- ↑ «Design, synthesis and biological evaluation of 3-amino-3-phenylpropionamide derivatives as novel mu opioid receptor ligands». Bioorganic & Medicinal Chemistry Letters 10 (6): 523–6. March 2000. doi:. PMID 10741545.
- ↑ «Subcutaneous octreotide in cluster headache: randomized placebo-controlled double-blind crossover study». Annals of Neurology 56 (4): 488–94. October 2004. doi:. PMID 15455406. https://archive.org/details/sim_annals-of-neurology_2004-10_56_4/page/488.
- ↑ «The role of octreotide and somatostatin in acute and chronic pancreatitis». Digestion 60 Suppl 2 (2): 23–31. 1999. doi:. PMID 10207228.
- ↑ «Clinical efficacy and safety of octreotide (SMS201-995) in terminally ill Japanese cancer patients with malignant bowel obstruction». Japanese Journal of Clinical Oncology 38 (5): 354–9. May 2008. doi:. PMID 18490369.
- ↑ «Combination treatment with octreotide, midodrine, and albumin improves survival in patients with type 1 and type 2 hepatorenal syndrome». Journal of Clinical Gastroenterology 43 (7): 680–5. August 2009. doi:. PMID 19238094.
- ↑ Patient.info (Feb 2013). Hypotension. Αρχειοθετήθηκε από το πρωτότυπο στις 28 August 2021. https://web.archive.org/web/20210828194146/https://patient.info/doctor/hypotension. Ανακτήθηκε στις 26 June 2015.
- ↑ «Octreotide for treating chylothorax after cardiac surgery». Texas Heart Institute Journal 32 (3): 437–9. 2005. PMID 16392238.
- ↑ «Spontaneous neonatal chylothorax treated with octreotide». Journal of Paediatrics and Child Health 42 (1–2): 65–7. 2006. doi:. PMID 16487393.
- ↑ «Postoperative chylothorax after cardiothoracic surgery in children». The Annals of Thoracic Surgery 80 (5): 1864–70. November 2005. doi:. PMID 16242470. https://archive.org/details/sim_annals-of-thoracic-surgery_2005-11_80_5/page/1864.
- ↑ «Octreotide: a therapeutic option for idiopathic intracranial hypertension». Neurology, Neurophysiology, and Neuroscience: 1. July 2007. PMID 17700925.
- ↑ 28,0 28,1 28,2 28,3 «Octreotide therapy of pediatric hypothalamic obesity: a double-blind, placebo-controlled trial». The Journal of Clinical Endocrinology and Metabolism 88 (6): 2586–92. June 2003. doi:. PMID 12788859.
- ↑ «Obesity wars: molecular progress confronts an expanding epidemic». Cell 116 (2): 337–50. January 2004. doi:. PMID 14744442.
- ↑ Boulpaep, Emile L.· Boron, Walter F. (2003). Medical physiologya: A cellular and molecular approach. Philadelphia: Saunders. σελ. 1227. ISBN 978-0-7216-3256-8.
- ↑ «Hypothalamic obesity after craniopharyngioma: mechanisms, diagnosis, and treatment». Frontiers in Endocrinology 2: 60. 2011. doi:. PMID 22654817.
- ↑ «A multicenter, randomized, double-blind, placebo-controlled, dose-finding trial of a long-acting formulation of octreotide in promoting weight loss in obese adults with insulin hypersecretion». International Journal of Obesity 30 (2): 331–41. February 2006. doi:. PMID 16158082.