Αιθυλομεθυλαιθέρας
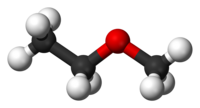
Ο αιθυλομεθυλαιθέρας (EthylMethylEther, EME) ή μεθυξυαιθάνιο ή αιθυλομεθυλοξείδιο είναι οργανική ένωση με μοριακό τύπο C3H8O και ημισυντακτικό τύπο CH3CH2OCH3, που γράφεται επίσης συντομογραφικά EtOMe. Πιο συγκεκριμένα, ανήκει στους αιθέρες. Η χημικά καθαρή ένωση, στις κανονικές συνθήκες περιβάλλοντος (θερμοκρασία 25 °C, πίεση 1 atm), είναι άχρωμο αέριο. Έχει τα ακόλουθα δύο (2) ισομερή θέσης:
- 1-προπανόλη με σύντομο συντακτικό τύπο CH3CH2CH2OH.
- 2-προπανόλη ή ισοπροπανόλη με σύντομο συντακτικό τύπο CH3CH(OH)CH3.
| Αιθυλομεθυλαιθέρας | |||
|---|---|---|---|
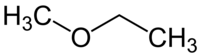
| |||
| |||
| Γενικά | |||
| Όνομα IUPAC | Μεθοξυαιθάνιο | ||
| Άλλες ονομασίες | Αιθυλομεθυλαιθέρας Αιθυλομεθυλοξείδιο | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | C3H8O | ||
| Μοριακή μάζα | 60,1 amu | ||
| Σύντομος συντακτικός τύπος |
CH3CH2OCH3 | ||
| Συντομογραφίες | EtΟMe, EME | ||
| Αριθμός CAS | 540-67-0 | ||
| SMILES | CCOC | ||
| PubChem CID | 10903 | ||
| Δομή | |||
| Ισομέρεια | |||
| Ισομερή θέσης | 2 Προπανόλη-1 Προπανόλη-2 | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | -139 °C | ||
| Σημείο βρασμού | 7,6 °C | ||
| Ιξώδες | 0,224 cP (25 °C) | ||
| Εμφάνιση | Άχρωμο αέριο | ||
| Χημικές ιδιότητες | |||
| Επικινδυνότητα | |||

| |||
| Εξαιρετικά εύφλεκτος (F+) | |||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Παραγωγή
ΕπεξεργασίαΑλκυλίωση αλκολικού άλατος
ΕπεξεργασίαΜπορεί να παραχθεί με αιθυλίωση μεθανολικού άλατος (π.χ. CH3ONa) με αλαιθάνιο (CH3CH2X) ή μεθυλίωση αιθανολικού άλατος (π.χ. CH3CH2ONa) με αλομεθάνιο (CH3X) [1]:
ή
Χημικές ιδιότητες και παράγωγα
ΕπεξεργασίαΩς βάση κατά Λιούις, μπορεί να αντιδρά με οξέα κατά Λιούις σχηματίζοντας άλατα, ενώ αντιδρά βίαια με οξειδωτικά μέσα.
Οξείδωση
ΕπεξεργασίαΥπό την επίδραση φωτός (hv) και ατμοσφαιρικού οξυγόνου σχηματίζει ασταθή και εκρηκτικά υπεροξείδια[2], κυρίως 1-μεθοξυαιθυλυδροϋπεροξείδιο:
Επίδραση οξέων
ΕπεξεργασίαΜε τη επίδραση οξέων, κλασσικών ή κατά Lewis παράγει διάφορα οξώνια, δηλαδή ασταθή και πολύ δραστικά παράγωγα του τρισθενή O+[3]:
Υδρόλυση
Επεξεργασία1. Με επίδραση νερού, σε όξινο περιβάλλον, υδρολύεται προς ισομοριακό μείγμα μεθανόλης κσι αιθανόλης[4]:
2. Με επίδραση ψυχρού υδροϊωδίου (HI) παράγεται σχεδόν ισομοριακό μείγμα μεθανόλης, ιωδομεθανίου, αιθανόλης και ιωδαιθανίου:
3. Με επίδραση θερμού υδροϊωδίου (HI) παράγεται ισομοριακό μείγμα ιωδομεθανίου, ιωδαιθανίου και νερού:
Μετάθεση Wittig
ΕπεξεργασίαΜε επίδραση αλκυλολιθίου (π.χ. μεθυλολιθίου) έχουμε τη μετάθεση Wittig, με την οποία παράγεται 2-προπανόλη και αλκάνιο (μεθάνιο αν είχε χρησιμοποιηθεί μεθυλολίθιο)[5]:
Επίδραση καρβενίων
ΕπεξεργασίαΜε παρεμβολή μεθυλενίου, παράγεται μεθυλοπροπυλαιθέρας, διαιθυλαιθέρας και ισοπροπυλομεθυλαιθέρας[6]:
Θέματα ασφαλείας
ΕπεξεργασίαΕίναι εξαιρετικά εύφλεκτος και η εισπνοή του μπορεί να προκαλέσει ασφυξία ή ζάλη.
Αναφορές και σημειώσεις
Επεξεργασία- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.198, §8.3.1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.200, §8.5.1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.200, §8.5.2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.201, §8.5.3.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.201, §8.5.4.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 155, §6.7.3, R = CH3CH2OCH2.
Πηγές
Επεξεργασία- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
- Δημήτριου Ν. Νικολαΐδη: Ειδικά μαθήματα Οργανικής Χημείας, Θεσσαλονίκη 1983.