Γλυοξάλη
Η γλυοξάλη ή αιθανοδιάλη (αγγλικά: glyoxal) είναι οργανική χημική ένωση, που περιέχει άνθρακα, οξυγόνο και υδρογόνο, με μοριακό τύπο C2H2O2, αν και συχνά γράφεται πιο αναλυτικά ως HCOCHO. Είναι η απλούστερη διάλη, δηλαδή αλδεΰδη με δυο αλδεϋδομάδες (-CHO). Η (πραγματική μοριακή) δομή της είναι πιο πολύπλοκη από ότι δείχνει ο απλός ημισυντακτικός της τύπος, γιατί σχηματίζονται υδρίτες και ολιγομερή. Παράγεται βιομηχανικά και είναι πρόδρομη ένωση για πολλά προϊόντα[1]. Η χημικά καθαρή γλυοξάλη, στις κανονικές συνθήκες περιβάλλοντος, δηλαδή σε θερμοκρασία 25°C και υπό πίεση 1 atm, είναι κίτρινο υγρό, που όταν εξατμίζεται δίνει ένα πράσινο αέριο.
| Γλυοξάλη | |||
|---|---|---|---|
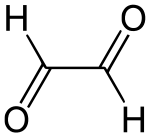
| |||

| |||
| Γενικά | |||
| Όνομα IUPAC | Αιθανοδιάλη | ||
| Άλλες ονομασίες | Γλυοξάλη | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | C2H2O2 | ||
| Μοριακή μάζα | 58,04 amu | ||
| Σύντομος συντακτικός τύπος |
HCOCHO | ||
| Αριθμός CAS | 107-22-2 | ||
| SMILES | C(=O)C=O | ||
| InChI | 1S/C2H2O2/c3-1-2-4/h1-2H | ||
| PubChem CID | 7860 | ||
| ChemSpider ID | 7572 | ||
| Ισομέρεια | |||
| Ισομερή θέσης | 7 | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | 15°C | ||
| Σημείο βρασμού | 51°C | ||
| Πυκνότητα | 1270 kg/m³ | ||
| Χημικές ιδιότητες | |||
| Ελάχιστη θερμοκρασία ανάφλεξης |
-4°C | ||
| Επικινδυνότητα | |||
| Κίνδυνοι κατά NFPA 704 |
|||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Φυσική παρουσία
ΕπεξεργασίαΗ γλυοξάλη είναι μια ερεθιστική ένωση που σχηματίζονται όταν μαγειρικά έλαια και λίπη θερμαίνονται σε υψηλές θερμοκρασίες.
Η γλυοξάλη έχει παρατηρηθεί ως ιχναέριο στην ατμόσφαιρα, για παράδειγμα ως παραπροϊόν οξείδωσης υδρογονανθράκων[2]. Οι τροποσφαιρικές συγκεντρώσεις της κυμαίνονται σε 0-200 ppt, αλλά έχουν αναφερθεί και συγκεντρώσεις ως 1 ppb, σε ρυπασμένες περιοχές[3].
Παραγωγή
Επεξεργασία
Βιομηχανικά η γλυοξάλη παράγεται είτε με την οξείδωση αιθένιου, στην αέρια φάση, (αρχικά) σε 1,2-αιθανοδιόλη, παρουσία αργύρου ή χαλκού, ως καταλύτη (διεργασία Λαπόρτ, Laporte process), είτε με οξείδωση αιθανάλης με νιτρικό οξύ, στην υγρή φάση[1]. Η ονομαστική ετήσια παγκόσμια παραγωγική χωρητικότητα για τη γλυοξάλη ανέρχεται σε περίπου 220.000 τόνους, με μικρότερη (πραγματική) ετήσια παραγωγή, εξαιτίας υπερχωρητικότητας παραγωγής, κυρίως στην Ασία. Η περισσότερη παραγωγή γίνεται με τη μέθοδο της οξείδωσης στην αέρια φάση.
Η πρώτη μονάδα βιομηχανικής παραγωγής άρχισε τη λειτουργία της στη Λαμότ, στη Γαλλία, το 1960. Η μεγαλύτερη μονάδα παραγωγής είναι της BASF, στο Λουντβιχσχάφεν της Γερμανίας, με ετήσια παραγωγή 60.000 τόνους. Άλλες μονάδες παραγωγής υπάρχουν επίσης στις ΗΠΑ και στην Κίνα. Η εμπορική γλυοξάλη παράγεται ως υδατικό της διάλυμα 40%.
Η γλυοξάλη μπορεί να συνθεθεί εργαστηριακά με οξείδωση αιθανάλης από σεληνώδες οξύ (H2SeO3)[4]. Η σύνθεση άνυδρης γλυοξάλης εμπλέκει θέρμανση στερεού υδρίτη της με πεντοξείδιο του φωσφόρου (P2O5) και συμπύκνωση των σχηματιζόμενων ατμών γλυοξάλης με ψυκτική παγίδα[5].
Εφαρμογές
ΕπεξεργασίαΤο επικαλυμένο χαρτί και το φινίρισμα υφασμάτων χρησιμοποιούν μεγάλες ποσότητες γλυοξάλης. Συμπυκνώνεται με την ουρία, σχηματίζοντας 4,5-διυδροξυ-2-ιμιδαζολιδινόνη, που με αντίδραση με μεθανάλη δίνει δι(υδροξυμεθυλο) παράγωγα που χρησιμοποιούνται για την αποφυγη τσαλακώματος σε υφάσματα. Επίσης χρησιμοποιήθηκε ως διαλυτοποιητής και μέσο διασύνδεσης στη χημεία πολυμερών:
- πρωτεΐνες (βυρσοδεψία)
- κολλαγόνο
- παράγωγα κυτταρίνης (υφάσματα)
- υδροκολλοειδή
- άμυλο (επικάλυψη χαρτιού)
Η γλυοξάλη είναι μια πολύτιμη συνθετική μονάδα σε αντιδράσεις οργανικής σύνθεσης, ειδικότερα για τη σύνθεση ετεροκυκλικών ενώσεων, όπως ιμιδαζολών[6]. Μια βολική για εργαστηριακή χρήση μορφή του αντιδραστηρίου είναι η διημιακετάλη με 1,2-αιθανοδιόλη, δηλαδή η 1,4-διοξαν-2,3-διόλη. Αυτή η ένωση είναι εμπορικά διαθέσιμη.
Διαλύματα γλυοξάλης χρησιμοποιήθηκαν στην ιστολογία, με μια μέθοδο που διατηρεί κύτταρα για μικροσκοπική εξέταση.
Διαλύματα
ΕπεξεργασίαΗ γλυοξάλη παράγεται τυπικά ως υδατικό διάλυμα 40%. Όπως και οι άλλες (σχετικά) μικρού μοριακού βάρους αλδεΰδες, η γλυοξάλη σχηματίζει υδρίτες. Επιπλέον, οι υδρίτες αυτοί συμπυκνώνονται δίνοντας μια σειρά από ολιγομερή, με δομές μη επιβεβαιωμένες. Αλλά για τις περισσότερες εφαρμογές, η ακριβής φύση των χημικών ειδών που σχηματίζονται σε διαλύματά της είναι χωρίς πρακτική σημασία. Τουλάχιστον δυο υδρίτες της γλυοξάλης πωλούνται εμπορικά:
- Διμερής γλυοξάλη, με τύπο [(CHO)2]2[H2O]2, και συστηματική ονομασία 1,4-διοξαν-trans-2,3-διόλη (με CAS# 4845-50-5 και σημείο τήξης 91-95°C.
- Τριμερής γλυοξάλη, με τύπο [(CHO)2]3(H2O)2 (CAS# 4405-13-4).
Εκτιμήθηκε ότι σε συγκεντρώσεις κάτω από 1 M, η γλυοξάλη κυριαρχεί ως μονομερής ή ως υδρίτης, δηλαδή με τύπους HCOCHO, HCOCH(OH)2 και (HO)2CHCH(OH)2. Σε συγκεντρώσεις πάνω από 1 M, η γλυοξάλη κυριαρχεί ως διμερή. Αυτά τα διμερή είναι πιθανότατα διοξολάνια, με τύπο [(HO)CH]2O2CHCHO[7]. Διμερή και τριμερή μπορούν να συνυπάρχουν.
Πηγές
Επεξεργασία- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
- Δημήτριου Ν. Νικολαΐδη: Ειδικά μαθήματα Οργανικής Χημείας, Θεσσαλονίκη 1983.
Αναφορές και σημειώσεις
Επεξεργασία- ↑ 1,0 1,1 Georges Mattioda, Alain Blanc, "Glyoxal" in Ullmann's Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH, Weinheim. doi:10.1002/14356007.a12 491
- ↑ M. Vrekoussis, F. Wittrock, A. Richter, J. P. Burrows: Temporal and spatial variability of glyoxal as observed from space. In: Atmos. Chem. Phys. 2009, 9, S. 4485–4504 (Abstract).
- ↑ Volkamer, Rainer, et al. "A missing sink for gas‐phase glyoxal in Mexico City: Formation of secondary organic aerosol." Geophysical Research Letters 34.19 (2007).
- ↑ Ronzio, A. R.; Waugh, T. D. (1944). "Glyoxal Bisulfite". Org. Synth. 24: 61.; Coll. Vol. 3, p. 438
- ↑ Harries, C.; Temme, F. (1907). "Über monomolekulares und trimolekulares Glyoxal". Berichte 40 (1): 165–172. doi:10.1002/cber.19070400124.
Man erhitzt nun das Glyoxal-Phosphorpentoxyd-Gemisch mit freier Flamme und beobachtet bald, dass sich unter Schwarzfärbung des Kolbeninhalte ein flüchtiges grünes Gas bildet, welches sich in der gekühlten Vorlage zu schönen Krystallen von gelber Farbe kondensiert. (One heats the mixture of (crude) glyoxal and P4O10 with an open flame and soon observes that, upon blackening of the contents, a mobile green gas, which condenses in the cooled flask as beautiful yellow crystals)
- ↑ Snyder, H. R.; Handrick, R. G.; Brooks, L. A. (1942). "Imidazole". Org. Synth. 22: 65.; Coll. Vol. 3, p. 471
- ↑ Whipple, E. B. (1970). "Structure of Glyoxal in Water". J. Am. Chem. Soc. 92 (24): 7183–7186. doi:10.1021/ja00727a027.
