Γαλακταλδεΰδη
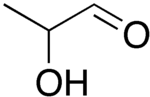
Η γαλακταλδεΰδη ή 2-υδροξυπροπανάλη ή 2-υδροξυπροπιοναλδεΰδη ή γαλακτική αλδεΰδη) (αγγλικά: lactaldehyde) είναι οργανική χημική ένωση, που βρίσκεται σε δυο οπτικά ισομερή και περιέχει άνθρακα, οξυγόνο και υδρογόνο, με μοριακό τύπο C3H6O2, αν και συχνά γράφεται πιο αναλυτικά ως CH3CH(OH)CHO. Η μεθυλογλυοξάλη μετατρέπεται σε D-γαλακταλδεΰδη από τη δεϋδρογονάση της γλυκερόλης (gldA). Μετά η γαλακταλδεΰδη μετατρέπεται σε γαλακτικό οξύ από τη δεϋδρογονάση των αλδεϋδών[1].
| Γαλακταλδεΰδη | |||
|---|---|---|---|
| |||

| |||
| Γενικά | |||
| Όνομα IUPAC | 2-υδροξυπροπανάλη | ||
| Άλλες ονομασίες | Γαλακταλδεΰδη Γαλακτική αλδεΰδη Υδροξυπροπιοναλδεΰδη | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | C3H6O2 | ||
| Μοριακή μάζα | 74,08 amu | ||
| Σύντομος συντακτικός τύπος |
CH3CH(OH)CHO | ||
| Αριθμός CAS | 598-35-6 3946-09-6 (R) 3913-64-2 (S) | ||
| SMILES | O=CC(O)C | ||
| InChI | 1S/C3H6O2/c1-3(5)2-4/h2-3,5H,1H3 | ||
| PubChem CID | 855 | ||
| ChemSpider ID | 832 | ||
| Ισομέρεια | |||
| Φυσικές ιδιότητες | |||
| Χημικές ιδιότητες | |||
| Επικινδυνότητα | |||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Η γαλακταλδεΰδη υπάρχει σε αρκετές μορφές: Στη μορφή ανοικτής αλυσίδας, ως κυκλική ημιακετάλη, σε διαλύματα, σε κρυσταλλικές μορφές, ως μονομερές και ως διμερές. Στην κρυσταλλική μορφή υπάρχουν τρία (3) συνμορφομερή ως ημιακεταλικά διμερή με σκελετό δακτυλίου 1,4-διοξάνιου:


Στη χημική ισορροπία διαλύματος υπάρχει αμελητέα ποσότητα του μονομερούς και τουλάχιστον ένα διμερές με πενταμελή δακτύλιο.
Παραγωγή
ΕπεξεργασίαΜε έμμεση μερική αναγωγή γαλακτικού οξέος
Επεξεργασία1. Αρχικά το γαλακτικό οξύ μετατρέπεται σε 2-υδροξυπροπανοϋλοχλωρίδιο[2]:
2. Το 2-υδροξυπροπανοϋλοχλωρίδιο ανάγεται καταλυτικά άμεσα προς γαλακταλδεΰδη:
Χημικές ιδιότητες και παράγωγα
ΕπεξεργασίαΗ γαλακταλδεΰδη συνδυάζει τις ιδιότητες αλδεΰδης και αλκοόλης.
Ιδιότητες αλδεΰδης
ΕπεξεργασίαΑναγωγή προς 1,2-προπανοδιόλη
Επεξεργασία1. Με λιθιοαργιλιοϋδρίδιο (LiAlH4):
2. Με καταλυτική υδρογόνωση:
Αναγωγή προς 2-προπανόλη
ΕπεξεργασίαΗ γαλακταλδεΰδη μπορεί να αναχθεί προς 2-προπανόλη με την μεθόδο Wolff-Kishner[3]
Οξείδωση προς πυροσταφυλικό οξύ
ΕπεξεργασίαΗ γαλακταλδεΰδη μπορεί να οξειδωθεί προς πυροσταφυλικό οξύ, με αραιό υπερμαγγανικό κάλιο[4];
Μερική οξείδωση προς γαλακτικό οξύ
ΕπεξεργασίαΗ γαλακταλδεΰδη μπορεί να οξειδωθεί προς γαλακτικό οξύ[4];
1. Με τριοξείδιο του χρωμίου:
2. Με οξυγόνο:
3. Με αντιδραστήριο Tollens (αμμωνιακό διάλυμα νιτρικού αργύρου):
4. Με αντιδραστήρια Fehling:
- Οι αντιδράσεις 3-4 παρουσιάζονται απλοποιημένες και χρησιμοποιούνται γενικά για την ανίχνευση αλδεϋδομάδας (-CHO).
Προσθήκη ύδατος
ΕπεξεργασίαΜε προσθήκη ύδατος σε γαλακταλδεΰδη παράγεται, σε χημική ισορροπία, η μη απομονώσιμη ασταθής 1,1,2-προπανοτριόλη[5]:
Αντιδράσεις με αζωτούχες ενώσεις
ΕπεξεργασίαΗ γαλακταλδεΰδη αντιδρά με αρκετά είδη αζωτούχων ενώσεων του γενικού τύπου NH2A, όπου το A μπορεί να είναι υδρογόνο, αλκύλιο, υδροξύλιο, αμινοξάδα και διάφορα άλλα. Με βάση το γενικό τύπο η γενική αντίδραση είναι η ακόλουθη[6]:
- Μερικά σχετικά παραδείγματα αμέσως παρακάτω:
1. Με αμμωνία παράγεται 1-ιμιν-2-προπανόλη. Προκύπτει από την παραπάνω γενική με A = H:
2. Με πρωτοταγείς αμίνες (RNH2) παράγεται Ν-αλκυλο-1-ιμιν-2-προπανόλη. Προκύπτει από την παραπάνω γενική με A = R:
3. Με υδροξυλαμίνη παράγεται 1-(υδροξυλιμιν)-2-προπανόλη. Προκύπτει από την παραπάνω γενική με A = OH:
4. Με υδραζίνη παράγεται αρχικά 1-υδραζο-2-προπανόλη και με περίσσεια μεθανάλης δι(1-υδροξυλ-2-προπυλιδεν)αζίνη. Προκύπτει από την παραπάνω γενική με A = NH2:
5. Με φαινυλυδραζίνη παράγεται (1-φαινυλυδραζ)-2-προπανόλη. Προκύπτει από την παραπάνω γενική με A = NHPh:
6. Με υδραζινομεθαναμίδιο παράγεται [(2-υδροξυλπροπυλιδεν)υδραζο]μεθαναμίνη. Προκύπτει από την παραπάνω γενική με A = NHCONH2:
Συμπύκνωση με δευτεροταγείς αμίνες
ΕπεξεργασίαΜε επίδραση δευτεροταγούς αμίνης (RNHR') σε γαλακταλδεΰδη παράγεται 2-(αλκυλιμινο)-2-προπανόλη[7]:
Αλδολική συμπύκνωση
ΕπεξεργασίαΜε επίδραση βάσης σε γαλακταλδεΰδη έχουμε τη λεγόμενη αλδολική συμπύκνωση, η οποία όταν γίνεται με τον εαυτό της, παράγεται 2-μεθυλο-2,3,4-τριυδροξυπεντανάλη[8]:
Συμπύκνωση με «ενεργές» μεθυλενομάδες
ΕπεξεργασίαΜε την επίδραση «ενεργών» μεθυλενομάδων, δηλαδή ενώσεων του γενικού τύπου XCH2Y, όπου X,Y ηλεκτραρνητικές ομάδες όπως π.χ. κυανομάδα (CN), καρβαλκοξυομάδα (COOR), σε γαλακταλδεΰδη έχουμε την αντίδραση Knoevenagel[9]:
Επίδραση φωσφοροϋλιδίων
ΕπεξεργασίαΜε επίδραση φωσφοροϋλιδίων [Ph3P+C-(R)R'] έχουμε τη λεγόμενη αντίδραση Wittig, με την οποία παράγεται 4,4-διαλκυλο-3-βουτεν-2-όλη[10]:
Προσθήκη διαφόρων πυρηνόφιλων αντιδραστηρίων
ΕπεξεργασίαΕίναι δυνατή η προσθήκη διαφόρων πυρηνόφιλων αντιδραστηρίων στο διπλό δεσμό C=Ο που περιέχει η γαλακταλδεΰδη. Π.χ.:[11]:
1. Με προσθήκη υδροκυανίου παράγεται αρχικά , από το οποίο με υδρόλυση μπορεί να παραχθεί 2,3-διυδροξυπροπανικό οξύ:
2. Με προσθήκη όξινου θειικού νατρίου παράγεται 1,2-διυδροξυαιθανοσουλφονικό οξύ:
3. Με προσθήκη αλκυλομαγνησιοαλογονιδίου (RMgX) παράγεται 2-αλκυλο-1,2-προπανοδιόλη:
4. Με προσθήκη στο καρβονύλιο και υποκατάσταση του υδροξυλίου σε γαλακταλδεΰδη από πενταχλωριούχου φωσφόρου παράγεται 1,1,2-τριχλωροπροπάνιο:
Επίδραση υδραζωτικού οξέος
ΕπεξεργασίαΜε επίδραση υδραζωτικού οξέος σε γαλακταλδεΰδη παράγεται 2-υδροξυπροπανονιτρίλιο και 2-υδροξυπροπαναμίδιο[12]:
Προσθήκη αλκοολών
ΕπεξεργασίαΜε προσθήκη αλκοόλης (ROH) σε γαλακταλδεΰδη παράγεται αρχικά 1-αλκοξυ-1,2-προπανοδιόλη και έπειτα, με περίσσεια αλκοόλης 2,2-διαλκοξυ-2-προπανόλη[13]:
Αντίδραση Stracker
ΕπεξεργασίαΜε επίδραση υδροκυανίου (HCN) και αμμωνίας (NH3) σε γαλακταλδεΰδη παράγεται αρχικά 2-αμινο-3-υδροξυβουτονιτρίλιο και στη συνέχεια, με υδρόλυση, θρεονίνη[14]:
Φωτοχημική προσθήκη σε αλκένια
ΕπεξεργασίαΜε επίδραση μεθανάλης σε αιθένιο σχηματίζεται φωτοχημικά 2-(1-υδροξυαιθυλ)οξετάνιο (Αντίδραση Paterno–Büchi)[15][16]:
2-(1-υδροξυαιθυλ)οξετάνιο
Ιδιότητες αλκοόλης
ΕπεξεργασίαΑλκοολικά άλατα
Επεξεργασία1. Αντίδραση με αλκαλιμέταλλα[17]:
2. Αντίδραση με αμίδια μετάλλων[18]::
Διαμοριακή αφυδάτωση
ΕπεξεργασίαΜε διαμοριακή αφυδάτωση παράγεται 2-(μεθυλοφορμυλομεθυλο)προπανάλη[19]:
Ενδομοριακή αφυδάτωση
ΕπεξεργασίαΜε ενδομοριακή αφυδάτωση παράγεται (κυρίως) προπενάλη[20]:
Καρβοξυλικοί εστέρες
ΕπεξεργασίαΑντίδραση με ακυλιωτικά μέσα: 1. Εστεροποίηση με καρβοξυλικό οξύ[21]:
- Πρόκειται για μέθοδο «προστασίας» της υδροξυλομάδας.
2. Εστεροποίηση με ανυδρίτη καρβοξυλικού οξέος[22]:
3. Εστεροποίηση με ακυλαλογονίδιο[23]:
Επίδραση καρβενίων
ΕπεξεργασίαΠαρεμβολή καρβενίων, π.χ. με μεθυλενίου σε γαλακταλδεΰδη παράγονται 2-υδροξυβουτανάλη, 2-μεθυλο-2-υδροξυπροπανάλη, 2-μεθοξυπροπανάλη, 3-υδροξυβουτανόνη και 1-υδροξυαιθυλοξιράνιο[24]:
1-υδροξυαιθυλοξιράνιο
Πηγές
Επεξεργασία- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
- Δημήτριου Ν. Νικολαΐδη: Ειδικά μαθήματα Οργανικής Χημείας, Θεσσαλονίκη 1983.
Αναφορές και σημειώσεις
Επεξεργασία- ↑ Huang PC, Miller ON (1958). "The metabolism of lactaldehyde, page 205" (PDF). J. Biol. Chem. 231 (1): 201–5. PMID 13538961.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.216, §9.2.3.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.218, §9.5.3α.
- ↑ 4,0 4,1 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.221, §9.6.1,2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.218, §9.5.5α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.218-219, §9.5.6.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.219, §9.5.7.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.219, §9.5.8.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.219, §9.5.9.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.219, §9.5.11.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.220, §9.5.12.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.220, §9.5.15.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.221, §9.6.3.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 329, §14.2.2.
- ↑ E. Paterno, G. Chieffi (1909). «.». Gazz. Chim. Ital. 39: 341.
- ↑ G. Büchi, Charles G. Inman, and E. S. Lipinsky (1954). «Light-catalyzed Organic Reactions. I. The Reaction of Carbonyl Compounds with 2-Methyl-2-butene in the Presence of Ultraviolet Light». Journal of the American Chemical Society 76 (17): 4327–4331. doi:.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.199, §8.2.4α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.199, §8.2.4β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.199, §8.4.5β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.153, §6.3.3.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.199, §8.4.4α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.199, §8.4.4β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.199, §8.4.4γ.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 155, §6.7.3.