Μονοκλωνικό αντίσωμα
Ένα μονοκλωνικό αντίσωμα (mAb ή moAb) είναι αντίσωμα που κατασκευάζεται με κλωνοποίηση ενός μοναδικού λευκού αιμοσφαιρίου. Όλα τα επακόλουθα αντισώματα που προέρχονται με αυτόν τον τρόπο εντοπίζονται σε ένα μοναδικό γονικό κύτταρο.
Τα μονοκλωνικά αντισώματα μπορούν να έχουν μονοσθενή συγγένεια, που συνδέονται μόνο με τον ίδιο επίτοπο (το τμήμα ενός αντιγόνου που αναγνωρίζεται από το αντίσωμα). Αντιθέτως, τα πολυκλωνικά αντισώματα δεσμεύονται σε πολλαπλούς επίτοπους και συνήθως παράγονται από διάφορες διαφορετικές σειρές κυττάρων πλάσματος που εκκρίνουν αντίσωμα. Τα διειδικά μονοκλωνικά αντισώματα μπορούν επίσης να κατασκευαστούν, αυξάνοντας τους θεραπευτικούς στόχους ενός μόνο μονοκλωνικού αντισώματος σε δύο επίτοπους.
Είναι δυνατή η παραγωγή μονοκλωνικών αντισωμάτων που συνδέονται ειδικά με σχεδόν οποιαδήποτε κατάλληλη ουσία. Στη συνέχεια μπορούν να χρησιμεύσουν για τον εντοπισμό ή τον καθαρισμό. Αυτή η ικανότητα έχει γίνει ένα σημαντικό εργαλείο στη βιοχημεία, τη μοριακή βιολογία και την ιατρική.
Ιστορία
ΕπεξεργασίαΟ ρόλος που έχουν τα μονοκλωνικά αντισώματα περιγράφηκε για πρώτη φορά από τον ανοσολόγο του 20ού αιώνα Πάουλ Έρλιχ του 20ου αιώνα, ο οποίος πρότεινε την ιδέα ενός ιατρικού Zauberkugel, μιας « μαγικής σφαίρας ». Αυτό θα μπορούσε να είναι μια ένωση που θα μπορούσε να κατασκευαστεί για να στοχεύσει επιλεκτικά έναν οργανισμό που προκαλεί ασθένειες, η οποία θα επέτρεπε να παραδοθεί μια τοξίνη για αυτόν τον οργανισμό μαζί της. Αυτός και ο Ίλια Μέτσνικοφ έλαβαν το βραβείο Νόμπελ Φυσιολογίας ή Ιατρικής του 1908 για αυτό το έργο.
Στη δεκαετία του 1970, ήταν γνωστό το πολλαπλό μυέλωμα από καρκινικά Β-κύτταρα. Κατανοήθηκε ότι αυτά τα καρκινικά Β-κύτταρα παράγουν όλα έναν μοναδικό τύπο αντισώματος (μια παραπρωτεΐνη ). Αυτό χρησιμοποιήθηκε για τη μελέτη της δομής των αντισωμάτων, αλλά δεν ήταν ακόμη δυνατό να παραχθούν πανομοιότυπα αντισώματα ειδικά για ένα δεδομένο αντιγόνο.[3] :324
Η παραγωγή μονοκλωνικών αντισωμάτων με υβριδικά κύτταρα ανθρώπου-ποντικού περιγράφηκε για πρώτη φορά από τον Τζέρολντ Σβάμπερ το 1973.[4] Αυτό το έργο παραμένει ευρέως αναφερόμενο σε αυτούς που χρησιμοποιούν υβριδώματα που προέρχονται από τον άνθρωπο.[5]
Το 1975, οι Γκέοργκ Κέλερ και Σέσαρ Μιλστάιν κατάφεραν να δημιουργήσουν συντήξεις κυτταρικών σειρών μυελώματος με Β κύτταρα για να δημιουργήσουν υβριδώματα που θα μπορούσαν να παράγουν αντισώματα, ειδικά για γνωστά αντιγόνα και που αθανατοποιήθηκαν.[6] Αυτοί και ο Νιλς Κάι Γιέρνε μοιράστηκαν το βραβείο Νόμπελ Φυσιολογίας ή Ιατρικής το 1984 για την ανακάλυψη.
Το 1988, ο Γκρεγκ Γουίντερ και η ομάδα του πρωτοστάτησαν στις τεχνικές εξανθρωπισμού μονοκλωνικών αντισωμάτων[7] εξαλείφοντας τις αντιδράσεις που προκάλεσαν πολλά μονοκλωνικά αντισώματα σε ορισμένους ασθενείς.
Το 2018, οι Τζέιμς Π. Άλισον και Τασούκου Χόντζο έλαβαν το βραβείο Νόμπελ Φυσιολογίας ή Ιατρικής για την ανακάλυψη της θεραπείας με καρκίνο με την αναστολή της αρνητικής ανοσολογικής ρύθμισης, χρησιμοποιώντας μονοκλωνικά αντισώματα που αποτρέπουν τους ανασταλτικούς δεσμούς.[8]
Παραγωγή
ΕπεξεργασίαΑνάπτυξη υβριδώματος
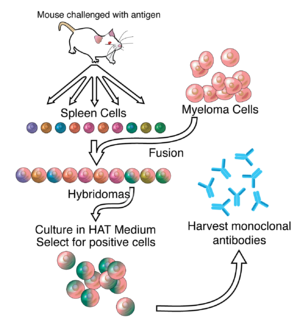
ΕπεξεργασίαΜεγάλο μέρος της εργασίας πίσω από την παραγωγή μονοκλωνικών αντισωμάτων βασίζεται στην παραγωγή υβριδωμάτων, η οποία περιλαμβάνει την ταυτοποίηση ειδικών για τα αντιγόνα κυττάρων πλάσματος / πλασμαβλαστών (ASPCs) που παράγουν αντισώματα ειδικά για ένα αντιγόνο ενδιαφέροντος και τη σύντηξη αυτών των κυττάρων με κύτταρα μυελώματος.[6] Τα κύτταρα Β κουνελιού μπορούν να χρησιμοποιηθούν για το σχηματισμό υβριδώματος κουνελιού. Η πολυαιθυλενογλυκόλη χρησιμοποιείται για την τήξη γειτονικών μεμβρανών πλάσματος,[9] αλλά το ποσοστό επιτυχίας είναι χαμηλό, επομένως χρησιμοποιείται ένα επιλεκτικό μέσο στο οποίο μπορούν να αναπτυχθούν μόνο συγχωνευμένα κύτταρα. Αυτό είναι εφικτό επειδή τα κύτταρα μυελώματος έχουν χάσει την ικανότητα να συνθέσουν υποξανθίνη-γουανίνη-φωσφοριβοσυλ τρανσφεράση (HGPRT), ένα ένζυμο απαραίτητο για τη σύνθεση διάσωσης νουκλεϊκών οξέων. Η απουσία HGPRT δεν αποτελεί πρόβλημα για αυτά τα κύτταρα εκτός εάν διαταραχθεί επίσης η οδός σύνθεσης της de novo πουρίνης. Η έκθεση των κυττάρων σε αμινοπτερίνη (ένα ανάλογο φυλλικού οξέος, το οποίο αναστέλλει τη διυδροφολική αναγωγάση, DHFR), τα καθιστά ανίκανα να χρησιμοποιήσουν το de novo μονοπάτι και να γίνουν πλήρως αυξοτροφικά για τα νουκλεϊκά οξέα, απαιτώντας έτσι συμπλήρωση για να επιβιώσουν.
Το εκλεκτικό μέσο καλλιέργειας ονομάζεται μέσο ΗΑΤ επειδή περιέχει υποξανθίνη, αμινοπτερίνη και θυμιδίνη. Αυτό το μέσο είναι επιλεκτικό για συντηγμένα κύτταρα (υβρίδωμα). Τα μη χρησιμοποιημένα κύτταρα μυελώματος δεν μπορούν να αναπτυχθούν επειδή δεν έχουν HGPRT και έτσι δεν μπορούν να αναπαραγάγουν το DNA τους. Τα μη συντηγμένα κύτταρα σπλήνας δεν μπορούν να αναπτυχθούν επ 'αόριστον λόγω της περιορισμένης διάρκειας ζωής τους. Μόνο τα συγχωνευμένα υβριδικά κύτταρα που αναφέρονται ως υβριδώματα, είναι σε θέση να αναπτυχθούν επ 'αόριστον στο μέσο, επειδή το συνοδό κύτταρο σπλήνας παρέχει HGPRT και ο συνοδός μυελώματος έχει χαρακτηριστικά που το καθιστούν αθάνατο (παρομοίως με ένα καρκινικό κύτταρο).
Τα υβριδώματα μπορούν να αναπτυχθούν επ 'αόριστον σε κατάλληλο μέσο κυτταρικής καλλιέργειας. Μπορούν επίσης να ενίονται σε ποντίκια (στην περιτοναϊκή κοιλότητα, γύρω από το έντερο). Εκεί, παράγουν όγκους που εκκρίνουν ένα πλούσιο σε αντίσωμα υγρό που ονομάζεται ασκίτης.
Το μέσο πρέπει να εμπλουτιστεί κατά την in vitro επιλογή για να ευνοηθεί περαιτέρω η ανάπτυξη υβριδώματος. Αυτό μπορεί να επιτευχθεί με τη χρήση στρώματος τροφοδοτικών κυττάρων ινοκυττάρων ή συμπληρωματικού μέσου όπως βρικλόνη. Μπορούν να χρησιμοποιηθούν μέσα καλλιέργειας που ρυθμίζονται από μακροφάγα. Η παραγωγή σε κυτταρική καλλιέργεια προτιμάται συνήθως καθώς η τεχνική ασκίτη είναι επώδυνη για το ζώο. Όπου υπάρχουν εναλλακτικές τεχνικές, ο ασκίτης θεωρείται ανήθικος.[10]
Νέα τεχνολογία ανάπτυξης mAb
ΕπεξεργασίαΑρκετές τεχνολογίες μονοκλωνικών αντισωμάτων έχουν αναπτυχθεί πρόσφατα,[11] όπως παρουσίαση φάγου,[12] καλλιέργεια μεμονωμένων κυττάρων Β,[13] ενίσχυση μεμονωμένων κυττάρων από διάφορους πληθυσμούς Β κυττάρων[14][15][16][17][18] και τεχνολογίες ανάκρισης μεμονωμένων κυττάρων πλάσματος. Διαφορετικά από την παραδοσιακή τεχνολογία υβριδώματος, οι νεότερες τεχνολογίες χρησιμοποιούν τεχνικές μοριακής βιολογίας για να ενισχύσουν τις βαριές και ελαφριές αλυσίδες των γονιδίων αντισωμάτων με PCR και να παράγουν είτε σε βακτηριακά είτε σε θηλαστικά συστήματα με ανασυνδυασμένη τεχνολογία. Ένα από τα πλεονεκτήματα των νέων τεχνολογιών ισχύει για πολλά ζώα, όπως κουνέλι, λάμα, κοτόπουλο και άλλα κοινά πειραματόζωα στο εργαστήριο.
Κάθαρση
ΕπεξεργασίαΑφού ληφθεί είτε ένα δείγμα μέσων καλλιεργημένων υβριδωμάτων είτε ένα δείγμα υγρού ασκίτη, τα επιθυμητά αντισώματα πρέπει να εκχυλιστούν. Οι μολυσματικές ουσίες κυτταρικής καλλιέργειας αποτελούνται κυρίως από συστατικά μέσων όπως παράγοντες ανάπτυξης, ορμόνες και τρανσφερίνες. Αντιθέτως, το in νiνο δείγμα είναι πιθανό να έχει αντισώματα ξενιστή, πρωτεάσες, νουκλεάσες, νουκλεϊκά οξέα και ιούς. Και στις δύο περιπτώσεις, ενδέχεται να υπάρχουν και άλλες εκκρίσεις από τα υβριδώματα όπως οι κυτοκίνες. Μπορεί επίσης να υπάρχει βακτηριακή μόλυνση και, ως αποτέλεσμα, ενδοτοξίνες που εκκρίνονται από τα βακτήρια. Ανάλογα με την πολυπλοκότητα των μέσων που απαιτούνται στην κυτταρική καλλιέργεια και συνεπώς τους μολυσματικούς παράγοντες, μπορεί να προτιμάται η μία ή η άλλη μέθοδος (in vivo ή in vitro).
Το δείγμα πρώτα ρυθμίζεται ή προετοιμάζεται για καθαρισμό. Τα κύτταρα, τα συντρίμμια των κυττάρων, τα λιπίδια και το πήγμα του υλικού απομακρύνονται πρώτα, συνήθως με φυγοκέντρηση ακολουθούμενη από διήθηση με 0,45 φίλτρο μm. Αυτά τα μεγάλα σωματίδια μπορούν να προκαλέσουν ένα φαινόμενο που ονομάζεται ρύπανση μεμβράνης σε μεταγενέστερα στάδια καθαρισμού. Επιπλέον, η συγκέντρωση του προϊόντος στο δείγμα μπορεί να μην είναι επαρκής, ειδικά σε περιπτώσεις όπου το επιθυμητό αντίσωμα παράγεται από μια κυτταρική σειρά χαμηλής έκκρισης. Το δείγμα συνεπώς συμπυκνώνεται με υπερδιήθηση ή αντίστροφη ώσμωση.
Οι περισσότερες από τις φορτισμένες ακαθαρσίες είναι συνήθως ανιόντα όπως νουκλεϊκά οξέα και ενδοτοξίνες. Αυτές μπορούν να διαχωριστούν με χρωματογραφία ανταλλαγής ιόντων.[19] Είτε χρησιμοποιείται χρωματογραφία ανταλλαγής κατιόντων σε αρκετά χαμηλό pΗ ώστε το επιθυμητό αντίσωμα να δεσμεύεται στη στήλη, ενώ τα ανιόντα ρέουν διαμέσου, ή χρωματογραφία ανταλλαγής ανιόντων χρησιμοποιείται σε αρκετά υψηλό pΗ όπου το επιθυμητό αντίσωμα ρέει διαμέσου της στήλης, ενώ τα ανιόντα προσδένονται σε αυτή. Διάφορες πρωτεΐνες μπορούν επίσης να διαχωριστούν μαζί με τα ανιόντα με βάση το ισοηλεκτρικό τους σημείο (pI). Στις πρωτεΐνες, το ισοηλεκτρικό σημείο (ρΙ) ορίζεται ως το pΗ στο οποίο μια πρωτεΐνη δεν έχει καθαρό φορτίο. Όταν το pH> pI, μια πρωτεΐνη έχει καθαρό αρνητικό φορτίο, και όταν το pH <pI, μια πρωτεΐνη έχει καθαρό θετικό φορτίο. Για παράδειγμα, η αλβουμίνη έχει pI 4,8, το οποίο είναι σημαντικά χαμηλότερο από αυτό των περισσότερων μονοκλωνικών αντισωμάτων, τα οποία έχουν pΙ 6.1. Έτσι, σε pΗ μεταξύ 4,8 και 6,1, το μέσο φορτίο των μορίων αλβουμίνης είναι πιθανό να είναι πιο αρνητικό, ενώ τα μόρια mAbs είναι θετικά φορτισμένα και ως εκ τούτου είναι δυνατόν να τα διαχωριστούν. Η τρανσφερίνη, από την άλλη πλευρά, έχει pI 5,9, οπότε δεν μπορεί εύκολα να διαχωριστεί με αυτήν τη μέθοδο. Απαιτείται διαφορά στο pI τουλάχιστον 1 για καλό διαχωρισμό.
Η τρανσφερίνη μπορεί αντ 'αυτού να αφαιρεθεί με χρωματογραφία αποκλεισμού μεγέθους. Αυτή η μέθοδος είναι μία από τις πιο αξιόπιστες τεχνικές χρωματογραφίας. Δεδομένου ότι ασχολούμαστε με πρωτεΐνες, ιδιότητες όπως το φορτίο και η συγγένεια δεν είναι συνεπείς και ποικίλλουν με το pΗ καθώς τα μόρια είναι πρωτονιωμένα και αποπρωτονιωμένα, ενώ το μέγεθος παραμένει σχετικά σταθερό. Ωστόσο, έχει μειονεκτήματα όπως χαμηλή ανάλυση, χαμηλή χωρητικότητα και χαμηλούς χρόνους έκλουσης.
Μια πολύ ταχύτερη μέθοδος διαχωρισμού ενός σταδίου είναι η χρωματογραφία συγγένειας πρωτεΐνης A/G. Το αντίσωμα συνδέεται επιλεκτικά με την πρωτεΐνη Α/G, έτσι λαμβάνεται υψηλό επίπεδο καθαρότητας (γενικά> 80%). Ωστόσο, αυτή η μέθοδος μπορεί να είναι προβληματική για αντισώματα που καταστρέφονται εύκολα, καθώς γενικά χρησιμοποιούνται αντίοξεες συνθήκες. Το χαμηλό pΗ μπορεί να σπάσει τους δεσμούς για να αφαιρέσει το αντίσωμα από τη στήλη. Εκτός από το ενδεχόμενο να επηρεάσει το προϊόν, το χαμηλό pH μπορεί να προκαλέσει διαρροή από την στήλη της πρωτεΐνης A/G και να εμφανιστεί στο εκλουόμενο δείγμα. Διατίθενται ρυθμιστικά συστήματα απαλής έκλουσης που χρησιμοποιούν υψηλές συγκεντρώσεις άλατος για την αποφυγή έκθεσης ευαίσθητων αντισωμάτων σε χαμηλό ρΗ. Το κόστος πρέπει να ληφθεί υπόψιν με αυτήν τη μέθοδο, επειδή η ακινητοποιημένη πρωτεΐνη A / G είναι μια πιο ακριβή ρητίνη.
Ετερογένεια αντισωμάτων
ΕπεξεργασίαΗ χρωματογραφία μετατόπισης έχει χρησιμοποιηθεί για τον εντοπισμό και τον χαρακτηρισμό αυτών των συχνά αόρατων παραλλαγών σε ποσότητες που είναι κατάλληλες για επακόλουθα σχήματα προκλινικής αξιολόγησης όπως φαρμακοκινητικές μελέτες σε ζώα.[20][21] Η γνώση που αποκτήθηκε κατά τη φάση της προκλινικής ανάπτυξης είναι ζωτικής σημασίας για την καλύτερη κατανόηση της ποιότητας των προϊόντων και παρέχει μια βάση για τη διαχείριση κινδύνων και αυξημένη ρυθμιστική ευελιξία. Η πρόσφατη πρωτοβουλία της Υπηρεσίας Τροφίμων και Φαρμάκων (FDA) Quality by Design προσπαθεί να παρέχει καθοδήγηση σχετικά με την ανάπτυξη και να διευκολύνει το σχεδιασμό προϊόντων και διαδικασιών που μεγιστοποιούν την αποτελεσματικότητα και το προφίλ ασφάλειας, ενώ παράλληλα ενισχύουν την κατασκευαστικότητα του προϊόντος.[22]
Ανασυνδυασμός
ΕπεξεργασίαΗ παραγωγή ανασυνδυασμένων μονοκλωνικών αντισωμάτων περιλαμβάνει κλωνοποίηση ρεπερτορίου, CRISPR/Cas9 ή τεχνολογίες εμφάνισης φάγου/ζύμης.[23] Η ανασυνδυασμένη μηχανική αντισωμάτων συνεπάγεται παραγωγή αντισωμάτων με τη χρήση ιών ή ζύμης, αντί για ποντίκια. Αυτές οι τεχνικές βασίζονται στην ταχεία κλωνοποίηση των τμημάτων γονιδίου ανοσοσφαιρίνης για τη δημιουργία βιβλιοθηκών αντισωμάτων με ελαφρώς διαφορετική αμινοξέος αλληλουχίες από τις οποίες μπορούν να επιλεγούν αντισώματα με επιθυμητές ειδικότητες.[24] Οι βιβλιοθήκες αντισωμάτων φάγου είναι μια παραλλαγή βιβλιοθηκών αντιγόνου φάγου.[25] Αυτές οι τεχνικές μπορούν να χρησιμοποιηθούν για την ενίσχυση της ειδικότητας με την οποία τα αντισώματα αναγνωρίζουν τα αντιγόνα, τη σταθερότητά τους σε διάφορες περιβαλλοντικές καταστάσεις, τη θεραπευτική αποτελεσματικότητά τους και την ανιχνευσιμότητα τους σε διαγνωστικές εφαρμογές.[26] Οι θάλαμοι ζύμωσης έχουν χρησιμοποιηθεί για παραγωγή αντισωμάτων μεγάλης κλίμακας.
Χιμαιρικά αντισώματα
ΕπεξεργασίαΕνώ τα αντισώματα ποντικού και ανθρώπου είναι δομικά παρόμοια, οι διαφορές μεταξύ τους ήταν αρκετές για να προκαλέσουν ανοσοαπόκριση όταν εγχύθηκαν μονοκλωνικά αντισώματα ποντικού σε ανθρώπους, με αποτέλεσμα την ταχεία απομάκρυνσή τους από το αίμα, καθώς και συστημικές φλεγμονώδεις επιδράσεις και την παραγωγή ανθρώπινων αντι-αντισωμάτων ποντικού (HAMA).
Το ανασυνδυασμένο DNA έχει διερευνηθεί από τα τέλη της δεκαετίας του 1980 για να αυξήσει τους χρόνους παραμονής. Σε μία προσέγγιση, το DNA ποντικού που κωδικοποιεί το τμήμα δέσμευσης ενός μονοκλωνικού αντισώματος συγχωνεύθηκε με DNA που παράγει ανθρώπινα αντισώματα σε ζωντανά κύτταρα. Η έκφραση αυτού του «χιμαιρικού» ή «εξανθρωπισμένου» DNA μέσω κυτταρικής καλλιέργειας έδωσε αντισώματα εν μέρει ποντικού και εν μέρει ανθρώπου.[27][28]
Ανθρώπινα αντισώματα
ΕπεξεργασίαΑπό την ανακάλυψη ότι μπορούσαν να δημιουργηθούν μονοκλωνικά αντισώματα, οι επιστήμονες έχουν στοχεύσει στη δημιουργία πλήρως ανθρώπινων προϊόντων για τη μείωση των παρενεργειών εξανθρωπισμένων ή χιμαιρικών αντισωμάτων. Έχουν εντοπιστεί αρκετές επιτυχημένες προσεγγίσεις: διαγονιδιακά ποντίκια,[29] παρουσίαση φάγου[12] και κλωνοποίηση απλών Β κυττάρων:[11]
Από το Νοέμβριο 2016 δεκατρία των δεκαεννέα πλήρως ανθρώπινων θεραπευτικών μονοκλωνικών αντισωμάτων στην αγορά προήλθαν από τεχνολογία διαγονιδιακών ποντικών.
Εφαρμογές
ΕπεξεργασίαΔιαγνωστικά τεστ
ΕπεξεργασίαΜόλις παραχθούν μονοκλωνικά αντισώματα για μια δεδομένη ουσία, μπορούν να χρησιμοποιηθούν για την ανίχνευση της παρουσίας αυτής της ουσίας. Πρωτεΐνες μπορεί να ανιχνευθεί χρησιμοποιώντας η Western blot και ανοσολογική δοκιμασία κηλίδας. Στην ανοσοϊστοχημεία, τα μονοκλωνικά αντισώματα μπορούν να χρησιμοποιηθούν για την ανίχνευση αντιγόνων σε τμήματα σταθερού ιστού, και παρομοίως, μπορεί να χρησιμοποιηθεί ανοσοφθορισμός για την ανίχνευση μιας ουσίας είτε σε τμήμα κατεψυγμένου ιστού είτε σε ζωντανά κύτταρα.
Αναλυτικές και χημικές χρήσεις
ΕπεξεργασίαΤα αντισώματα μπορούν επίσης να χρησιμοποιηθούν για τον καθαρισμό των ενώσεων στόχων τους από μίγματα, χρησιμοποιώντας τη μέθοδο ανοσοκαθίζησης.
Θεραπευτικές χρήσεις
ΕπεξεργασίαΤα θεραπευτικά μονοκλωνικά αντισώματα δρουν μέσω πολλαπλών μηχανισμών, όπως ο αποκλεισμός των στοχευμένων μοριακών λειτουργιών, προκαλώντας απόπτωση σε κύτταρα που εκφράζουν τον στόχο, ή με διαμόρφωση οδών σηματοδότησης.[30][31]
Μία πιθανή θεραπεία για τον καρκίνο περιλαμβάνει μονοκλωνικά αντισώματα που συνδέονται μόνο με αντιγόνα ειδικά στα καρκινικά κύτταρα και προκαλούν ανοσοαπόκριση έναντι του καρκινικού κυττάρου στόχου. Τέτοια mAbs μπορούν να τροποποιηθούν για απελευθέρωση τοξίνης, ραδιοϊσότοπου, κυτοκίνης ή άλλου δραστικού συζεύγματος ή για το σχεδιασμό διειδικών αντισωμάτων που μπορούν να συνδεθούν με τις περιοχές Fab τους τόσο στο αντιγόνο στόχευσης όσο και σε ένα συζυγές ή κύτταρο τελεστή. Κάθε άθικτο αντίσωμα μπορεί να συνδεθεί με κυτταρικούς υποδοχείς ή άλλες πρωτεΐνες με την περιοχή Fc του.
Τα μονοκλωνικά αντισώματα που έχουν εγκριθεί από το FDA για καρκίνο περιλαμβάνουν:[32]
Τα μονοκλωνικά αντισώματα που χρησιμοποιούνται για αυτοάνοσες ασθένειες περιλαμβάνουν την ινφλιξιμάμπη και την ανταλιμουμάμπη, οι οποίες είναι αποτελεσματικές στη ρευματοειδή αρθρίτιδα, τη νόσο του Crohn, την ελκώδη κολίτιδα και την αγκυλοποιητική σπονδυλίτιδα λόγω της ικανότητάς τους να συνδέονται και να αναστέλλουν τον TNF-α.[33] Η μπασιλιξιμάμπη και η δακλιζουμπάμπη αναστέλλουν την IL-2 σε ενεργοποιημένα Τ κύτταρα και έτσι βοηθούν στην πρόληψη της οξείας απόρριψης των μεταμοσχεύσεων νεφρού. Η ομαλιζουμάμπη αναστέλλει την ανθρώπινη ανοσοσφαιρίνη Ε (IgE) και είναι χρήσιμη στη θεραπεία μέτριου έως σοβαρού αλλεργικού άσθματος.
Παρενέργειες
ΕπεξεργασίαΑρκετά μονοκλωνικά αντισώματα, όπως η μπεβασιζουμάμπη και το Cetuximab, μπορούν να προκαλέσουν διαφορετικά είδη παρενεργειών.[34] Αυτές οι ανεπιθύμητες ενέργειες μπορούν να ταξινομηθούν σε συχνές και σοβαρές παρενέργειες.[35]
Μερικές συχνές ανεπιθύμητες ενέργειες περιλαμβάνουν:
Μεταξύ των πιθανών σοβαρών παρενεργειών είναι:
- Αναφυλαξία
- Αιμορραγία
- Αρτηριακοί και φλεβικοί θρόμβοι
- Αυτοάνοση θυροειδίτιδα
- Υποθυρεοειδισμός
- Ηπατήτιδα
- Καρδιακή ανεπάρκεια
- Καρκίνος
- Αναιμία
- Μείωση των λευκών αιμοσφαιρίων
- Στοματίτιδα
- Εντεροκολίτιδα
- Γαστρεντερική διάτρηση
- Βλεννογονίτιδα[36]
Παραπομπές
Επεξεργασία- ↑ «Cytochrome P450 Mediated Drug and Carcinogen Metabolism using Monoclonal Antibodies». home.ccr.cancer.gov. Ανακτήθηκε στις 2 Απριλίου 2018.
- ↑ «Inhibitory monoclonal antibodies to human cytochrome P450 enzymes: a new avenue for drug discovery». Trends in Pharmacological Sciences 20 (11): 432–8. November 1999. doi:. PMID 10542439. http://www.cell.com/trends/pharmacological-sciences/comments/S0165-6147(99)01382-6.
- ↑ «Monoclonal antibodies: a witness seminar in contemporary medical history». Medical History 38 (3): 322–7. July 1994. doi:. PMID 7934322.
- ↑ «Human x mouse somatic cell hybrid clone secreting immunoglobulins of both parental types». Nature 244 (5416): 444–7. August 1973. doi:. PMID 4200460.
- ↑ «Between fact and technique: the beginnings of hybridoma technology». Journal of the History of Biology 25 (2): 175–230. 1992. doi:. PMID 11623041.
- ↑ 6,0 6,1 Marks, LV. «The Story of César Milstein and Monoclonal Antibodies». WhatisBiotechnology.org. Ανακτήθηκε στις 23 Σεπτεμβρίου 2020.
- ↑ «Reshaping human antibodies for therapy». Nature 332 (6162): 323–7. March 1988. doi:. PMID 3127726. Bibcode: 1988Natur.332..323R.
- ↑ «A Nobel Prize-worthy pursuit: cancer immunology and harnessing immunity to tumour neoantigens». Immunology 155 (3): 283–284. November 2018. doi:. PMID 30320408.
- ↑ Yang J1, Shen MH. Polyethylene glycol-mediated cell fusion. Methods Mol Biol. 2006; 325:59-66.
- ↑ National Research Council (US) Committee on Methods of Producing Monoclonal Antibodies. Recommendation 1: Executive Summary: Monoclonal Antibody Production. Washington (DC): National Academies Press (US); 1999. (ISBN 978-0-309-07511-4)
- ↑ 11,0 11,1 11,2 «Inaugural Editorial: Searching for Magic Bullets». Antibody Therapeutics 1 (1): 1–5. June 2018. doi:. PMID 30101214.
- ↑ 12,0 12,1 «A novel high-affinity human monoclonal antibody to mesothelin». International Journal of Cancer 128 (9): 2020–30. May 2011. doi:. PMID 20635390.
- ↑ «A robust high throughput platform to generate functional recombinant monoclonal antibodies using rabbit B cells from peripheral blood». PLOS ONE 9 (2): e86184. 2014. doi:. PMID 24503933. Bibcode: 2014PLoSO...986184S.
- ↑ «Predominant autoantibody production by early human B cell precursors». Science 301 (5638): 1374–7. September 2003. doi:. PMID 12920303. Bibcode: 2003Sci...301.1374W.
- ↑ «Mature B cells class switched to IgD are autoreactive in healthy individuals». The Journal of Clinical Investigation 117 (6): 1558–65. June 2007. doi:. PMID 17510706. PMC 1866247. https://archive.org/details/sim_journal-of-clinical-investigation_2007-06_117_6/page/1558.
- ↑ «Rapid generation of fully human monoclonal antibodies specific to a vaccinating antigen». Nature Protocols 4 (3): 372–84. 2009-01-01. doi:. PMID 19247287.
- ↑ «Functional anergy in a subpopulation of naive B cells from healthy humans that express autoreactive immunoglobulin receptors». The Journal of Experimental Medicine 206 (1): 139–51. January 2009. doi:. PMID 19103878.
- ↑ «Isolation of human monoclonal antibodies from peripheral blood B cells». Nature Protocols 8 (10): 1907–15. October 2013. doi:. PMID 24030440.
- ↑ «Heterogeneity of monoclonal antibodies revealed by charge-sensitive methods». Current Pharmaceutical Biotechnology 9 (6): 468–81. December 2008. doi:. PMID 19075686.
- ↑ «Charge variants in IgG1: Isolation, characterization, in vitro binding properties and pharmacokinetics in rats». mAbs 2 (6): 613–24. 2010. doi:. PMID 20818176. PMC 3011216. http://www.landesbioscience.com/journals/mabs/abstract.php?id=13333.
- ↑ «Isolation and characterization of therapeutic antibody charge variants using cation exchange displacement chromatography». Journal of Chromatography A 1218 (31): 5079–86. August 2011. doi:. PMID 21700290.
- ↑ «Quality by design for biopharmaceuticals». Nature Biotechnology 27 (1): 26–34. January 2009. doi:. PMID 19131992. https://archive.org/details/sim_nature-biotechnology_2009-01_27_1/page/26.
- ↑ «Functional diversification of hybridoma-produced antibodies by CRISPR/HDR genomic engineering». Science Advances 5 (8): eaaw1822. August 2019. doi:. PMID 31489367.
- ↑ «Recombinant monoclonal antibody technology». Transfusion Clinique et Biologique 9 (1): 15–22. January 2002. doi:. PMID 11889896.
- ↑ «Dr. George Pieczenik». LMB Alumni. MRC Laboratory of Molecular Biology (LMB). 17 Σεπτεμβρίου 2009. Αρχειοθετήθηκε από το πρωτότυπο στις 23 Δεκεμβρίου 2012. Ανακτήθηκε στις 17 Νοεμβρίου 2012.
- ↑ «Phage display: a molecular tool for the generation of antibodies--a review». Placenta 21 Suppl A (Suppl A): S106-12. 2000. doi:. PMID 10831134.
- ↑ «Production of functional chimaeric mouse/human antibody». Nature 312 (5995): 643–6. 1984. doi:. PMID 6095115.
- ↑ «Therapeutic antibody expression technology». Current Opinion in Biotechnology 12 (2): 188–94. April 2001. doi:. PMID 11287236.
- ↑ «Human antibodies from transgenic mice». International Reviews of Immunology 13 (1): 65–93. 1995. doi:. PMID 7494109.
- ↑ «Therapeutic monoclonal antibodies». Lancet 355 (9205): 735–40. February 2000. doi:. PMID 10703815. http://www.thelancet.com/journals/lancet/article/PIIS0140-6736(00)01034-5/fulltext.
- ↑ Australian Prescriber (2006). «Monoclonal antibody therapy for non-malignant disease». Australian Prescriber 29 (5): 130–133. doi:. http://www.australianprescriber.com/magazine/29/5/130/3/#2.
- ↑ Takimoto CH, Calvo E. (January 01, 2005) "Principles of Oncologic Pharmacotherapy" Αρχειοθετήθηκε 2017-07-22 στο Wayback Machine. in Pazdur R, Wagman LD, Camphausen KA, Hoskins WJ (Eds) Cancer Management Αρχειοθετήθηκε 2013-10-04 στο Wayback Machine.
- ↑ Pharmacology. Edinburgh: Churchill Livingstone. 2003. σελίδες 241, for the examples infliximab, basiliximab, abciximab, daclizumab, palivusamab, gemtuzumab, alemtuzumab and rituximab, and mechanism and mode. ISBN 978-0-443-07145-4.
- ↑ «Monoclonal antibodies to treat cancer | American Cancer Society». www.cancer.org. Ανακτήθηκε στις 19 Απριλίου 2018.
- ↑ «Monoclonal antibody drugs for cancer: How they work». Mayo Clinic. https://www.mayoclinic.org/diseases-conditions/cancer/in-depth/monoclonal-antibody/art-20047808. Ανακτήθηκε στις 2018-04-19.
- ↑ 36,0 36,1 «Monoclonal Antibodies: List, Types, Side Effects & FDA Uses (Cancer)». MedicineNet. https://www.medicinenet.com/monoclonal_antibodies/article.htm#what_drugs_or_other_compounds_interact_with_monoclonal_antibodies?. Ανακτήθηκε στις 2018-04-19.