2-μεθυλοκυκλοπροπανόλη
Η 2-μεθυλοκυκλοπροπανόλη είναι ονομασία δύο γεωμετρικά ισομερών κυκλοαλκανολών, δηλαδή κορεσμένων μονοκυκλικών μονοσθενών αλκοολών. Συνήθως αντιπροσωπεύονται από τον τύπο: ![]() . Με βάση το χημικό της τύπο, C4H8Ο έχουν τα ακόλουθα εικοσιπέντε (25) ισομερή:
. Με βάση το χημικό της τύπο, C4H8Ο έχουν τα ακόλουθα εικοσιπέντε (25) ισομερή:
- Βουτεν-1-όλη-1 (ελάσσων ταυτομερές της βουτανάλης) με σύντομο συντακτικό τύπο CH3CH2CH=CHOH.
- Βουτεν-2-όλη-1 ή 3-μεθυλαλλυλική αλκοόλη με σύντομο συντακτικό τύπο CH3CH=CHCH2OH.
- Βουτεν-3-όλη-1 με σύντομο συντακτικό τύπο CH2=CHCH2CH2OH.
- Βουτεν-1-όλη-2 (ελάσσων ταυτομερές της βουτανόνης) με σύντομο συντακτικό τύπο CH3CH2C(OH)=CH2.
- Βουτεν-2-όλη-2 (ελάσσων ταυτομερές της βουτανόνης) με σύντομο συντακτικό τύπο CH3CH=C(OH)CH3.
- Βουτεν-3-όλη-2 με σύντομο συντακτικό τύπο CH2=CHCH(OH)CH3.
- Μεθυλοπροπεν-1-όλη (ελάσσων ταυτομερές της μεθυλοπροπανάλης) με σύντομο συντακτικό τύπο (CH3)2C=CHOH.
- Μεθυλοπροπεν-2-όλη ή 2-μεθυλαλλυλική αλκοόλη με σύντομο συντακτικό τύπο CH2=C(CH3)CH2OH.
- Αιθυλοβινυλαιθέρας ή αιθοξυαιθένιο με σύντομο συντακτικό τύπο CH3CH2OCH=CH2.
- Μεθυλοπροπεν-1-υλαιθέρας ή 1-μεθοξυπροπένιο με σύντομο συντακτικό τύπο CH3OCH=CHCH3.
- Μεθυλοπροπεν-2-υλαιθέρας ή 3-μεθοξυπροπένιο με σύντομο συντακτικό τύπο CH3OCH2CH=CH2.
- Μεθυλο(μεθυλοβινυλ)αιθέρας ή 2-μεθοξυπροπένιο με σύντομο συντακτικό τύπο CH3OC(CH3)=CH2.
- Βουτανάλη (κύριο ταυτομερές) της βουτεν-1-όλης-1 με σύντομο συντακτικό τύπο CH3CH2CH2CHO.
- Μεθυλοπροπανάλη (κύριο ταυτομερές) της μεθυλοπροπεν-1-όλης με σύντομο συντακτικό τύπο (CH3)2CHCHO.
- Βουτανόνη (κύριο ταυτομερές) της βουτεν-2-όλης-2 και της βουτεν-3-όλης-2) με σύντομο συντακτικό τύπο CH3CH2COCH3.
- Μεθυλοκυκλοβουτανόλη με σύντομο συντακτικό τύπο
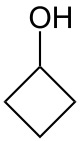 .
. - 1-μεθυλοκυκλοπροπανόλη με σύντομο συντακτικό τύπο
 .
. - Κυκλοπροπυλομεθανόλη με σύντομο συντακτικό τύπο
 .
. - Κυκλοπροπυλομεθυλαιθέρας με σύντομο συντακτικό τύπο
 .
. - Οξολάνιο με σύντομο συντακτικό τύπο
 .
. - 2-μεθυλοξετάνιο με σύντομο συντακτικό τύπο
 .
. - 3-μεθυλοξετάνιο με σύντομο συντακτικό τύπο
 .
. - Αιθυλοξιράνιο με σύντομο συντακτικό τύπο
 .
. - 2,2-διμεθυλοξιράνιο με σύντομο συντακτικό τύπο
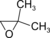 .
. - 2,3-διμεθυλοξιράνιο με σύντομο συντακτικό τύπο
 .
.
| 2-μεθυλοκυκλοπροπανόλη | |
|---|---|

| |
| Γενικά | |
| Όνομα IUPAC | 2-μεθυλοκυκλοπροπανόλη |
| Χημικά αναγνωριστικά | |
| Χημικός τύπος | C4H8O |
| Μοριακή μάζα | 72,11 amu[1] |
| Σύντομος συντακτικός τύπος |
|
| SMILES | OC1C(C)C1 |
| Δομή | |
| Ισομέρεια | |
| Ισομερή θέσης | 25 |
| Γεωμετρικά ισομερή | 2 |
| Φυσικές ιδιότητες | |
| Χημικές ιδιότητες | |
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |
Κυκλοπροπάνια
Επεξεργασία«Κυκλοπροπάνια» ονομάζονται τα κυκλοαλκάνια με τριμελή δακτύλιο, που αποτελεί και το χαρακτηριστικό της δομής τους. Οι πλευρικές αλυσίδες, όταν υπάρχουν, διαμορφώνονται όπως στα αλκάνια. Το ιδιαίτερο χαρακτηριστικό της μοριακής δομής τους είναι η εμφάνιση γωνίας δεσμού που είναι η συνηθισμένη γωνία δεσμού sp3-sp3 που αντιστοιχεί σε κορεσμένο. Ύστερα από ενεργειακή ανάλυση των πιθανών δομών - μοριακών μοντέλων με κβαντομηχανικές μεθόδους προέκυψε ως πιθανότερη η εκδοχή του sp2 υβριδισμού και της δημιουργίας δύο μοριακών τροχιακών τριών κέντρων (των τριών ατόμων C), σ (2sp2-2sp2-2sp2) και π (2p-2p-2p), με 3 ηλεκτρόνια ανά μοριακό τροχιακό, ώστε να χρησιμοποιηθούν τα 6 διαθέσιμα ηλεκτρόνια των 3 ατόμων C (τα άλλα 6 χρησιμοποούνται για τους 6 σ δεσμούς με τα 6 άτομα υδρογόνου ή και τα αλκύλια). Αντί δηλαδή των κλασσικών 3 ομοιοπολικών δεσμών δύο κέντρων μεταξύ των ατόμων C, υπάρχουν 2 ομοιοπολικοί δεσμοί τριών κέντρων[2].
Εξαιτίας αυτού του γεγονότος προκύπτει η λεγόμενη «ενέργεια τάσης δεσμών» που συνυπολογίζει την ενέργεια παραμόρφωσης δεσμικής γωνίας (κατά Baeyer), που οφείλεται στη διαφορά γωνίας από την κανονική, και την ενέργεια στρέψης (κατά Piltzer), που οφείλεται στην αδυναμία του συστήματος να στρέψει τους δεσμούς του και να πάρει διαμόρρφωση αποφυγής των απώσεων τύπου Van der Waals, που αναπτύσσονται από την προσέγγιση αλληλοαπωθούμενων ατόμων και ομάδων αυτών. Ενώ λοιπόν το ισομερές προπένιο έχει θερμότητα ολικής καύσης 1.971 kcal/mole το κυκλοπροπάνιο έχει 2.088 kcal/mole. Το ΔQ = 117 kJ/mole αντιστοιχεί ακριβώς στην επιπλέον ενέργεια που παγιδεύει η ιδιάζουσα δομή του τριμελή δακτυλίου[3]. Αποτέλεσμα των παραπάνω είναι τα κυκλοπροπάνια να δείνουν αντιδράσεις προσθηκοδιάσπασης-1,3.
Σε σύγκριση με το κυκλοπροπάνιο, η 2-μεθυλοκυκλοπροπανόλη έχει ένα μεθύλιο (CH3) και ένα υδροξύλιο (OH), αντί δύο ατόμων υδρογόνου, ενωμένα στο άτομα άνθρακα #2 και #1, αντίστοιχα[4].
Παραγωγή
ΕπεξεργασίαΑπό 1,3-διαλοβουτανόλη-2
ΕπεξεργασίαΜε επίδραση ψευδαργύρου σε 1,3-διαλοβουτανόλη-2 παράγεται 2-μεθυλοκυκλοπροπανόλη, με ενδομοριακή αντίδραση Wurtz [5]:
Από 1-αλο-2-μεθυλοκυκλοπροπάνιο
Επεξεργασία1. Με επίδραση διαλύματος υδροξειδίου του αργύρου σε 1-αλο-2-μεθυλοκυκλοπροπάνιο παράγεται 2-μεθυλοκυκλοπροπανόλη[6]:
2. Με επίδραση διαλύματος αιθανικού νατρίου σε 1-αλο-1-μεθυλοκυκλοπροπάνιο παράγεται αρχικά αιθανικός 1'-μεθυλοκυκλοπροπυλεστέρας, που στη συνέχεια υδρολύεται σχηματίζοντας 1-μεθυλοκυκλοπροπανόλη [7]:
Από 2-μεθυλοκυκλοπροπανόνη
ΕπεξεργασίαΜε αναγωγή 2-μεθυλοκυκλοπροπανόνης:
1. Με καταλυτική υδρογόνωση[8]:
2. Με λιθιοαργιλιοϋδρίδιο (LiAlH4)[9]:
Από 3-μεθυλοκυκλοπροπένιο
ΕπεξεργασίαΜε προσθήκη νερού σε 3-μεθυλοκυκλοπροπένιο παράγεται 3-μεθυλοκυκλοπροπανόλη[10]:
Από 2-μεθυλοκυκλοπροπαναμίνη
ΕπεξεργασίαΜε επίδραση νιτρώδους οξέος σε 2-μεθυλοκυκλοπροπαναμίνη παράγεται 2-μεθυλοκυκλοπροπανόλη [11]:
Από 2-μεθυλοκυκλοπροπυλομεθανόλη
ΕπεξεργασίαΜε αποικοδόμιση της ανθρακικής αλυσίδας της 2-μεθυλοκυκλοπροπυλομεθανόλης[12]::
Χημικές ιδιότητες και παράγωγα
ΕπεξεργασίαΑλκοολικά άλατα
Επεξεργασία1. Αντίδραση με αλκαλιμέταλλα[13]:
2. Αντίδραση με αμίδια μετάλλων[14]:
3. Αντίδραση με αιθινικά μέταλλα[15]:
4. Αντίδραση με αντιδραστήρια Grignard[16]:
- Ενδεικτική σειρά οξύτητας ορισμένων ενώσεων: νερό (H2O) > 2-μεθυλοκυκλοπροπανόλη ( ) > αιθίνιο (HC ≡ CH) > αμμωνία (NH3) > μεθάνιο (CH4).
Υποκατάσταση από αλογόνα
Επεξεργασία1. Αντίδραση με υδροϊώδιο[17]:
2. Αντίδραση με άλλα υδραλογόνα (X: F, Cl, Br)[18]:
3. Αντίδραση με ισχυρά χλωριωτικά μέσα[19]:
- 1. Με πενταχλωριούχο φωσφόρο (PCl5):
- 2. Με τριχλωριούχο φωσφόρο (PCl3)[20]:
- Η συγκεκριμένη μέθοδος εφαρμόζεται επίσης για την παραγωγή 1-βρωμο-2-μεθυλοκυκλοπροπάνιου από 2-μεθυλοκυκλοπροπανόλη, με την ανάλογη χρήση του τριβρωμιούχου φωσφόρου.
- 3. Με θειονυλοχλωρίδιο (SOCl2)[21]:
Δι(2-μεθυλοκυκλοπροπυλ)αιθέρας
ΕπεξεργασίαΠαραγωγή δι(2-μεθυλοκυκλοβουτυλ)αιθέρα[22]:
Καρβοξυλικοί εστέρες
ΕπεξεργασίαΑντίδραση με ακυλιωτικά μέσα:
1. Εστεροποίηση με καρβοξυλικό οξύ[23]:
2. Εστεροποίηση με ανυδρίτη καρβοξυλικού οξέος[24]:
3. Εστεροποίηση με ακυλαλογονίδιο[25]:
- Όπου Py: πυριδίνη.
Οξείδωση
ΕπεξεργασίαΜε υπερμαγγανικό κάλιο (KMnO4). Παράγεται 2-μεθυλοκυκλοπροπανόνη[26]:
Ανοικοδόμηση προς 2-μεθυλοκυκλοπροπυλομεθανόλη
ΕπεξεργασίαΥπάρχουν αρκετές δύο (2) μέθοδοι για ανοικοδόμηση 2-μεθυλοκυκλοπροπανόλης προς 2-μεθυλοκυκλοπροπυλομεθανόλη[12]:
Αρχίζουν και οι δύο με την παραγωγή 1-ιωδο-2-μεθυλοκυκλοπροπάνιο και μετά 2-μεθυλοκυκλοπροπυλομεθανονιτρίλιου:
1. Υδρόλυση 2-μεθυλοκυκλοπροπυλομεθανονιτρίλιου προς 2-μεθυλοκυκλοπροπυλομεθανικό οξύ και μετά αναγωγή προς 2-μεθυλοκυκλοπροπυλομεθανόλη:
2. Αναγωγή προς 2-μεθυλοκυκλοπροπυλομεθαναμίνη και μετατροπή της τελευταίας σε 2-μεθυλοκυκλοπροπυλομεθανόλη:
Ανοικοδόμηση προς 2-(2΄-μεθυλοκυκλοπροπυλο)αιθανόλη
ΕπεξεργασίαΑρχίζει με την παραγωγή 1-ιωδο-2-μεθυλοκυκλοπροπάνιο και μετά, με επίδραση οξιρανίου σε 1-ιωδομαγνησιο-2-μεθυλοκυκλοπροπάνιο, παράγεται 2-(2΄-μεθυλοκυκλοπροπυλο)αιθανόλη[12]:
Επίδραση καρβενίων
ΕπεξεργασίαΠαρεμβολή καρβενίων, π.χ. με μεθυλενίου παράγεται ένα μίγμα παραγώγων, με σύνθεση που δίνεται κατά προσέγγιση από τη στοιχειομετρική εξίσωση αμέσως παρακάτω[27]:
- Η αντίδραση είναι ελάχιστα εκλεκτική και αυτό σημαίνει ότι κατά προσέγγιση έχουμε:
- 1. Παρεμβολή στους τρεις (3) δεσμούς CH2-H. Παράγεται 2-αιθυλοκυκλοπροπανόλη.
- 2. Παρεμβολή στους δύο (2) δεσμούς -CH-H: Παράγεται 2,3-διμεθυλοκυκλοπροπανόλη.
- 3. Παρεμβολή στον (1) δεσμό C#1-H. Παράγεται 1,2-διμεθυλοκυκλοπροπανόλη.
- 3. Παρεμβολή στον (1) δεσμό C#2-H. Παράγεται 2,2-διμεθυλοκυκλοπροπανόλη.
- 4. Παρεμβολή στον (1) δεσμό O-H. Παράγεται 1-μεθυξυ-2-μεθυλοκυκλοπροπάνιο.
Αναφορές και σημειώσεις
Επεξεργασία- ↑ Ελλείψει άλλης πηγής χρησιμοποιείθηκε η μοριακή μάζα της ισομερούς βουτανάλης.
- ↑ Ν. Αλεξάνδρου, Γενική Οργανική Χημεία, ΘΕΣΣΑΛΟΝΙΚΗ 1985: Σελ.127-128, §6.2.
- ↑ Ν. Αλεξάνδρου, Γενική Οργανική Χημεία, ΘΕΣΣΑΛΟΝΙΚΗ 1985, Σελ. 125-126, §6.1.
- ↑ Η αρίθμηση αρχίζει από το άτομο άνθρακα που είναι ενωμένο με το υδροξύλιο
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.154, §6.5.Β1
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.197, §8.2.3α
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.197, §8.2.3β
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 218, §9.2.2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 197, §8.2.2α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.197, §8.2.4α
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.198, §8.2.6
- ↑ 12,0 12,1 12,2 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.198, §8.2.7.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.199, §8.2.4α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.199, §8.2.4β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.199, §8.2.4γ.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.199, §8.2.4δ.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.199, §8.4.2β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.199, §8.4.2γ.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.199, §8.4.3α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.199, §8.4.3β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.199, §8.4.3γ.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.199, §8.4.5β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.199, §8.4.4α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.199, §8.4.4β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.199, §8.4.4γ.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.200, §8.4.6α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 155, §6.7.3.
Πηγές
Επεξεργασία- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
- Δημήτριου Ν. Νικολαΐδη: Ειδικά μαθήματα Οργανικής Χημείας, Θεσσαλονίκη 1983.

