Αιθανοϋλοχλωρίδιο
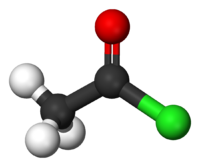
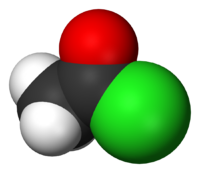
Το αιθανοϋλοχλωρίδιο ή ακετυλοχλωρίδιο με σύντομο συντακτικό τύπο CH3COCl (συντομογραφικά AcCl) είναι ένα ακυλαλογονίδιο, δηλαδή ένα παράγωγο του αιθανικού οξέος. Στην εμφάνιση είναι ένα άχρωμο υγρό. Είναι μια ουσία που δεν έχει βρεθεί στη φύση, γιατί είναι ευαίσθητη στην παρουσία νερού, το οποίο το υδρολύει. Κατά τη χρήση του στον αέρα σχηματίζει ένα λευκό νεφίδιο, λόγω αντίδρασής του με την ατμοσφαιρική υγρασία. Το νεφίδιο αποτελείται από σταγονίδια του υδροχλωρικού οξέος που σχηματίζεται κατά την υδρόλυση. Με βάση το χημικό τύπο του, C2H3OCl, έχει τα ακόλουθα τέσσερα (4) ισομερή θέσης (όχι όλα σταθερά):
- 2-χλωραιθενόλη, με σύντομο συντακτικό τύπο ClCH=CHOH, σε δύο (2) γεωμετρικά ισομερή.
- 1-χλωραιθενόλη, με σύντομο συντακτικό τύπο CH2=C(Cl)OH.
- Χλωραιθανάλη, με σύντομο συντακτικό τύπο ClCH2CHO
- 1,2-εποξυαιθυλοχλωρίδιο ή χλωροξιράνιο.
| Αιθανοϋλοχλωρίδιο | |||
|---|---|---|---|

| |||
| |||
| |||

| |||
| Γενικά | |||
| Όνομα IUPAC | Αιθανοϋλοχλωρίδιο | ||
| Άλλες ονομασίες | Ακετυλοχλωρίδιο | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | C2H3OCl | ||
| Μοριακή μάζα | 78,49 amu | ||
| Σύντομος συντακτικός τύπος |
CH3COCl | ||
| Συντομογραφίες | AcCl | ||
| Αριθμός CAS | 75-36-5 | ||
| SMILES | ClC(=O)C | ||
| InChI | 1S/C2H3ClO/c1-2(3)4/h1H3 | ||
| Αριθμός RTECS | AO6390000 | ||
| Αριθμός UN | QD15RNO45K | ||
| ChemSpider ID | 6127 | ||
| Δομή | |||
| Διπολική ροπή | 2,45 D | ||
| Ισομέρεια | |||
| Ισομερή θέσης | 4 | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | -112 °C | ||
| Σημείο βρασμού | 52 °C | ||
| Πυκνότητα | 1.104 kg/m3 | ||
| Διαλυτότητα στο νερό |
Αντιδρά | ||
| Διαλυτότητα σε άλλους διαλύτες |
χλωράνθρακες, φρεόν | ||
| Εμφάνιση | Άχρωμο υγρό | ||
| Χημικές ιδιότητες | |||
| Σημείο αυτανάφλεξης | 390 °C | ||
| Επικινδυνότητα | |||
 
| |||
| Εύφλεκτο (F), Διαβρωτικό (C) | |||
| Φράσεις κινδύνου | R11 R14 R34 | ||
| Φράσεις ασφαλείας | S(1/2) S9 S16 S26 S45 | ||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Δομή
Επεξεργασία| Δεσμοί[1][2] | ||||
| Δεσμός | τύπος δεσμού | ηλεκτρονική δομή | Μήκος δεσμού | Ιονισμός |
|---|---|---|---|---|
| C#2-H | σ | 2sp3-1s | 109 pm | 3% C- H+ |
| C#1-H | σ | 2sp2-1s | 107 pm | 3% C- H+ |
| C#1-C#2 | σ | 2sp2-2sp3 | 151 pm | |
| C=O | σ | 2sp2-2sp2 | 134 pm | 19% C+ O- |
| π | 2p-2p | |||
| C-Cl | σ | 2sp2-3sp3 | 176 pm | 9% C+ Cl- |
| Στατιστικό ηλεκτρικό φορτίο[3] | ||||
| O | -0,38 | |||
| Cl | -0,09 | |||
| C#2 | -0,09 | |||
| H | +0,03 | |||
| C#1 | +0,47 | |||
Παραγωγή
Επεξεργασία1. Με επίδραση χλωριωτικών μέσων σε αιθανικό οξύ παράγεται αιθανοϋλοχλωρίδιο[4]::
- 1. Με θειονυλοχλωρίδιο (SOCl2):
- 2. Με πενταχλωριούχο φωσφόρο (PCl5):
- 3. Με τριχλωριούχο φωσφόρο PCl3:
2. Με επίδραση αιθανικού νατρίου (CH3COONa) σε βενζοϋλοχλωρίδιο (PhCOCl)[5]
3. Βιομηχανικά παράγεται με επίδραση υδροχλωρίου σε αιθανικό ανυδρίτη[6]:
4. Μπορεί επίσης να συνθεθεί με καταλυτική καρβονυλίωση του μεθυλοχλωρίδιου[7]:
Χημικές ιδιότητες και παράγωγα
ΕπεξεργασίαΥδρόλυση
Επεξεργασία- Με υδρόλυση μετατρέπεται σε αιθανικό οξύ[8]
Αλκοόλυση
Επεξεργασία
Αμμωνιόλυση
ΕπεξεργασίαΜε επίδραση αμμωνίας (NH3) μετατρέπεται σε αιθαναμίδιο[8]:
Αμινόλυση
Επεξεργασία1. Με επίδραση πρωτοταγών αμινών (RNH2) μετατρέπεται σε αιθαναλκυλαμίδιο[8]:
2. Με επίδραση δευτεροταγών αμινών (RNHR΄) μετατρέπεται σε αιθανοδιαλκυλαμίδιο:
Επίδραση καρβονικού άλατος
ΕπεξεργασίαΜε επίδραση αιθανικού νατρίου μετατρέπεται σε ανυδρίτη αιθανικού οξέος[8]:
Επίδραση αρωματικών ενώσεων
ΕπεξεργασίαΑκετυλιώνει αρωματικών ενώσεων κατά Friedel-Crafts. Π.χ. από βενζόλιο παράγεται ακετυλοβενζόλιο[9]:
Παραγωγή οργανομαγνησιακής ένωσης
ΕπεξεργασίαΜε επίδραση μαγνησίου, παρουσία άνυδρου διαιθυλαιθέρα (|Et2O|), παράγεται ακετυλομαγνησιοχλωρίδιο[10]:
Αναγωγή
Επεξεργασία1. Με καταλυτική υδρογόνωση παράγεται αιθανάλη ή και αιθανόλη[11]
2. Με LiAlH4 ή NaBH4 παράγεται απευθείας αιθανόλη[11]::
Επίδραση διαζωμεθανίου
ΕπεξεργασίαΜε επίδραση διαζωμεθανίου παράγεται τελικά προπανικό οξύ[12]:
Σημειώσεις και αναφορές
Επεξεργασία- ↑ Τα δεδομένα προέρχονται εν μέρει από το «Table of periodic properties of thw Ellements», Sagrent-Welch Scientidic Company και Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, Σελ. 34.
- ↑ LeBlanc, Jr., O. H.; Laurie, V. W.; Gwinn, W. D. “Microwave Spectrum, Structure, and Dipole Moment of Formyl Fluoride” The Journal of Chemical Physics 1960, volume 33, pp. 598-600.
- ↑ Υπολογισμένο βάση του ιονισμού από τον παραπάνω πίνακα
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.285, §12.4.8β.
- ↑ Olah, G. A.; Ohannesian, L.; Arvanaghi, M, ”Formylating Agents” Chemical Reviews, 1987, volume 87, pp 671 - 686. DOI: 10.1021/cr00080a001, Cl αντί F.
- ↑ Hosea Cheung, Robin S. Tanke, G. Paul Torrence “Acetic Acid” in Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim.
- ↑ US 4352761
- ↑ 8,0 8,1 8,2 8,3 8,4 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 302, §13.5.1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 302, §13.5.2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 187, §7.3.5, R = CH3CO, X = Cl.
- ↑ 11,0 11,1 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 302, §13.5.3.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 302, §13.5.4.
Πηγές
Επεξεργασία- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
- Δημήτριου Ν. Νικολαΐδη: Ειδικά μαθήματα Οργανικής Χημείας, Θεσσαλονίκη 1983.