Βενζόλιο
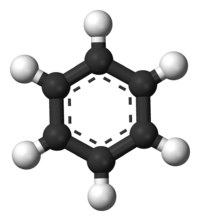
Το βενζόλιο[3] (αγγλικά benzene) είναι οργανική χημική ένωση, που περιέχει άνθρακα και υδρογόνο, με μοριακό τύπο C6H6, αλλά συμβολίζεται συχνά συντομογραφικά ως PhH ή ΦH. Το μόριό του αποτελείται από έξι (6) άτομα άνθρακα, που το καθένα τους συνδέεται με δύο (2) άλλα άτομα άνθρακα, σχηματίζοντας έναν εξαγωνικό δακτύλιο, ενώ ταυτόχρονα κάθε ένα από τα 6 αυτά άτομα άνθρακα συνδέεται και με ένα (1) άτομο υδρογόνου. Εφόσον το μόριό του περιέχει μόνο άτομα υδρογόνου και άνθρακα, το βενζόλιο ταξινομείται στους υδρογονάνθρακες.
| Βενζόλιο | |||
|---|---|---|---|

| |||
| |||
| |||
| |||

| |||
| Γενικά | |||
| Όνομα IUPAC | Βενζένιο | ||
| Άλλες ονομασίες | Βενζόλιο Κυκλοεξατριένιο | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | C6H6 | ||
| Μοριακή μάζα | 78,11 amu | ||
| Συντομογραφίες | PhH, ΦH | ||
| Αριθμός CAS | 71-43-2 | ||
| SMILES | c1ccccc1 C1=CC=CC=C1 | ||
| InChI | 1S/C6H6/c1-2-4-6-5-3-1/h1-6H | ||
| Αριθμός RTECS | CY1400000 | ||
| Αριθμός UN | J64922108F | ||
| PubChem CID | 241 | ||
| ChemSpider ID | 236 | ||
| Δομή | |||
| Διπολική ροπή | 0 D | ||
| Μοριακή γεωμετρία | επίπεδη | ||
| Ισομέρεια | |||
| Ισομερή θέσης | 108 (τουλάχιστον) | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | 5,5°C | ||
| Σημείο βρασμού | 80,1°C | ||
| Πυκνότητα | 876,5 kg/m3 | ||
| Διαλυτότητα στο νερό |
1,8 kg/m3 (15°C) | ||
| Ιξώδες | 0,652 cP (20°C) | ||
| Εμφάνιση | Άχρωμο υγρό | ||
| Χημικές ιδιότητες | |||
| Βαθμός οκτανίου | 99[1] | ||
| Ελάχιστη θερμοκρασία ανάφλεξης |
-11°C | ||
| Σημείο αυτανάφλεξης | 561 °C | ||
| Επικινδυνότητα | |||
 
| |||
| Πολύ Εύφλεκτο (F) Τοξικό (T) | |||
| Φράσεις κινδύνου | R45, R46, R11 R36/38 R48/23/24/25, R65 | ||
| Φράσεις ασφαλείας | S53, S45 | ||
| LD50 | 930 mg/kg[2] | ||
| Κίνδυνοι κατά NFPA 704 |
|||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Το βενζόλιο είναι ένα φυσικό συστατικό του αργού πετρελαίου και ένα από τα πιο θεμελιώδη πετροχημικά προϊόντα. Ειδικότερα, το βενζόλιο είναι αρωματικός υδρογονάνθρακας και το πιο κλασσικό παράδειγμα αρωματικότητας. Ακόμη ειδικότερα είναι το απλούστερο και σπουδαιότερο μέλος της οικογένειας των αρενίων[4], και το δεύτερο n-αννουλένιο (το πρώτο είναι το κυκλοβουταδιένιο), με n = 6, δηλαδή ένας κυκλικός υδρογονάνθρακας με συνεχόμενο π-δεσμό. Το χημικά καθαρό βενζόλιο, στις κανονικές συνθήκες περιβάλλοντος, δηλαδή σε θερμοκρασία 25 °C και υπό πίεση 1 atm, είναι άχρωμο και πολύ εύφλεκτο υγρό, με γλυκιά οσμή. Είναι αναμείξιμο με σχεδόν όλους τους οργανικούς διαλύτες, αλλά είναι δύσκολα και λίγο αναμείξιμο με το νερό. Το ίδιο το βενζόλιο αποτελεί καλό διαλύτη, αλλά η χρήση του για το σκοπό αυτό αποφεύγεται γιατί είναι γνωστό καρκινογόνο και μεταλλαξιογόνο, καθώς το ίδιο και οι μεταβολίτες του είναι δηλητήρια που μπορούν να προκαλέσουν χρωμοσωμικές ανωμαλίες.[5]
Η κύρια εφαρμογή του είναι να χρησιμεύει ως πρόδρομη ένωση άλλων, συνήθως βαρύτερων χημικών προϊόντων, όπως το αιθυλοβενζόλιο, το κουμένιο, το κυκλοεξάνιο και το νιτροβενζόλιο[6]. Η παγκόσμια ετήσια παραγωγή του βενζολίου είναι της τάξης του 1.000.000 τόννων. Ως καύσιμο, σε κινητήρες εσωτερικής καύσης, έχει υψηλό βαθμό οκτανίου (το χημικά καθαρό βενζόλιο ως καύσιμο αντιστοιχεί σε 150 βαθμούς οκτανίου), και γι' αυτό είναι ένα σημαντικό συστατικό της βενζίνης, αν και αποτελεί ένα σχετικά μικρό ποσοστό, της τάξης των λίγων μονάδων τοις εκατό της μάζας της. Πιο συγκεκριμένα, το μέγιστο επιτρεπόμενο ποσοστό του στη βενζίνη στην Ευρωπαϊκή Ένωση, σύμφωνα με το πρότυπο EN 228, είναι 1%.[7] Το ίδιο ισχύει στην Ελβετία[8], ενώ στις ΗΠΑ είναι 5%.[9]
Αυτό συμβαίνει, επίσης, γιατί είναι γνωστό καρκινογόνο, οπότε η συμμετοχή του βενζολίου, τόσο στη βενζίνη, όσο και σε άλλες μη βιομηχανικές εφαρμογές του, να είναι περιορισμένη.
Ισομέρεια θέσης
ΕπεξεργασίαΤο βενζόλιο έχει 108 (τουλάχιστον) ισομερή θέσης, τα σημαντικότερα από τα οποία είναι τα ακόλουθα:
- Βενζβαλένιο, με γραμμικό τύπο: .
- Δικυκλοπροπεν-2-ύλιο, με γραμμικό τύπο: .
- Βενζόλιο Dewar, με γραμμικό τύπο: .
- Φουλβένιο, με γραμμικό τύπο:
- Πρισμάνιο, με γραμμικό τύπο:
- 3-ραδιολένιο, στο οποίο αντιστοιχεί ο ακραίος αριστερός από τους γραμμικούς τύπους: .
Ιστορία
ΕπεξεργασίαΑνακάλυψη
ΕπεξεργασίαΗ λέξη «βενζένιο» προέρχεται ιστορικά από το «βενζαμίν», ένα αρωματικό ρετσίνι που ήταν γνωστό στους Ευρωπαίους φαρμακοποιούς και αρωματοποιούς, τουλάχιστον από τον 15ο αιώνα, ως προϊόν που προέρχονταν από τη Νοτιοανατολική Ασία. Το όνομα αυτό του ρετσινιού αυτού προέρχεται από παραφθορά της αντίστοιχης αραβικής έκφρασης «luban jawi». Το ίδιο προϊόν ονομαζόταν και «λιβάνι της Ιάβας», ονομασία που προέρχεται από την κατά γράμμα μετάφραση στα ελληνικά της παρά πάνω αναφερόμενης αραβικής έκφρασης. Στην πραγματικότητα το όξινο προϊόν που παραλαμβάνονταν από το αντίστοιχο φυτό, με εξάχνωση, ήταν το βενζοϊκό οξύ (PhCOOH), που ονομαζόταν και «άνθος του βενζοΐν», αλλά η ονομασία μεταδόθηκε και στον αντίστοιχο υδρογονάνθρακα, ως «βενζίν», «βενζόλιο» και «βενζένιο»[10].
Στο δεύτερο ήμισυ του 17ου αιώνα, ο Γιόχαν Ρούντολφ Γκλώμπερ (Johann Rudolph Glauber), που ανακάλυψε επίσης το Άλας της Πίστης (Faith salt), ανακάλυψε το βενζόλιο αποστάζοντας λιθανθρακόπισσα. Η σύνθεση τής (νέας για τότε) ένωσης ήταν άγνωστη σε αυτόν, οπότε την ονόμασε «λεπτόρευστο και γλυκό έλαιο» (subtiles und liebliches Oleum).
Το βενζόλιο ήταν το θέμα πολλών ερευνών από διάφορους επιστήμονες, που περιλάμβαναν τους Μάικλ Φαραντέι (Michael Faraday) και Λίνους Πάουλιγκ (Linus Pauling). Ο Μάικλ Φαραντέι το απομόνωσε και το ταυτοποίησε πρώτος το 1825, από το ελαιώδες υπόλειμμα της παραγωγής φωταερίου, δίνοντας στη νέα (τότε) ταυτοποιημένη ένωση αρχικά το όνομα bicarburet of hydrogen, δηλαδή κατά γράμμα «δικαρβίδιο του υδρογόνου»[11][12][13]. Το 1833 ο Έιλχαρντ Μίτσερλριτς (Eilhard Mitscherlich), το παρασκεύασε πρώτος με συναπόσταξη βενζοϊκού οξέος και ασβεστόνερου. Οι αντιδράσεις που χρησιμοποίησε ήταν:
Αργότερα, ήταν αυτός που ονόμασε την ένωση με το όνομα που τελικά επικράτησε, από το ανάλογο μεσαιωνικό προϊόν[14]. Αλλά ήταν ο Γιούστας φον Λίμπιγκ (Justus von Liebig) που χρησιμοποίησε για πρώτη φορά την ονομασία «βενζόλιο» (benzol), το 1834,[15] ενώ λίγο πριν, το 1833, ο Έιλχαρντ Μίτσερλριτς πρότεινε ως ονομασία της ένωσης τον όρο «βενζένιο» (benzene)[16]. Τελικά επικράτησε διπλή ονομασία στις αγγλόφωνες και στις γαλλόφωνες περιοχές.
Το 1836 ο Αυγκούστ Λωρέντ (Auguste Laurent) το ονόμασε «φαίνε» (phène), που αποτελεί ρίζα του ονόματος της φαινόλης (PhOH), που είναι υδροξυλιωμένο παράγωγο του βενζολίου. Η τελευταία ονομασία δεν επικράτησε για το ίδιο το βενζόλιο, αλλά χρησιμοποιήθηκε για την ονομασία της ρίζας Ph- ή C6H5- (φαινύλιο), αλλά και για την παραγωγή του ονόματος της φαινόλης.
Το 1845 ο Τσαρλς Μάνσφιελντ (Charles Mansfield), που εργαζόταν κάτω από τη διεύθυνση του Αύγκουστ Γουΐλελμ φον Χόφφμανν (August Wilhelm von Hofmann), απομόνωσε το βενζόλιο από τη λιθανθρακόπισσα. Το 1849 ο ίδιος άρχισε να το παράγη πρώτος βιομηχανικά με αυτήν τη μέθοδο.
Το 1849 άρχισε η βιομηχανική παραγωγή βενζολίου με βάση τον λιθάνθρακα. Η παραγωγή αυτή έγινε αρχικά με απρόσεκτο τρόπο, ώσπου, μετά από πολλές προσπάθειες και 100 χρόνια αργότερα, έγιναν γνωστοί και αποδείχθηκαν οι κίνδυνοι από την τοξικότητα του βενζολίου.
Σταδιακά, με βάση το βενζόλιο, παράχθηκε μια ολόκληρη οικογένεια χημικών ενώσεων - παραγώγων του βενζολίου. Το 1855 ο August Wilhelm Hofmann πρωτοχρησιμοποίησε τον όρο «αρωματικές» (aromatic) για να χαρακτηρίσει ολόκληρη την οικογένεια, χάρη σε μια σειρά χαρακτηριστικών ιδιοτήτων, που ονομάστηκε «αρωματικός χαρακτήρας»[17].
To 1997 το βενζόλιο ανιχνεύθηκε στο διάστημα.[18]
Ο βενζολικός δακτύλιος
ΕπεξεργασίαΟ εμπειρικός τύπος του βενζολίου [(CH)n] ήταν γνωστός για ένα (σχετικά) μακρύ χρονικό διάστημα, αλλά η ανακάλυψη της πραγματικής δομής του, που χαρακτηρίζεται από υψηλό βαθμό ακορεστόστητας (4), ήταν μια πραγματική πρόκληση για τους επιστήμονες της εποχής του 19ου αιώνα. Η διερεύνηση τού σωστού συντακτικού τύπου του βενζολίου προκάλεσε μακρόχρονη διαφωνία. Οι πρώτες προτάσεις απέδιδαν στο βενζόλιο τη δομή του (ισομερούς) πρισμανίου, του (επίσης ισομερούς) βενζβαλένιου, του (άλλου ισομερούς) δικυκλοπροπενυλένιου και του (άλλου ισομερούς) βενζολίου Ντιούαρ (Dewar-Benzol, ονομασμένο από τον Τζέημς Ντιούαρ, James Dewar), που τελικά αποδείχθηκαν λανθασμένες.
Το 1858 ο Άρτσιμπαλ Σκοττ Κούπερ (Archibald Scott Cooper) και το 1861 ο Τζόζεφ Λόσχμιντ (Joseph Loschmidt) πρότειναν μια σειρά πιθανούς συντακτικούς τύπους με πολλούς διπλούς δεσμούς ή και με πολλούς δακτυλίους, αλλά η έρευνα των αρωματικών ενώσεων και των ιδιοτήτων τους ήταν ελάχιστα προχωρημένη ώστε να δικαιολογήσει ή να απορρίψει κάποιους από αυτούς για το βενζόλιο.
Το 1865 ο Φρέντριχ Αυγκούστ Κεκουλέ (Friedrich August Kekulé) δημοσίευσε σημειώσεις του στα γαλλικά (για να χρησιμεύσουν για τη διδασκαλία στο γαλλόφωνο Βέλγιο) προτείνοντας τους περίφημους τύπους του, που για το βενζόλιο πρότειναν τη δομή ενός εξαμελούς δακτυλίου και τριών (3) διπλών και τριών (3) απλών δεσμών εναλλάξ. Τον επόμενο χρόνο δημοσίευσε ένα ακόμη πιο εκτενές άρθρο στα γερμανικά για το ίδιο θέμα[20][21]. Χρησιμοποίησε μάλιστα το γεγονός ότι σχηματίζονταν μόνο ένα (1) μονοπαράγωγο από το βενζόλιο, καθώς και ακριβώς τρία (3) διπαράγωγα, τα οποία σήμερα χαρακτηρίζονται αντίστοιχα με τα προθέματα «ορθο-», «μετα-» και «παρα-», για να επιχειρηματολογήσει υποστηρίζοντας την προτεινόμενες (από αυτόν) δομές. Επισήμανε, δηλαδή το γεγονός ότι το βενζόλιο συμπεριφέρεται σαν να είναι χημικώς ισοδύναμα τα άτομα άνθρακα και άτομα υδρογόνου του, όπως ακριβώς συμβαίνει και στις προτεινόμενες από αυτόν δομές.
Οι συμμετρικές «δομές του Kekulé» (όπως ονομάστηκαν) όντως εξηγούν πολλές από τις περίεργες (ως τότε) ιδιότητες της ένωσης, όπως και την αναλογία 1:1 ατόμων άνθρακα - υδρογόνου[22].
Αυτή η νέα (τότε) κατανόηση της δομής του βενζολίου οδήγησε στην υιοθέτηση ανάλογων τύπων σε όλες τις αρωματικές ενώσεις και από τις δυο ενώσεις Χημικών της Γερμανίας (αυτή της Καθαρής και αυτή της Εφαρμοσμένης Χημείας) το 1890, όταν η «Κοινωνία των Γερμανών Χημικών» οργάνωσε σχετική τελετή για να τιμήσει τον Kekulé για την 25η επέτειο από τη δημοσίευση του πρώτου άρθρου του. Στην τελετή αυτή ο Κεκουλέ μίλησε για τη δημιουργία της θεωρίας του. Είπε ότι ανακάλυψε τη δακτυλιακή δομή του βενζολίου αφού θυμήθηκε ότι είχε ονειρευθεί ένα φίδι που δάγκωνε την ουρά του, ένα συνηθισμένο σύμβολο σε πολλούς αρχαίους πολιτισμούς, γνωστό ως ουρόβορος ή ατελείωτος κόμπος (endless knot).[23] Αυτό το όραμα, είπε, ξαναήρθε στο μυαλό του ύστερα από χρόνια, καθώς μελετούσε τη φύση των δεσμών άνθρακα - άνθρακα. Αυτό έγινε επτά (7) χρόνια αφού είχε λύσει το πρόβλημα του πώς τα άτομα άνθρακα μπορούσαν να σχηματίσουν δεσμούς με τέσσερα (4) άλλα άτομα ταυτόχρονα. Περιέργως, μια παρόμοια, χιουμοριστική απεικόνιση του βενζολίου είχε παρουσιαστεί το 1886, σε μια φυλλάδα με τίτλο Berichte der Durstigen Chemischen Gesellschaft (δηλαδή Εφημερίδα της Διψασμένης Κοινωνίας της Χημείας), μόνο που η σχετική παροδία είχε έξι (6) μαϊμούδες να δαγκώνουν η μια την ουρά της άλλης μέσα σε έναν κύκλο, και όχι φίδια, όπως στο ανέκδοτο του Κεκουλέ.[24] Κάποιοι ιστορικοί πρότειναν ότι η σχετική παροδία ήταν το έναυσμα για το ανέκδοτο με το φίδι, πιθανώς γνωστό μέσω προφορικής διάδοσης, πριν ακόμη παρουσιαστεί σε κάποιο έντυπο.[25] Ο λόγος του Κεκουλέ το 1890[26], στον οποίο εμφανίστηκε το ανέκδοτό του μεταφράστηκε κατόπιν στα αγγλικά.[27] Αν το ανέκδοτο ήταν πραγματικά από την ανάμνηση ενός αληθινού γεγονότος, οι καταστάσεις που αναφέρθηκαν στην ιστορία αυτή θα πρέπει να είχαν συμβεί στις αρχές του 1862.[28][29]
Η δομή του Κεκουλέ ήταν η πρώτη που έπαιρνε υπόψη τα πειραματικά δεδομένα που έδειχναν ότι όλα τα άτομα άνθρακα στο μόριο του βενζολίου είναι ισοδύναμα. Ωστόσο, δεν εξηγούσε όλες τις ιδιότητες του βενζολίου, όπως (και κυρίως) την ασυνήθιστα χαμηλή χημική δραστικότητα που παρουσιάζει, και μάλιστα για ένωση με αριθμό ακορεστότητας 4. Ιδιαίτερα, η εξήγηση του γεγονότος ότι το βενζόλιο δεν δίνει αντίδραση προσθήκης με υδατικό διάλυμα στοιχειακού βρωμίου, όπως θα περίμενε κανείς από τη δομή Κεκουλέ, παρουσίαζε ιδιαίτερο προβληματισμό. Η απόδειξη για την ισοδυναμία των ατόμων υδρογόνου του βενζολίου πραγματοποιήθηκε κατά το χρονικό διάστημα 1869 - 1874. Το 1872, ο Κεκουλέ τυποποίησε την «υπόθεση ταλάντωσης» (Oszillationshypothese), σύμφωνα με την οποία υπάρχει συνεχής αλλαγή των απλών δεσμών του βενζολίου σε διπλούς και των διπλών σε απλούς.
Μόλις κατά τον 20ό αιώνα διατυπώθηκε το φαινόμενο των απεντοπισμένων ηλεκτρονιακών νεφών, που δίνει στο μόριο του βενζολίου την παρατηρούμενη (σχετικά αυξημένη) σταθερότητά του, όπως τελικά επιβεβαίωσε η ανάλυση της δομή του με ακτίνες Χ. Το 1925 οι Αρμίτ (Armit) και Ρόμπινσον (Robinson) υιοθέτησαν την απλοποιημένη σημείωση με τον ομόκεντρο κύκλο στον τύπο του βενζολίου, που έχει σκοπό να εκφράσει ότι όλοι οι δεσμοί άνθρακα - άνθρακα του βενζολίου είναι απολύτως ισοδύναμοι και ότι δεν υπάρχουν εντοπισμένοι διπλοί δεσμοί στο μόριό του.[30] Μια καθαρά υποθετική μορφή τριών (3) εντοπισμένων διπλών δεσμών και τριών (3) ομοίως εντοπισμένων απλών δεσμών εναλλάξ (δομή Κεκουλέ για το βενζόλιο), θα αντιστοιχούσε στην εντελώς υποθετική ισομερή ένωση που θα ονοματίζονταν «1,3,5-κυκλοεξατριένιο».
Η κυκλική φύση του βενζολίου τελικά επιβεβαιώθηκε από την κρυσταλλογράφο Καθλίν Λόνσντεϊτ (Kathleen Lonsdale), το 1929.
Δομή
ΕπεξεργασίαΤο βενζόλιο είναι ο απλούστερος βενζοειδής αρωματικός υδρογονάνθρακας. Οι βενζοειδείς αρωματικοί υδρογονάνθρακες ονομάζονται επίσης «αρένια». Οι ιδιαίτερες δεσμικές καταστάσεις αυτής της ομάδας ενώσεων οδηγούν σε μια ομάδα ιδιοτήτων που ονομάζεται αρωματικότητα και περιγράφονται σαν ήταν το βενζόλιο το πρότυπο για όλα τα αρένια: Κάθε άτομο άνθρακα του βενζολίου έχει τέσσερα (4) ηλεκτρόνια σθένους, δύο (2) από αυτά, σε υβριδισμό 2sp², συνδέονται με δύο (2) εντοπισμένους σ δεσμούς με δύο (2) γειτονικά άτομα άνθρακα, σχηματίζοντας γωνίες 120°, και βρίσκονται όλα στο ίδιο επίπεδο. Ένα (1) ηλεκτρόνιο ανά άτομο άνθρακα, επίσης σε 2sp² υβριδισμό, συνδέεται με έναν (1) εντοπισμένο σ δεσμό με ένα (1) άτομο υδρογόνου, που έχει το μοναδικό του ηλεκτρόνιο στο 1s ατομικό τροχιακό. Τα συνολικά έξι (6) ηλεκτρόνια, σε 2p τροχιακά, που απομένουν τυπικά σχημάτιζαν τρεις (3) π δεσμούς, όπως εκφράζονταν στις δομές Κεκουλέ με τους τρεις (3) εντοπισμένους δεσμούς. Οι δεσμοί, όμως, δεν είναι εντοπισμένοι μόνο μεταξύ δύο γειτονικών ατόμων άνθρακα, αλλά κατανέμονται συμμετρικά μεταξύ όλων των ατόμων άνθρακα. Μετρήσεις με ακτίνες Χ έδειξαν ότι το μήκος των δεσμών C-C δεν είναι εναλλασσόμενο του γνωστού μήκους του απλού και του διπλού δεσμού (154 pm και 134 pm αντίστοιχα), αλλά όλοι οι δεσμοί είναι του αυτού μήκους (139 pm, δηλαδή έχουν ένα ενδιάμεσο μήκος). Από τα παραπάνω συμπεραίνεται, και αποδεικνύεται πειραματικά, ότι το βενζόλιο δεν είναι απλά συζυγές κυκλοεξατριένιο, όπως δείχνουν οι τύποι Kekulé.[31]. Τα 6 2p ηλεκτρόνια από τα 6 άτομα άνθρακα με 2sp² υβριδισμό σχηματίζουν τελικά ένα εξακεντρικό σύστημα 6 ηλεκτρονίων ενιαίου π δεσμού. Έτσι οι 6 δεσμοί C-C είναι ισότιμοι και αντιστοιχούν σε 1,5 δεσμό ο καθένας.
Το γεγονός ότι το βενζόλιο έχει επίπεδη μοριακή γεωμετρία αποδείχθηκε από τη Βρεττανίδα κρυσταλλογράφο Καθλίν Λόνσντεϊτ (Kathleen Lonsdale), το 1929,[32][33] γεγονός που τεκμηρίωσε επίσης ότι τα άτομα άνθρακα στο μόριο του βενζολίου έχουν sp² υβριδισμό.
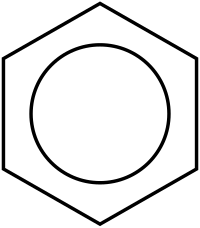
Ο Κεκουλέ εξέφρασε αυτήν την κατάσταση ως μεσομέρεια ανάμεσα σε δυο συντακτικούς τύπους, που εκφράζουν μόνο τα δυο (2) ακραία σημεία του ηλεκτρονιακού φορτίου. Εξαιτίας του φαινομένου της μεσομέρειας ο ανθρακικός δακτύλιος είναι πιο σταθερός σε σύγκριση με αυτόν του υποθετικού 1,3,5-κυκλοεξατριένιου με τους εντοπισμένους διπλούς δεσμούς. Στην απλοποιημένη απόδοση, ο εξαμελής ανθρακικός δακτύλιος αντιπροσωπεύεται από ένα εξάγωνο και το απεντοπισμένο ηλεκτρονιακό νέφος ως εγγεγραμμένο στο εξάγωνο κύκλο. Ωστόσο, το φαινόμενο της μεσομέρειας ή του συντονισμού στο μόριο βενζολίου, αναγνωρίστηκε για πρώτη φορά κατά τη δεκαετία του 1930, από το Λίνους Πάουλιγκ.
Ο απεντοπισμός των ηλεκτρονίων τεκμηριώνει την ισοδυναμία των ομάδων CH του βενζολιου και έτσι και την υψηλή του συμμετρία,[34] μια και το βενζόλιο ανήκει στην ομάδα σημείων D6h, δηλαδή εξαμελούς άξονα.[35]
Το καλοκαίρι του 2013, ερευνητές του Lawrence Berkeley National Laboratory κατώρθωσαν να ανακαλύψουν και να περιγράψουν την εξαγωνική μοριακή γεωμετρία του βενζολίου, χρησιμοποιώντας μικροσκόπιο δυνατής σάρωσης.[36][37]
Σκέδαση ακτίνων Χ έδειξε ότι οι έξι (6) δεσμοί C-C έχουν τα ίδια μήκη, συγκεκριμένα 140 pm. Τα μήκη αυτά είναι μακρύτερα από τα μήκη των διπλών δεσμών (135 pm), αλλά βραχύτερα από τα μήκη των απλών δεσμών (147 pm). Αυτό το ενδιάμεσο μήκος είναι συνεπές με τον απεντοπισμό των ηλεκτρονίων, καθώς τα έξι (6) p ηλεκτρόνια των ατόμων άνθρακα κατανέμονται εξίσου ανάμεσα στα έξι (6) άτομα άνθρακα. Το βενζόλιο έχει έξι (6) άτομα υδρογόνου, δηλαδή οκτώ (8) λιγότερα από αυτά του αντίστοιχου αλκανίου, που είναι το εξάνιο (C6H14). Το μόριο του βενζολίου είναι επίπεδο. Η περιγραφή των μοριακών τροχιακών του εμπλέκει το σχηματισμό τριών (3) απεντοπισμένων π τροχιακών, μοιρασμένων εξίσου σε όλα τα έξι (6) άτομα άνθρακα της ένωσης, ενώ η θεωρία σθένους - δεσμού εμπλέκει την υπέρθεση δομών συντονισμού. Είναι πιθανό αυτή η σταθερότητα να συνεισφέρει στις ιδιαίτερες μοριακές και χημικές ιδιότητες που είναι γνωστές ως αρωματικότητα. Η ακριβής αντανάκλαση της φύσης της δεσμολογίας του βενζολίου συχνά παριστάνεται με τη χρήση εγγεγραμμένου κύκλου σε εξάγωνο, που εκπροσωπεί τη σχετική τοποθέτηση των ατόμων άνθρακα της ένωσης.
Υποκατεστημένα παράγωγα του βενζολίου υπάρχουν σημαντικά συχνά ως συστατικά οργανικών μορίων, που η Κοινοπραξία Ενιαίας Κωδικοποίησης (Unicode Consortium) έχει θεσπίσει ένα σύμβολο στην περιοχή των Διαφόρων Τεχνικών (Miscellaneous Technical block), με κωδικοποίηση U+232C (c)[38], για να το αναπαριστά με τρεις (3) διπλούς δεσμούς, και με κωδικοποίηση U+23E3, για την απεντοπισμένη έκδοση[39].
| Δεσμοί[40] | ||||
| Δεσμός | τύπος δεσμού | ηλεκτρονική δομή | Μήκος δεσμού | Ιονισμός |
|---|---|---|---|---|
| C-H | σ | 2sp²-1s | 106 pm | 3% C- H+ |
| C-C | σ | 2sp²-2sp² | 140 pm | |
| C#1...C#6 | π[41] | 2p-2p | 140 pm | |
| Κατανομή φορτίων σε ουδέτερο μόριο | ||||
| C | -0,03 | |||
| H | +0,03 | |||
Ονοματολογία
ΕπεξεργασίαΔεδομένου ότι η κατάληξη είναι «-όλη» χρησιμοποιείται για αλκοόλες, στη συστηματική χημική ονοματολογία, η πιο ευρέως χρησιμοποιούμενη στα γερμανικά ιστορική ονομασία benzol είναι παραπλανητική. Η ονομασία βενζόλιο ή βενζένιο καθορίστηκε από την IUPAC ως επίσης ονομασία της ένωσης, σύμφωνα με τη συστηματική κατάληξη της ονοματολογίας των υδρογοναθράκων.
Ο γερμανός χημικός Βίλχελμ Κόνρνερ (Wilhelm Körner) πρότεινε τα προθέματα ορθο-, μετα- και παρα-, για να διαχωρίσει μεταξύ τους τα διυποκατεστημένα παράγωγα του βενζολίου το 1867, ωστόσο, δεν χρησιμοποίησε τα προθέματα για να διαχωρήσει τις σχετικές θέσεις υποκαταστατών στο βενζολίου στο βενζολικό δακτύλιο.[42] Αργότερα, ένας άλλος γερμανός χημικός, ο Καρλ Γκράμπε (Karl Gräbe), χρησιμοποίησε πρώτος το 1869 τα ίδια προθέματα για να προσδιορίσει και τις σχετικές θέσεις των διυποκαταστατών σε έναν (άλλο) διυποκατεστημένο αρωματικό δακτύλιο (δηλαδή το ναφθαλίνιο).[43] Το 1870, ο γερμανός χημικός Βίκτορ Μέγιερ (Viktor Meyer) πρώτος εφάρμοσε την ονοματολογία του Γκράμπε στο βενζόλιο.[44]
Παρουσία και εκπομπές βενζολίου
ΕπεξεργασίαΜικρές ποσότητες βενζολίου βρίσκονται στο (αργό) πετρέλαιο, στο λιθάνθρακα, στη λιθανθρακόπισσα καθώς και στον παραγώμενο καπνό των αναμένων τσιγάρων (10-100 μg ανά τσιγάρο). Ίχνη βενζολίου, επίσης, παράγονται κατά τη διάρκεια ηφαιστειακών εκρήξεων, δασικών πυρκαγιών, καθώς και κατά την ατελή καύση οργανικής ύλης. Στην ατμόσφαιρα, το βενζόλιο έχει ημιζωή δύο (2) έως πέντε (5) ημέρες, γιατί αντιδρά με ελεύθερες ρίζες υδροξυλίου (•ΟΗ).
Για εμπορική χρήση, ως το Β΄ Παγκόσμιο Πόλεμο, το περισσότερο βενζόλιο λαμβάνονταν ως παραπρϊόν της παραγωγής κοκ (καύσιμου), που παράγονταν για τη χαλυβουργία. Ωστόσο, η αύξηση της ζήτησης βενζολίου, μετά τη δεκαετία 1950, ιδιαίτερα από την αναπτυσσόμενη βιομηχανία πολυμερών, έκανε απαραίτητη την παραγωγή βενζολίου με πρώτη ύλη το πετρέλαιο. Σήμερα, το περισσότερο βενζόλιο παράγεται από την πετροχημική βιομηχανία, και μόνο ελάχιστο κλάσμα της παραγωγής του προέρχεται από παραπροϊόντα άνθρακα.[45]
Το βενζόλιο κυρίως εκλύεται από τα καυσαέρια βενζινοκινητήρων. Το 75% των εκπομπών βενζολίου προέρχεται από μηχανοκίνητα οχήματα. Από το 2000, το ποσοσστό βενζολίου στη βενζίνη περιορίστηκε σε ένα μέγιστο όριο 1% κατ' όγκο, σύμφωνα με την οδηγία DIN EN 228 στην Ευρώπη. Το 2003, ο μέσος όρος ήταν 0,7% κατ' όγκο. Το αντίστοιχο όριο για τις ΗΠΑ (από το 2010) ήταν 5% κατ' όγκο.[9][46] Από το 2013, η μέση περιεκτικότητα βενζολίου στη βενζίνη στις ΗΠΑ έπρεπε να μειωθεί σε 0,62%,[47] αλλά τελικά ο κανονισμός μέγιστου όριου 5% δεν έχει ακόμη μεταβληθεί.[48]
Η μέση τιμή φορτίου για τον πληθισμό είναι περίπου 2 μg/m³ στον αέρα, αλλά στην πράξη μπορεί να είναι σημαντικά μεγαλύτερο, ανάλογα με το περιβάλλον (π.χ. γύρω από βενζινάδικά, σε γκαράζ με φτωχό εξαερισμό, κ.τ.λ.). Από το 1980 υπήρξε απότομη πτώση σε εκπομπές βενζολίου, ενώ αυτό συνεχίστηκε κατά τη δεκετία του 1990. Το φορτίο βενζολίου μεταξύ 1997 και 2005, για παράδειγμα, ήταν σημαντικά μειωμένο στην αστική ζώνη, κοντά σε σταθμούς ελέγχου κίνησης, καθώς επίσης και κοντά σε δημοτικά κτίρια, οπότε η θέσπιση ορίου 5 μg/m³, που επιβλήθηκε από το 2010, σε μεγάλο βαθμό τηρείται.[49]
Υποκατεστημένα παράγωγα του βενζολίου
ΕπεξεργασίαΠολλές σημαντικές χημικές ενώσεις παράγονται από το βενζόλιο με την αντικατάσταση μιας ή περισσοτέρων ατόμων υδρογόνου από μία ή περισσότερες λειτουργικές ομάδες. Τέτοια παραδείγματα συμπεριλμβάνουν τη φαινόλη (PhOH), το τολουόλιο (PhMe) και την ανιλίνη (PhNH2). Συνδέοντας δυο βενζολικούς δακτυλίους παίρνουμε το διφαινύλιο (Ph2). Παραπέρα απώλεια ατόμων υδρογόνου δίνει «συμπυκνωμένους» αρωματικούς υδρογονάνθρακες, όπως το ναφθαλίνιο και το ανθρακένιο. Το όριο της διεργασίας συμπύκνωσης είναι ο γραφίτης, που είναι αλλομορφή του άνθρακα, δηλαδή χωρίς καθόλου υδρογόνο.
Σε ετεροκυκλικά παράγωγα του βενζολίου, άτομα άνθρακα του βενζολικού δακτυλίου αντικαθιστούνται από άτομα άλλων χημικών στοιχείων. Οι πιο σημαντικές από αυτές τις παραλλαγές περιέχουν άζωτο. Αντικαθιστώντας μια ομάδα CH του βενζολίου με ένα άτομο αζώτο, παίρνουμε την ένωση πυριδίνη (C5H5N). Παρ' όλο που το βενζόλιο και η πυριδίνη είναι ενώσεις δομικά συγγενικές, το βενζόλιο δεν μπορεί να μετατραπεί σε πυριδίνη. Η αντικατάσταση και μιας δεύτερης ομάδα CH με άτομο αζώτου δίνει, ανάλογα με τη σχετική θέση του δεύτερου ατόμου αζώτου ως προς το πρώτο, τις ενώσεις πυριδαζίνη, πυριμιδίνη και πυραζίνη, που όλες έχουν μοριακό τύπο C4H4N2.[50]
Παραγωγή
ΕπεξεργασίαΓια πολλά χρόνια το βενζόλιο παραγόταν από την λιθανθρακόπισσα με κλασματική απόσταξη.
Το βενζόλιο είναι φυσικό συστατικό του πετρελαίου, αλλά δεν μπορεί να διαχωριστεί με απλή κλασματική απόσταξη από αυτό γιατί δημιουργεί αζεοτροπικά μίγματα με αρκετούς άλλους υδρογονάνθρακες. Η ανάκτηση είναι πιο οικονομική αν το κλάσμα του πετρελαίου υποβληθεί πρώτα σε μία θερμική ή καταλυτική διεργασία η οποία αυξάνει τη συγκέντρωση του βενζολίου.
Τέσσερεις (4) χημικές διεργασίες συνεισφέρουν (πλέον) στη βιομηχανική παραγωγή βενζολίου:
- Η καταλυτκή αναμόρφωση της νάφθας.
- Η απομεθυλίωση του τολουολίου.
- Η δυσαναλοποίηση του τολουολίου.
- Πυρόλυση με ατμό.
Σύμφωνα με το ATSDR τοξικολογικό προφίλ για το βενζόλιο, μεταξύ 1978 και 1981 η καταλυτική αναμόρφωση νάφθας χρησιμοποιούνταν περίπου για το 44-55% της συνολικής παραγωγής βενζολίου στις ΗΠΑ.[45]
Καταλυτική αναμόρφωση της νάφθας
ΕπεξεργασίαΣτην καταλυτική αναμόρφωση της νάφθας, ένα μίγμα υδρογονανθράκων με θερμοκρασίες βρασμού 60–200 °C, αναμειγνύεται με αέριο υδρογόνο και εκτίθεται σε διλειτουργικούς καταλύτες, όπως διχλωριούχο λευκόχρυσο (PtCl2) ή κάποιο χλωρίδιο του ρήνιου στους 500–525 °C και υπό πίεση 8–50 atm. Κάτω από αυτές τις συνθήκες, οι αλειφατικοί υδρογονάνθρακες, σχηματίζουν δακτυλίους, για παράδειγμα το εξάνιο γίνεται κυκλοεξάνιο, και αφυδρογονώνονται, με αποτέλεσμα να γίνονται (τελικά) αρωματικοί υδρογονάνθρακες. Τα αρωματικά προϊόντα των παραπάνω αναφερόμενων αντιδράσεων διαχωρίζονται από το «αναμορφωμένο» μίγμα (δηλαδή το μίγμα που προκύπτει μετά την αναμόρφωση, reformate mix) με εκχύλιση, με οποιονδήποτε από έναν αριθμό διαλυτών, που συμπεριλαμβάνουν την 1,2-αιθανοδιόλη ή το σουλφολάνιο, και το βενζόλιο μετά διαχωρίζεται από τους υπόλοιπους αρωματικούς υδρογονάνθρακες με απόσταξη. Το στάδιο της εκχύλισης του αναμιορφωμένου σχεδιάστηκε για να παράγει αρωματικό μίγμα με τις ελάχιστες μη αρωματικές προσμείξεις. Η αναμόρφωση των αρωματικών, που συχνά αναφέρεται ως BTX [από τα ξενικά αρχικά των ενώσεων βενζόλιο (Benzene), τολουόλιο (Toluene) και ξυλόλιο (Xylene)], συμπεριλαμβάνει στάδια εκχύλισης και απόσταξης. Υπάρχουν πολλές καλές αδειοδοτημένες διεργασίες για την εκχύλιση των αρωματικών υδρογονανθράκων.
Παρόμοιες διεργασίες με την παραπάνω αναφερόμενη καταλυτική αναμόρφωση αποτελούν οι διεργασίες UOP και BP, που εμπορευματοποίησαν μια μέθοδο μετατροπής υγραερίων, κυρίως προπάνιο και βουτάνιο, σε αρωματικούς υδρογονάνθρακες, συμπεριλαμβανομένου του βενζολίου.
Υδροαπομεθυλίωση του τολουολίου
ΕπεξεργασίαΗ υδροαπομεθυλίωση του τολουολίου μετατρέπει τολουόλιο σε βενζόλιο. Σε αυτήν τη διεργασία, το τολουόλιο αναμιγνύεται με υδρογόνο, και μετά διέρχεται πάνω από καταλύτη οξειδίων χρωμίου, μολυβδαινίου ή λευκοχρύσου. Ο αντιδραστήρας λειτουργεί σε θερμοκρασία 500-595 °C και πίεση 40-60 atm. Μερικές φορές προτιμώνται υψηλότερες θερμοκρασίες αντί για τη χρήση καταλυτών. Κάτω από τις παραπάνω αναφερόμενες συνθήκες, το τολουόλιο μετατρέπεται σε μίγμα βενζολίου και μεθανίου. Ο βαθμός μετατροπής φτάνει συνήθως το 90% και η εκλεκτικότητα σε βενζόλιο ξεπερνάει το 95%:
Δυσαναλογοποίηση τολουολίου
ΕπεξεργασίαΑντίδραση δύο μορίων τολουολίου για την παραγωγή ενός μορίου βενζολίου και ενός μορίου κάποιου από τα ισομερή ξυλένια. Κατά την διαδικασία αυτή το τολουόλιο θερμαίνεται στους 350-530 °C σε πίεση 10-50 bar, και εισάγεται σε αντιδραστήρα που περιέχει καταλύτη ευγενούς μετάλλου. Μετά την απομάκρυνση των αερίων, και με κλασματική απόσταξη παραλαμβάνεται υψηλής καθαρότητας βενζόλιο και ξυλόλιο. Ο βαθμός μετατροπής μπορεί να φτάσει και το 92% του θεωρητικού[51].
Τριμερισμός αιθινίου
ΕπεξεργασίαΜε καταλυτικό τριμερισμό αιθινίου παράγεται βενζόλιο[52]:
Μέθοδος Fitting
ΕπεξεργασίαΑπό φαινυλαλογονίδιο (PhX), με τη μεθοδο Fittιng, παράγεται βενζόλιο[53]:
Μέθοδος Grignard
ΕπεξεργασίαΑπό φαινυλαλογονίδιο (PhX), με τη μεθοδο Grignard, παράγεται βενζόλιο[54]:
Με αποκαρβοξυλίωση βενζοϊκού οξέος
ΕπεξεργασίαΑπό βενζοϊκό οξύ, με αποκαρβοξυλίωση, παράγεται βενζόλιο[55]:
Με αποξυγόνωση φαινόλης
ΕπεξεργασίαΑπό φαινόλη, με αποξυγόνωση, παράγεται βενζόλιο[56]:
Ιδιότητες
ΕπεξεργασίαΕίναι υγρό άχρωμο, με ιδιάζουσα γλυκιά μυρωδιά, πολύ εύφλεκτο και πτητικό. Διαλύεται ελάχιστα στο νερό και καίγεται με ζωηρή φλόγα και καπνό. Αναμιγνύεται εύκολα σε οποιαδήποτε αναλογία με τον αιθέρα και το οινόπνευμα. Παρόλο που εμφανίζει μηδενική διπολική ροπή, διαλύει πολλές οργανικές ενώσεις, όπως λίπη, λάδια, καουτσούκ, αλλά και ανόργανες ουσίες, όπως θείο, φωσφόρο και ιώδιο. Οι ατμοί με τον ατμοσφαιρικό αέρα αποτελούν εκρηκτικό μείγμα. Είναι ανθεκτικό στα οξειδωτικά μέσα και δε σχηματίζει εύκολα παράγωγα με τα αλογόνα στοιχεία, όταν όμως εισπνέεται σε μεγάλες ποσότητες προκαλεί αναισθησία, ακόμη και θάνατο[57]. Η κύρια χημική ιδιότητά του είναι ότι δίνει αντιδράσεις ηλεκτρονιόφιλης αρωματικής υποκατάστασεις, της γενικής μορφής[58]:
Παράγωγα
ΕπεξεργασίαΝίτρωση
ΕπεξεργασίαΜε νίτρωση παράγει νιτροβενζόλιο[59]:
Σουλφούρωση
ΕπεξεργασίαΜε σουλφούρωση παράγει βενζοσουλφονικό οξύ[59]:
Αλογόνωση
ΕπεξεργασίαΜε αλογόνωση παράγει φαινυλαλογονίδιο[59]:
- όπου Χ Cl ή Br. Τα άλλα φαινυλαλονονίδια προκύπτουν σε δεύτερη φάση με υποκατάσταση αυτών με χρήση KI ή Hg2F2, αντίστοιχα.
Αλκυλίωση
ΕπεξεργασίαΜε αλκυλίωση κατά Friedel-Crafts παράγει αλκυλοβενζόλιο[59]:
Ακυλίωση
ΕπεξεργασίαΜε ακυλίωση κατά Friedel-Crafts παράγει ακυλοβενζόλιο[59]:
Υδροξυλίωση
ΕπεξεργασίαΜε υδροξυλίωση κατά Friedel-Crafts παράγει φαινόλη[59]:
Αμίνωση
ΕπεξεργασίαΜε αμίνωση κατά Friedel-Crafts παράγει ανιλίνη[59]:
Καρβοξυλίωση
ΕπεξεργασίαΜε καρβοξυλίωση κατά Friedel-Crafts παράγει βενζοϊκό οξύ[59]:
Αναγωγή
ΕπεξεργασίαΜε αναγωγή παράγει κυκλοεξάνιο[60]:
Οζονόλυση
ΕπεξεργασίαΜε Οζονόλυση παράγει αιθανοδιάλη[61]:
Οξείδωση
ΕπεξεργασίαΟξειδώνεται με πεντοξείδιο του βαναδίου (V2O5) παράγοντας μηλεϊνικό ανυδρίτη[61]:
- Η πηγή δεν ανέφερε τη συνολική στοιχειομετρική εξίσωση.
Αλομεθυλίωση
ΕπεξεργασίαΜε αλομεθυλίωση κατά Blanc παράγει αλομεθυλοβενζόλιο[62]:
Επίδραση καρβενίων
ΕπεξεργασίαΜε μεθυλένιο παράγει τολουόλιο και κυκλοεπτατρένιο:
Προσθήκη
Επεξεργασία1. Με προσθήκη σε αιθένιο, παρουσία καταλύτη, παράγεται αιθυλοβενζόλιο:
2. Με προσθήκη σε αιθίνιο, παρουσία καταλύτη, παράγεται στυρένιο:
Εφαρμογές
ΕπεξεργασίαΠρώιμες εφαρμογές
ΕπεξεργασίαΚατά το 19ο και κατά τις αρχές του 20ού αιώνα, το βενζόλιο χρησιμοποιήθηκε σε παρασκευάσματα που εφαρμώζονταν μετά το ξύρισμα, εξαιτίας της ευχάριστης οσμής του. Πριν από τη δεκαετία του 1920, το βενζόλιο συχνά χρησιμοποιήθηκε ως βιομηχανικός διαλύτης, ιδιαίτερα για την απογρασσοποίηση μετάλλων. Καθώς η τοξικότητά του γινόταν προφανής, το βενζόλιο αντικαταστάθηκε από άλλους διαλύτες, ιδιαίτερα από το τολουόλιο, που έχει παρόμοιες φυσικές ιδιότητες, αλλά είναι λιγότερο καρκινογόνο.
Το 1903, ο Λούντβιγκ Ροζέλιους (Ludwig Roselius) έκανε συνηθισμένη τη χρήση βενζολίου για την αποκαφεΐνωση του καφέ. Η ανακάλυψη οδήγησε στην παραγωγή Σάνκα (Sanka). Η διεργασία αυτή αργότερα διακόπηκε. Το βενζόλιο, ιστορικά χρησιμοποιήθηκε ως σημαντικό συστατικό σε πολλά καταναλωτικά προίόντα, όπως το Υγρό Ρενχ (Liquid Wrench), αρκετά αφαιρετικά μπογιάς, τσιμέντα καουτσούκ (rubber cements), καθαριστικά λεκέδων, καθώς και άλλα προϊόντα. Η παραγωγή κάποιων τέτοιων προϊόντων που περιείχαν βενζόλιο σταμάτησε γύρω στο 1950, παρ' όλο που η παραγωγή Liquid Wrench, που περιείχε σημαντικές ποσότητες βενζολίου, συνεχίστηκε ως τα τέλη της δεκαετίας του 1970.
Σύγχρονες εφαρμογές
ΕπεξεργασίαΗ πιο σημαντική χρήση του βενζολίου σήμερα είναι ως ενδιάμεσο για την παραγωγή πολλών σημαντικών βιομηχανικών ενώσεων. Έτσι χρησιμοποιείται για την παραγωγή του στυρενίου, της φαινόλης, του κυκλοεξανίου, της ανιλίνης, διάφορων αλκυλοβενζολίων και χλώροβενζολίων και του μηλεϊνικού ανυδρίτη. Αυτές οι ενώσεις στη συνέχεια εφοδιάζουν ένα μεγάλο αριθμό χημικών βιομηχανιών για την παραγωγή φαρμακευτικών προϊόντων, ειδικών χημικών, πλαστικών, ρητινών, χρωμάτων και εντομοκτόνων. Στην παρακάτω εικόνα δίνονται συνοπτικά τα σημαντικότερα βιομηχανικά παράγωγα του βενζολίου:
Επίσης το βενζόλιο, μαζί με άλλους ελαφρείς αρωματικούς υδρογονάνθρακες, όπως το τολουόλιο και το ξυλένιο, χρησιμοποιείται ως πρόσθετο στην βενζίνη για την αύξηση του αριθμού οκτανίου. Είναι πολύ καλός διαλύτης αλλά δεν χρησιμοποιείται πλέον σε σημαντικές ποσότητες λόγω της τοξικότητάς του.
Κίνδυνοι για την υγεία
ΕπεξεργασίαΤο βενζόλιο είναι μία ιδιαίτερα τοξική χημική ένωση. Όταν εισπνέεται σε μεγάλες ποσότητες μπορεί να προκαλέσει ζάλη, ταχυκαρδία, πονοκεφάλους, σύγχυση, αναισθησία, ακόμα και το θάνατο. Επίσης όταν βρίσκεται σε μεγάλες συγκεντρώσεις στα τρόφιμα μπορεί να προκαλέσει ερεθισμό, ζάλη, ταχυκαρδία, τάση για εμετό, σπασμούς και το θάνατο.
Μακροχρόνια έκθεση σε βενζόλιο έχει σημαντικές επιπτώσεις στην υγεία του ανθρώπου και κυρίως στο αίμα. Καταστρέφει το μυελό των οστών και μπορεί να προκαλέσει την εμφάνιση αναιμίας. Επίσης μπορεί να προκαλέσει υπερβολική αιμορραγία και να μειώσει την ικανότητα του ανοσοποιητικού συστήματος αυξάνοντας τις πιθανότητες μόλυνσης[63]
Τέλος, το βενζόλιο θεωρείται καρκινογόνο για τον άνθρωπο, μακροχρόνια έκθεση σε υψηλές συγκεντρώσεις μπορεί να προκαλέσει την εμφάνιση λευχαιμίας.
Πηγές
Επεξεργασία- Παπαγεωργίου Β.Π., “Εφαρμοσμένη Οργανική Χημεία: Κυκλικές Ενώσεις”, Εκδόσεις Παρατηρητής, Θεσσαλονίκη 1986.
- Speight J. G., “Chemical and Process Design Handbook”, McGraw-Hill, 2002
- Ηλεκτρονική Εγκυκλοπαίδεια “Επιστήμη & Ζωή”
- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
Αναφορές και σημειώσεις
Επεξεργασία- ↑ [1][νεκρός σύνδεσμος]
- ↑ Eintrag zu Benzol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 19. April 2013 (JavaScript erforderlich).
- ↑ Δείτε τις εναλλακτικές ονομασίες στον παρακείμενο πίνακα πληροφοριών χημικής ένωσης.
- ↑ Πρόκειται για αρωματικούς υδρογονάνθρακες που περιέχουν τουλάχιστον ένα βενζολικό δακτύλιο στο μόριο τους. Αποτελούν τη συντριπτική πλειοψηφία των αρωματικών υδρογονανθράκων.
- ↑ John Whysner, M. Vijayaraj Reddy, Peter M. Ross, Melissa Mohan, Elizabeth A. Lax: Genotoxicity of benzene and its metabolites. In: Mutation Research/Reviews in Mutation Research 566, Nr. 2, 2004, S. 99–130, doi:10.1016/S1383-5742(03)00053-X.
- ↑ Günter Jeromin: Organische Chemie: Ein praxisbezogenes Lehrbuch. Harry Deutsch, Frankfurt a. M. 2006, ISBN 978-3-8171-1732-1, S. 215.
- ↑ Thomas Hillenbrand, Frank Marscheider-Weidemann, Manuel Strauch, Kerstin Heitmann, Dora Schaffrin: Emissionsminderung für prioritäre und prioritäre gefährliche Stoffe der Wasserrahmenrichtlinie. (PDF; 3,7 MB) Stoffdatenblätter 29-07 des Umweltbundesamts, Abschnitt 16.3.
- ↑ Schweizerischer Bundesrat: Luftreinhalte-Verordnung (LRV), Anhang 5.
- ↑ 9,0 9,1 James W. Weaver, Linda R. Exum, Lourdes M. Prieto: Gasoline Composition Regulations Affecting LUST Sites. (PDF; 1,1 MB) Veröffentlichung der EPA, Januar 2010, S. 18.
- ↑ Rocke, A. J. (1985). "Hypothesis and Experiment in the Early Development of Kekule's Benzene Theory". Annals of Science 42 (4): 355–81. doi:10.1080/00033798500200411.
- ↑ Faraday, M. (1825). "On new compounds of carbon and hydrogen, and on certain other products obtained during the decomposition of oil by heat". Philosophical Transactions of the Royal Society of London 115: 440–466. doi:10.1098/rstl.1825.0022. JSTOR 107752. On pages 443-450, Faraday discusses "bicarburet of hydrogen" (benzene). On pages 449-450, he shows that benzene's empirical formula is C6H6, although he doesn't realize it because he (like most chemists at that time) used the wrong atomic mass for carbon (6 instead of 12).
- ↑ R. Kaiser (1968). "Bicarburet of Hydrogen. Reappraisal of the Discovery of Benzene in 1825 with the Analytical Methods of 1968". Angewandte Chemie International Edition in English 7 (5): 345–350. doi:10.1002/anie.196803451.
- ↑ Η ονομασία που έδωσε, πάντως, αντιστοιχεί στο αιθίνιο, (C2H2).
- ↑ Mitscherlich, E. (1834). "Über das Benzol und die Säuren der Oel- und Talgarten (On benzol and oily and fatty types of acids)". Annalen der Pharmacie 9 (1): 39–48. doi:10.1002/jlac.18340090103. In a footnote on page 43, Liebig, the journal's editor, suggested changing Mitscherlich's original name for benzene (namely, "benzin") to "benzol", because the suffix "-in" suggested that it was an alkaloid (e.g., Chinin (quinine)), which benzene isn't, whereas the suffix "-ol" suggested that it was oily, which benzene is. Thus on page 44, Mitscherlich states: "Da diese Flüssigkeit aus der Benzoësäure gewonnen wird, und wahrscheinlich mit den Benzoylverbindungen im Zusammenhang steht, so gibt man ihr am besten den Namen Benzol, da der Name Benzoïn schon für die mit dem Bittermandelöl isomerische Verbindung von Liebig und Wöhler gewählt worden ist." (Since this liquid [benzene] is obtained from benzoic acid and probably is related to benzoyl compounds, the best name for it is "benzol", since the name "benzoïn" has already been chosen, by Liebig and Wöhler, for the compound that's isomeric with the oil of bitter almonds [benzaldehyde].)
- ↑ Otto-Albrecht Neumüller (Herausgeber): Römpps Chemie Lexikon, Frank’sche Verlagshandlung, Stuttgart, 1983, 8. Auflage, S. 402−403, ISBN 3-440-04513-7.
- ↑ E. Mitscherlich: Ueber das Benzol und die Säuren der Oel- und Talgarten, in: Annalen der Pharmacie, 1834, 9 (1), S. 39–48, doi:10.1002/jlac.18340090103.
- ↑ Augustus W. Hoffman (1856) "On insolinic acid," Proceedings of the Royal Society of London, vol. 8, pages 1–3. On page 3, Hoffmann states: "The existence and mode of formation of insolinic acid prove that to the series of monobasic aromatic acids, Cn2Hn2-8O4, the lowest known term of which is benzoic acid, ...." [Σημείωση: Οι εμπειρικοί τύποι των οργανικών ενώσεων που εμφανίζονται στο άρθρο του Χόφφμανν είναι λανθασμένοι, γιατί χρησιμοποίησε λανθασμένες ατομικές μάζες για τον άνθρακα (χρησιμοποίησε 6 αντί 12) και για το οξυγόνο (χρησιμοποίησε 8 αντί 16).
- ↑ Cernicharo, José; Heras, Ana M.; Tielens, A. G. G. M.; Pardo, Juan R.; Herpin, Fabrice; Guélin, Michel; Waters, L. B. F. M. (1997), «Infrared Space Observatory's Discovery of C4H2, C6H2, and Benzene in CRL 618», Astrophysical Journal Letters 546 (2): L123–L126, doi:
- ↑ August Kekulé (1872). «Ueber einige Condensationsproducte des Aldehyds». Liebigs Ann. Chem. 162 (1): 77–124. doi:.
- ↑ F. A. Kekulé (1865). «Sur la constitution des substances aromatiques». Bulletin de la Société Chimique de Paris 3: 98–110.
- ↑ F. A. Kekulé (1866). «Untersuchungen uber aromatische Verbindungen». Liebigs Annalen der Chemie 137: 129–36. doi:.
- ↑ Critics pointed out a problem with Kekulé's original (1865/1866) structure for benzene: Whenever benzene underwent substitution at the ortho position, two distinguishable isomers should have resulted, depending on whether the double bond at the ortho position extended clockwise or counterclockwise; however, no such isomers were observed. In 1872, Kekulé suggested that benzene had two complementary structures and that these forms rapidly interconverted, so that if there were a double bond between any pair of carbon atoms at one instant, that double bond would become a single bond at the next instant (and vice-versa). To provide a mechanism for the conversion process, Kekulé proposed that the valency of an atom is determined by the frequency with which it collided with its neighbors in a molecule. As the carbon atoms in the benzene ring collided with each other, each carbon atom would collide twice with one neighbor during a given interval and then twice with its other neighbor during the next interval. Thus, a double bond would exist with one neighbor during the first interval and the other neighbor during the next interval. See pages 86–89 of Auguste Kekulé (1872) "Ueber einige Condensationsprodukte des Aldehyds" (On some condensation products of aldehydes), Liebig's Annalen der Chemie und Pharmacie, 162: 77–124, 309–320.
- ↑ Read, John (1995). From alchemy to chemistry. New York: Dover Publications. σελίδες 179–180. ISBN 9780486286907.
- ↑ English translation Wilcox, David H.; Greenbaum, Frederick R. (1965). «Kekule's benzene ring theory: A subject for lighthearted banter». Journal of Chemical Education 42 (5): 266–67. doi:. Bibcode: 1965JChEd..42..266W. https://archive.org/details/sim_journal-of-chemical-education_1965-05_42_5/page/266.
- ↑ Rocke, A. J. (1985). «Hypothesis and Experiment in the Early Development of Kekule's Benzene Theory». Annals of Science 42 (4): 355–81. doi:.
- ↑ Kekulé, F. A. (1890). «Benzolfest: Rede». Berichte der Deutschen Chemischen Gesellschaft 23: 1302–11. doi:. http://gallica.bnf.fr/ark:/12148/bpt6k90720c/f1304.chemindefer.
- ↑ Benfey O. T. (1958). «August Kekulé and the Birth of the Structural Theory of Organic Chemistry in 1858». Journal of Chemical Education 35: 21–23. doi:. Bibcode: 1958JChEd..35...21B.
- ↑ Gillis, Jean "Auguste Kekulé et son oeuvre, realisee a Gand de 1858 a 1867," Memoires de l'Academie Royale de Belgique, 37:1 (1866), 1–40.
- ↑ Stephan Kekule von Stradonitz: Zwei chemische Visionen. In: Zeitschrift für angewandte Chemie, 1927, 40 (25), S. 736–737, doi:10.1002/ange.19270402505.
- ↑ Alan R. Katritzky: Advances in heterocyclic chemistry. Band 17, Academic Press, 1974, ISBN 0-12-020617-X, S. 7.
- ↑ Παπαγεωργίου Β. Π., “Εφαρμοσμένη Οργανική Χημεία: Κυκλικές Ενώσεις”, Εκδόσεις Παρατηρητής, Θεσσαλονίκη 1986
- ↑ Lonsdale, K. (1929). «The Structure of the Benzene Ring in Hexamethylbenzene». Proceedings of the Royal Society 123A: 494.
- ↑ Lonsdale, K. (1931). «An X-Ray Analysis of the Structure of Hexachlorobenzene, Using the Fourier Method». Proceedings of the Royal Society 133A (822): 536–553. doi:. Bibcode: 1931RSPSA.133..536L. http://gallica.bnf.fr/ark:/12148/bpt6k56226p/f558.table.
- ↑ Eric D. Glendening, Rudiger Faust, Andrew Streitwieser, K. Peter C. Vollhardt, Frank Weinhold: The role of delocalization in benzene. In: Journal of the American Chemical Society, 1993, 115 (23), S. 10952–10957, doi:10.1021/ja00076a061.
- ↑ E. Cox: Crystal Structure of Benzene. In: Reviews of Modern Physics, 1958, 30 (1), S. 159–162, doi:10.1103/RevModPhys.30.159.
- ↑ Artikel Fotografische Bestätigung der Benzol-Strukturformel Αρχειοθετήθηκε 2013-09-27 στο Wayback Machine. auf elektronik.net, abgerufen am 13. Juni 2013.
- ↑ Artikel Atom by Atom, Bond by Bond, a Chemical Reaction Caught in the Act, Pressemitteilung des Lawrence Berkeley National Laboratory, abgerufen am 13. Juni 2013.
- ↑ «Unicode Character 'BENZENE RING' (U+232C)». fileformat.info. Ανακτήθηκε στις 16 Ιανουαρίου 2009.
- ↑ «Unicode Character 'BENZENE RING WITH CIRCLE' (U+23E3)». fileformat.info. Ανακτήθηκε στις 16 Ιανουαρίου 2009.
- ↑ Τα δεδομένα προέρχονται εν μέρει από το «Table of periodic properties of thw Ellements», Sagrent-Welch Scientidic Company και Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, Σελ. 34.
- ↑ Δεσμός 6 κέντρων και 6 ηλεκτρονίων
- ↑ See:
- Wilhelm Körner (1867) "Faits pour servir à la détermination du lieu chimique dans la série aromatique" (Facts to be used in determining chemical location in the aromatic series), Bulletins de l'Académie royale des sciences, des lettres et des beaux-arts de Belgique, 2nd series, 24 : 166–185 ; see especially p. 169. From p. 169: "On distingue facilement ces trois séries, dans lesquelles les dérivés bihydroxyliques ont leurs terms correspondants, par les préfixes ortho-, para- et mêta-." (One easily distinguishes these three series – in which the dihydroxy derivatives have their corresponding terms – by the prefixes ortho-, para- and meta-.)
- Hermann von Fehling, ed., Neues Handwörterbuch der Chemie [New concise dictionary of chemistry] (Braunschweig, Germany: Friedrich Vieweg und Sohn, 1874), vol. 1, p. 1142.
- ↑ Graebe (1869) "Ueber die Constitution des Naphthalins" (On the structure of naphthalene), Annalen der Chemie und Pharmacie, 149 : 20–28 ; see especially p. 26.
- ↑ Victor Meyer (1870) "Untersuchungen über die Constitution der zweifach-substituirten Benzole" (Investigations into the structure of di-substituted benzenes), Annalen der Chemie und Pharmacie, 156 : 265–301 ; see especially pp. 299–300.
- ↑ 45,0 45,1 Hillis O. Folkins "Benzene" Ullmann’s Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005.doi:10.1002/14356007.a03_475
- ↑ Sicherheitsdatenblatt firstfuelbank Αρχειοθετήθηκε 2007-09-28 στο Wayback Machine. (PDF; 36 kB) Stand: Februar 2003.
- ↑ EPA: Summary and Analysis of the 2009 Gasoline Benzene Pre-Compliance Reports. (PDF; 389 kB) November 2009.
- ↑ Felicity Barringer: E.P.A. Limits the Benzene in Gasoline by 2011. Artikel in der New York Times vom 10. Februar 2007.
- ↑ Umweltbundesamt: DATEN ZUR UMWELT: Der Zustand der Umwelt in Deutschland Ausgabe 2005, abgerufen am 27. Dezember 2015 (pdf).
- ↑ «Heterocyclic Chemistry: Heterocyclic Compounds». Michigan State University, Department of Chemistry.
- ↑ Speight J. G., “Chemical and Process Design Handbook”, McGraw-Hill, 2002
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982 ,σελ. 359, §16.4.2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982 ,σελ. 359, §16.4.3.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982 ,σελ. 359, §16.4.5.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982 ,σελ. 359, §16.4.6α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982 ,σελ. 359, §16.4.6b.
- ↑ Ηλεκτρονική Εγκυκλοπαίδεια “Επιστήμη & Ζωή”
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- ↑ 59,0 59,1 59,2 59,3 59,4 59,5 59,6 59,7 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 360, §16.5.1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 360, §16.5.2.
- ↑ 61,0 61,1 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 360, §16.5.3.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 360, §16.5.5.
- ↑ Το Βενζόλιο στην αγγλική έκδοση της Βικιπαίδειας.
