Εξάνιο
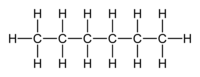
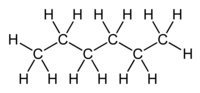
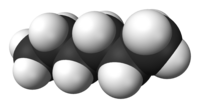
Το (κανονικό) εξάνιο [ αγγλικά: (n-)hexane] είναι οργανική ένωση με μοριακό τύπο C6H14, αν και λόγω της ύπαρξης ισομερών, χρησιμοποιούνται περισσότερο ημισυντακτικοί τύποι, συχνά με τη χρήση συντομογραφικών συμβολισμών, όπως Pr2 και CH3(CH2)4CH3. Το χημικά καθαρό εξάνιο, στις «κανονικές συνθήκες περιβάλλοντος», δηλαδή σε θερμοκρασία 25 °C και υπό πίεση 1 atm, είναι άχρωμο και άοσμο υγρό, με (κανονική) θερμοκρασία βρασμού περίπου 70 °C. Τα εξάνια (γενικά) συναποτελούν σημαντικά συστατικά της βενζίνης, αν και το ίδιο το (κανονικό) εξάνιο είναι μάλλον ανεπιθύμητο συστατικό για βενζινοκινητήρες, αφού έχει βαθμό οκτανίου μόλις 26. Χρησιμοποιείται όμως, με ή χωρίς τα ισομερή του, ευρύτατα ως ένας σχετικά φθηνός, ασφαλής, σε μεγάλο βαθμό χημικά αδρανής και πτητικός μη πολικός διαλύτης.
| Εξάνιο | |||
|---|---|---|---|

| |||
| |||
| |||

| |||
| |||
| Γενικά | |||
| Όνομα IUPAC | Εξάνιο | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | C6H14 | ||
| Μοριακή μάζα | 86,178 g/mol | ||
| Σύντομος συντακτικός τύπος |
CH3(CH2)4CH3 | ||
| Συντομογραφίες | BuEt, Pr2 | ||
| Αριθμός CAS | 110-54-3 | ||
| SMILES | CCCCCC | ||
| InChI | 1/C6H14/c1-3-5-6-4-2/h3-6H2,1-2H3 | ||
| Αριθμός RTECS | MN9275000 | ||
| PubChem CID | 8058 | ||
| ChemSpider ID | 7767 | ||
| Ισομέρεια | |||
| Ισομερή θέσης | 4 2-μεθυλοπεντάνιο 3-μεθυλοπεντάνιο 2,2-διμεθυλοβουτάνιο 2,3-διμεθυλοβουτάνιο | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | −95 °C | ||
| Σημείο βρασμού | 69 °C | ||
| Πυκνότητα | 654,8 kg/m3 | ||
| Διαλυτότητα στο νερό |
13 g/m3 (20 °C) | ||
| Εμφάνιση | Άχρωμο υγρό | ||
| Χημικές ιδιότητες | |||
| Βαθμός οκτανίου | 26 | ||
| Βαθμός κετανίου | 42 | ||
| Ελάχιστη θερμοκρασία ανάφλεξης |
-23.3 °C | ||
| Σημείο αυτανάφλεξης | 233.9 ° | ||
| Επικινδυνότητα | |||
  
| |||
| Eύφλεκτο (F), Επιβλαβές (Xn), Τοξικό για τους υδρόβιους οργανισμούς (N) | |||
| Φράσεις κινδύνου | R11, R38, R48/20, R62, R65, R67, R51/53 | ||
| Φράσεις ασφαλείας | S2, S9, S16, S29, S33, S36/37, S61, S62 | ||
| MSDS | Σύνδεσμος MSDS | ||
| Κίνδυνοι κατά NFPA 704 |
|||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Είναι επίσης συστατικό της βενζινόκολλας, που χρησιμοποιείται (μεταξύ άλλων) στην κατασκευή υποδημάτων και άλλων δερμάτινων προϊόντων. Χρησιμοποιείται, ακόμη, στον καθαρισμό και ιδιαίτερα στην απομάκρυνση ελαίων και γράσων από δερμάτινα και υφασμάτινα προϊόντα. Η χρήση αυτή επεκτείνεται και εργαστηριακά για την απομάκρυνση παρόμοιων ουσιών από δείγματα υδατικά και εδάφους, ως μέρος της προετοιμασίας τους για βαρυμετρική ανάλυση και αέρια χρωματογραφία.
Άλλες χρήσεις του όρου «εξάνιο»
ΕπεξεργασίαΟ όρος «εξάνιο» μπορεί να αναφέρεται επίσης και στα υπόλοιπα τέσσερα (4) ισομερή θέσης του (κανονικού) εξανίου, ή και σε μείγματα των πέντε (5) ισομερών εξανίων[1]. Ωστόσο, αυστηρά με βάση την κατά IUPAC ονοματολογίας οργανικών ενώσεων, ο όρος «εξάνιο» αναφέρεται ειδικά και μόνο στο μη διακλαδισμένο (κανονικό) εξάνιο, ενώ τα υπόλοιπα ισομερή ονομάζονται ως μεθυλιωμένα παράγωγα του πεντανίου και του βουτανίου. Η ονοματολογία κατά IUPAC χρησιμοποιεί επίσης τον όρο «εξάνιο» και για να εκφράσει, μαζί με τα κατάλληλα προθέματα, μια σειρά από δομικά παράγωγα του εξανίου, όπως το 2-μεθυλεξάνιο.
Τέλος, υπάρχει το κυκλοεξάνιο και διάφορα παράγωγά του.
Ονοματολογία
ΕπεξεργασίαΗ ονομασία «εξάνιο» προέρχεται από την ονοματολογία κατά IUPAC. Συγκεκριμένα, το πρόθεμα «εξ-» δηλώνει την παρουσία έξι (6) ατόμων άνθρακα ανά μόριο της ένωσης, το ενδιάμεσο «-αν-» δείχνει την παρουσία μόνο απλών δεσμών μεταξύ ατόμων άνθρακα στο μόριο και η κατάληξη «-ιο» φανερώνει ότι δεν περιέχει χαρακτηριστικές ομάδες, δηλαδή ότι είναι υδρογονάνθρακας.
Ισομέρεια
ΕπεξεργασίαΜε βάση το χημικό τύπο του προκύπτει ότι η ένωση σχηματίζει τέσσερα (4) ισομερή και συγκεκριμένα τα ακόλουθα:
- 2-μεθυλοπεντάνιο (ισοεξάνιο): CH3CH2CH2CH(CH3)2
- 3-μεθυλοπεντάνιο: CH3CH2CH(CH3)CH2CH3
- 2,2-διμεθυλοβουτάνιο (νεοεξάνιο): CH3CH2C(CH3)3
- 2,3-διμεθυλοβουτάνιο: (CH3)2CHCH(CH3)2
| Συντακτικός τύπος Δομή |
Όνομα IUPAC (ελληνική μορφή) Όνομα |
Μοριακό Βάρος |
Σημείο τήξης (°C, 1 atm) |
Σημείο ζέσεως (°C, 1 atm) |
| κ-εξάνιο εξάνιο |
86,18 | -95,3 | 69 | |
| 2-μεθυλοπεντάνιο ισοεξάνιο |
58,12 | -118 | 60 | |
| 3-μεθυλοπεντάνιο | 58,12 | -153,7 | 64 | |
| 2,2-διμεθυλοβουτάνιο νεοεξάνιο |
58,12 | -128,6 | 49,73 | |
| 2,3-διμεθυλοβουτάνιο | 58,12 | -99,8 | 57,9 |
Όπως φαίνεται από τον παραπάνω πίνακα, τα σημεία ζέσης των ισομερών είναι πολύ κοντινά, αν και γενικά τείνουν να μειώνονται στα διακλαδισμένα. Τα σημεία τήξης διαφέρουν αρκετά περισσότερο και δε φαίνεται να ακολουθούν κάποια τάση[2].
Παραγωγή
ΕπεξεργασίαΒιομηχανικές μέθοδοι
ΕπεξεργασίαΤα εξάνια (γενικά) παράγονται κυρίως από τη διύλιση του αργού πετρελαίου (καθώς και προϊόντων πυρόλυσης βαρέων κλασμάτων αυτού ή και ανακύκλωσης πολυμερών). Η ακριβής σύνθεση του (σχετικού) κλάσματος (διύλισης) εξαρτάται πολύ από την προέλευση του αργού πετρελαίου (ή και των άλλων προϊόντων που τυχόν αναμιγνύονται) καθώς και από τις παραμέτρους της διύλισης. Το βιομηχανικό προϊόν περιέχει περίπου 50% κατά βάρος (κανονικό) εξάνιο, εφόσον το σχετικό κλάσμα έχει σημείο βρασμού 65–70 °C.
Εναλλακτικές μέθοδοι
ΕπεξεργασίαΟι παρακάτω μέθοδοι δεν εφαρμόζονται παραμόνο για ακαδημαϊκούς λόγους
Παρασκευή με αντιδράσεις σύνθεσης: Από πρώτες ύλες με μικρότερη ανθρακική αλυσίδα
Επεξεργασία1. Το εξάνιο είναι συμμετρικό αλκάνιο, αφού αποτελείται από δυο τμήματα προπυλίου (CH3CH2CH2). Αυτό επιτρέπει τη παραγωγή του με τη μέθοδο Wüutz, από προπυλαλογονίδιο (CH3CH2CH2X) και Na[3]:
2. Είναι επίσης εύκολη η σύνθεση με αντίδραση προπυλαλογονίδιου - προπυλολίθιου[4]:
3. Για τον ίδιο λόγο παράγεται και με ηλεκτρόλυση διαλύματος βουτανικού νάτριου(CH3CH2CH2COONa)[5]:
4. Ακόμη, το εξάνιο μπορεί να ληφθεί με επίδραση νατρίου σε βουτανονιτρίλιο (CH3CH2CH2CN)[6]:
Παρασκευή με αντιδράσεις χωρίς αλλαγή ανθρακικής αλυσίδας
ΕπεξεργασίαΜε αναγωγή αλογονούχων ενώσεων
Επεξεργασία1. Με αναγωγή κάποιου (μον)αλοβουτανίου από «υδρογόνο εν τω γεννάσθαι», δηλαδή μέταλλο + οξύ[7]:
ή
ή
2. Με αναγωγή καποιου (μον)αλεξανίου από λιθιοαργιλιοϋδρίδιο (LiAlH4) ή νατριοβοριοϋδρίδιο (NaBH4)[8]:
ή
3. Με αναγωγή κάποιου (μον)ιωδεξανίου από υδροϊώδιο (HI)[9]:
ή
ή
4. Με αναγωγή κάποιου (μον)αλεξανίου από κάποιο σιλάνιο[10], παρουσία τριφθοριούχου βορίου παράγεται βουτάνιo[11]:
ή
ή
5. Αναγωγή κάποιου (μον)αλεξανίου από κάποιο κασσιτεράνιο[12]. Π.χ.[13]:
ή
ή
6 Με αναγωγή από μέταλλα και στη συνέχεια υδρόλυση των παραγόμενων οργανομεταλλικών ενώσεων:
[15]
ή
ή
[17]
ή
ή
Με υδρογόνωση ακόρεστων υδρογονανθράκων
Επεξεργασία
ή
ή
2. Από κάποιο εξίνιο[20]:
ή
ή
3. Από κάποιο εξαδιένιο[19]:
ή
ή
ή
ή
ή
4. Από κάποιο εξατριένιο[19]::
ή
ή
ή
ή
ή
5. Από κάποιο εξενίνιο[19][20]:
ή
ή
ή
ή
ή
ή
6. Από κάποιο εξατετραένιο[19]::
ή
ή
7. Από κάποιο εξαδιενίνιο[19][20]:
ή
ή
ή
ή
8. Από κάποιο εξαδιίνιο[20]::
ή
ή
ή
9. Από εξαπενταένιο[19]::
10. Από εξατριενίνιο[19][20]::
11. Από εξατριίνιο[20]:
Με αναγωγή οξυγονούχων ενώσεων
Επεξεργασία1. Με αναγωγή εξανάλης. Αντίδραση Wolf-Kishner[21]:
2. Με αναγωγή εξανόνης. Αντίδραση Clemmensen[22]:
ή
Με αναγωγή θειούχων ενώσεων
Επεξεργασία1. Με αναγωγή των κατάλληλων θειολών μπορεί να παραχθεί βουτάνιο. Π.χ. από την αναγωγή της 1-βουτανοθειόλης (μέθοδος Raney)[23]:
2. Με αναγωγή των κατάλληλων θειεστέρων μπορεί να παραχθεί βουτάνιο. Π.χ. από την αναγωγή του διεξυλοθειαιθέρα (μέθοδος Raney)[23]:
Παρασκευή με αντιδράσεις αποσύνθεσης με μείωση του μήκους της ανθρακικής αλυσίδας
Επεξεργασία- Με τη θέρμανση αλκαλικού διαλύματος κάποιου επτανικού οξέος[24]:
ή
ή
Φυσικές ιδιότητες
ΕπεξεργασίαΤο n-εξάνιο είναι άχρωμο υγρό[25][26] με ελαφριά χαρακτηριστική οσμή. Ανήκει στην οικογένεια των αλκανίων. Η τάση ατμών του εξανίου αυξάνεται τάχιστα με την άνοδο της θερμοκρασίας και εξισώνεται με 1 atm στο σημείο ζέσης του:
| Θερμοκρασία (°C) | Τάση ατμών (mmHg) |
|---|---|
| -40 | 3,36 |
| -30 | 7,12 |
| -20 | 14,01 |
| -10 | 25,91 |
| 0 | 45,37 |
| 10 | 75,74 |
| 20 | 121,26 |
| 25 | 151,28 |
| 30 | 187,11 |
| 40 | 279,42 |
| 50 | 405,31 |
| 60 | 572,76 |
Χημικές ιδιότητες
ΕπεξεργασίαΟξείδωση
Επεξεργασία1. Όπως όλα τα αλκάνια, το εξάνιο με περίσσεια οξυγόνου καίγεται προς διοξείδιο του άνθρακα και νερό[27]:
2. Παραγωγή υδραερίου:
3. Καταλυτική οξείδωση προς εξανόνη-2 και εξανόνη-3:
- Είναι τα κύρια προϊόντα της καταλυστικής οξείδωσης του εξανίου, αλλά παράγεται και μια μικρή ποσότητα εξανάλης.
Αλογόνωση[31]
Επεξεργασία
- Δραστικότητα των X2: F2 > Cl2 > Br2 > Ι2.
- όπου 0<a,b,c<1, a + b + c = 0, διαφέρουν ανάλογα με το αλογόνο:
- Τα F και Cl είναι πιο δραστικά και λιγότερο εκλεκτικά. Η αναλογία των εξυλαλογονιδίων τους εξαρτάται κυρίως πό τη στατιστική αναλογία των προς αντικατάσταση ατόμων H. Ειδικά γοα το χλώριο θα έχουμε:
- εξυλοχλωρίδιο-1: 6·1 = 6.
- εξυλοχλωρίδιο-2: 4·3,8 = 15,2.
- εξυλοχλωρίδιο-3: 4·3,8 = 15,2.
- Δηλαδή το μίγμα που προκύπτει είναι: 16,5% εξυλοχλωρίδιο-1, 41,8% εξυλοχλωρίδιο-2 και 41,8% εξυλοχλωρίδιο-3.
- Τα Br και I είναι πιο εκλεκτικά και λιγότερο δραστικά. Η αναλογία των εξυλαλογονιδίων μεταβάλλεται προς όφελος των δευτεροταγών (αυτών που το αλογόνο συνδέεται με δευτεροταγές άτομο C, δηλαδή ατόμου C ενωμένου με 2 άλλα άτομα C) εξυλοαλογονίδιων. Ειδικα για το βρώμιο θα έχουμε:
- εξυλοβρωμίδιο-1: 6·1 = 6.
- εξυλοβρωμίδιο-2: 4·82 = 328.
- εξυλοβρωμίδιο-3: 4·82 = 328.
- Δηλαδή το μίγμα που προκύπτει είναι: 0,9% εξυλοβρωμίδιο-1, 49,5% εξυλοβρωμίδιο-2 και 49,5% εξυλοβρωμίδιο-3.
- Ανάλυση του μηχανισμού της χλωρίωσης του CH3(CH2)4CH3:
- 1. Έναρξη: Παράγονται ελεύθερες ρίζες.
- Η απαιτούμενη ενέργεια προέρχεται από το υπεριώδες φως (UV) ή θερμότητα (Δ).
- 2. Διάδοση: Καταναλώνονται οι παλιές ελεύθερες ρίζες, σχηματίζοντας νέες.
- 3. Τερματισμός: Καταναλώνονται μεταξύ τους οι ελεύθερες ρίζες, κατά τη στατιστικά σπάνια περίπτωση της συνάντησής τους.
- Είναι όμως πρακτικά δύσκολο να σταματήσει η αντίδραση στην παραγωγή μονοαλογονοπαραγώγων.
- Αν χρησιμοποιηθούν ισομοριακές ποσότητες CH3(CH2)4CH3 και Χ2 θα παραχθεί μίγμα όλων των X-παραγώγων του CH3(CH2)4CH3.
- Αν όμως χρησιμοποιηθει περίσσεια CH3(CH2)4CH3, τότε η απόδοση τωμ μονοπαραγώγων αυξάνεται πολύ, λόγω της αύξησης της στατιστική πιθανότητας συνάντισης CH3(CH2)4CH3 με X. σε σχέση με την πιθανότητα συνάντισης μονοπαραγώγου και X., που μπορεί να οδηγήσει στην παραγωγή των υπόλοιπων X-παραγώγων.
Παρεμβολή καρβενίων
Επεξεργασία
- Η αντίδραση είναι ελάχιστα εκλεκτική και αυτό σημαίνει ότι κατά προσέγγιση έχουμε;
- Παρεμβολή στους έξι(6) δεσμούς CH2-H: 6
- Παρεμβολή στους τέσσερεις (4) δεσμούς 2-CH-H: 4
- Παρεμβολή στους τέσσερεις (4) δεσμούς 3-CH-H: 4
Προκύπτει επομένως μίγμα επτανίου ~43%, 2-μεθυλορξανίου ~29% και 3-μεθυλοπεντάνιου ~29%.
Νίτρωση
Επεξεργασία
όπου 0<a,b,c<1, a + b + c = 1.
Καταλυτική ισομερείωση
ΕπεξεργασίαΤο εξάνιο μπορεί να υποστεί καταλυτική ισομερείωση προς ισοξάνιο, 3-μεθυλοπεντάνιο, νεοεξάνιο και 2,3-διμεθυλοβουτάνιο:
Εφαρμογές
ΕπεξεργασίαΣτη βιομηχανία, τα εξάνια (γενικά) χρησιμοποιούνται για την παραγωγή βενζινόκολλας για τα παπούτσια, για δερμάτινα προϊόντα και σε οροφές κτισμάτων. Χρησιμοποιούνται ακόμη για την εκχύλιση μαγειρικών ελαίων, όπως το κραμβέλαιο ή το σογιέλαιο, από σπόρους, για τον καθαρισμό και το απογρασσάρισμα μιας ποικιλίας αντικειμένων, καθώς και στην υφαντουργία. Η πιο συνηθισμένη εφαρμογή τους στις ΗΠΑ είναι η εκχύλιση σογιέλαιου και γι' αυτό είναι πιθανό να υπάρχουν κατάλοιπα (εξανίων) σε τρόφιμα που περιέχουν (σογιέλαιο) που έχει παραχθεί με αυτήν την τεχνική, αλλά δεν έχει θεσπιστεί (σχετικός) κανονισμός από το FDA[35][36].
Σε ένα τυπικό εργαστήριο γίνεται χρήση εξανίων για την εκχύλιση ελαίων, και το την απομάκρυνση ρύπων από δείγματα νερού και εδάφους που προορίζονται για ανάλυση[37]. Εφόσον τα εξάνια δεν αποπρωτονιώνονται εύκολα, χρησιμοποιούνται στα εργαστήρια ως διαλύτες για αντιδράσεις που περιλαμβάνονουν πολύ ισχυρές βάσεις, όπως για παράδειγμα στην παραγωγή οργανολιθιακών αντιδραστηρίων. Πιο συγκεκριμένα, τα βουτυλολίθια τυπικά είναι διαθέσιμα με τη μορφή διαλύματός τους σε εξάνιο.
Σε πολλές εφαρμογές, και ιδιαίτερα σε φαρμακευτικά προϊόντα, η χρήση του (κανονικού) εξανίου καταργείται σταδιακά, εξαιτίας της μακροχρόνιας τοξικότητάς του. Συνήθως το εξάνιο αντικαθίσταται από επτάνιο, που δε σχηματίζει 2,5-εξανοδιόνη, η οποία είναι τοξικός μεταβολίτης του εξανίου[38].
Τοξικότητα
ΕπεξεργασίαΗ ακριβής τοξικότητα του εξανίου είναι σχετικά χαμηλή, αν και αποτελεί ένα ήπιο αναισθητικό. Η λήψη υψηλών συγκεντρώσεων εξανίου προκαλεί αρχικά μια ήπια ευφορία, ακολουθούμενη από υπνηλία, κεφαλαλγία (πονοκέφαλο) και ναυτία.
Μακροχρόνια δηλητηρίαση από λήψη μικρότερων συγκεντρώσεων εξανίου παρατηρήθηκε κυρίως σε εργαζόμενους σε υποδηματοποιεία, επιπλοποιεία, αυτοκινητοβιομηχανίες και άλλων μονάδων που χρησιμοποιούν εξάνιο ως διαλύτη ή βενζινόκολλες που περιέχουν εξάνιο. Μερικά από τα συμπτώματα μιας τέτοιας δηλητηρίασης είναι κράμπες στα χέρια και στα πόδια, ακολουθούμενες από γενική μυϊκή αδυναμία. Σε σοβαρότερες περιπτώσεις (πιο μακροχρόνια επίδραση ή και επίδραση μεγαλύτερων συγκεντρώσεων) παρατηρείται ατροφία των σκελετικών μυών και προβλήματα με την όραση.
Η νευροπαθητική τοξικότητα του εξανίου στους ανθρώπους είναι καλά τεκμηριωμένη[39]. Έχουν παρατηρηθεί τυπικές περιπτώσεις πολυνευροπάθειας σε ανθρώπους με μακροχρόνια έκθεση σε επίπεδα εξανίου από 400-600 ppm, με περιστασιακές εκθέσεις ως και 2.500 ppm.
Παρόμοια συμπτώματα παρατηρήθηκαν και σε πειραματόζωα. Το εξάνιο έχει συνδεθεί με αποδομιση του περιφερειακού και του κεντρικού νευρικού συστήματος, αρχίζοντας από τα άκρα προς το κέντρο. Η τοξικότητα του εξανίου δεν αποδίδεται στο ίδιο το εξάνιο, αλλά σε έναν από τους μεταβολίτες του, την εξανοδιόνη-2,5. Πιστεύεται ότι αντιδρά με τις πλευεικές αμινομάδες της λυσίνης διαφόρων πρωτείνών, μεταβάλλοντας την πρωτοτοταγή και άρα και την ανώτερη δομή τους προκαλώντας απώλεια της λειτουργικότητάς τους.
Τα αποτελέσματα της δηλητηρίασης ανθρώπων από εξάνιο είναι αβέβαια. Το 1994 περιλαμβανόταν στη λίστα με τις χημικές ουσίες του Toxic Release Inventory (TRI).[40]. Αργότερα όμως συνέβηκέ και ένας αριθμός εκρήξεων ατμών εξανίου. Το 2001 το U.S. Environmental Protection Agency εξέδωσε κανονισμούς για τον περιορισμό της έκθεσης ανθρώπων σε ατμούς εξανίου, αποδίδοντάς του και καρκινογόνες ιδιότητες.[41]
Αναφορές - Παρατηρήσεις
Επεξεργασία- ↑ "C5 and C6 alkanes". A and B Scott Organic Chemistry. Retrieved 30 October 2007.
- ↑ 2,0 2,1 William D. McCain (1990). The properties of petroleum fluids. PennWell. ISBN 0-87814-335-1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.2.2α, R = CH3CH2CH2
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 187, §7.3.5
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.2.3b, R = CH3CH2CH2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.2.2α, R = CH3CH2CH2, X = CN
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.2.1β., με R = CH3CH2CH2CH2CH2 ή CH3CH2CH2CHCH3 ή CH3CH2CHCH2CH3
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, §6.2.1α., με R = CH3CH2CH2CH2CH2 ή CH3CH2CH2CHCH3 ή CH3CH2CHCH2CH3
- ↑ Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991, σελ.14, §1.1
- ↑ Σημείωση: Οποιοδήποτε σιλάνιο είναι κατάλληλο, αρκεί να περιέχει δεσμό Si-H.
- ↑ Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991, σελ. 291-293, §19.1.
- ↑ Σημείωση: Οποιοδήποτε κασσιτεράνιο είναι κατάλληλο, αρκεί να περιέχει δεσμό Sn-H.
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, Σελ. 42, §4.3.
- ↑ Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991, σελ.80-82, §5.1-5.2
- ↑ όπου |Εt2Ο| : άνυδρος διαιθυλαιθέρας
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.2.4α., με R = CH3CH2CH2CH2CH2 ή CH3CH2CH2CHCH3 ή CH3CH2CHCH2CH3
- ↑ αντιδρασήριο Grignard
- ↑ cis- και trans-
- ↑ 19,0 19,1 19,2 19,3 19,4 19,5 19,6 19,7 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.2.5.
- ↑ 20,0 20,1 20,2 20,3 20,4 20,5 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 158, §6.9.4α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.7.6β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.7.6α, R = CH3CH2CH2CH2, R' = CH3 ή R = CH3CH2CH2, R' = CH3CH2
- ↑ 23,0 23,1 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.269, §11.6B7.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.2.3α., με R = CH3CH2CH2CH2CH2CH2 ή CH3CH2CH2CH2CHCH3 ή CH3CH2CH2CHCH2CH3
- ↑ "Organic Chemistry-I" (PDF). Retrieved 2014-02-17.
- ↑ "13. Hydrocarbons | Textbooks". Textbook.s-anand.net. Retrieved 2014-02-17.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 155, §6.7.1, v = 6 και μετατροπή μονάδας ενέργειας σε kJ.
- ↑ ΔHC-C= +347 kJ/mol
- ↑ ΔHC-H = +415 kJ/mol
- ↑ ΔHO-O=+146 kJ/mol
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.7.1β., με R = CH3CH2CH2CH2CH2CH2 ή CH3CH2CH2CH2CHCH3 ή CH3CH2CH2CHCH2CH3
- ↑ καθοριστικό ταχύτητας
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 155, §6.7.3, R = CH3CH2CH2CH2CH2CH2 ή CH3CH2CH2CH2CHCH3 ή CH3CH2CH2CH2CHCH2CH3.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 244 , §10.3.2, R = CH3CH2CH2CH2CH2CH2 ή CH3CH2CH2CH2CHCH3 ή CH3CH2CH2CHCH2CH3.
- ↑ «Αρχειοθετημένο αντίγραφο». Αρχειοθετήθηκε από το πρωτότυπο στις 17 Μαρτίου 2015. Ανακτήθηκε στις 9 Μαρτίου 2015.
- ↑ http://www.slate.com/articles/news_and_politics/explainer/2010/04/is_your_veggie_burger_killing_you.html
- ↑ Use of ozone depleting substances in laboratories. TemaNord 2003:516.
- ↑ Filser JG, Csanády GA, Dietz W, Kessler W, Kreuzer PE, Richter M, Störmer A (1996). "Comparative estimation of the neurotoxic risks of n-hexane and n-heptane in rats and humans based on the formation of the metabolites 2,5-hexanedione and 2,5-heptanedione". Adv Exp Med Biol 387: 411–427. PMID 8794236.
- ↑ Hathaway GJ, Proctor NH, Hughes JP, and Fischman M (1991). Proctor and Hughes' chemical hazards of the workplace. 3rd ed. New York, NY: Van Nostrand Reinhold.
- ↑ «N-Hexane Chemical Backgrounder». National Safety Council. Αρχειοθετήθηκε από το πρωτότυπο στις 29 Ιουνίου 2007. Ανακτήθηκε στις 25 Μαΐου 2007. Unknown parameter
|dateformat=ignored (βοήθεια) - ↑ Anuradee Witthayapanyanon and Linh Do. «Nanostructured Microemulsions as Alternative Solvents to VOCs in Cleaning Technologies and Vegetable Oil Extraction». National Center For Environmental Research. Αρχειοθετήθηκε από το πρωτότυπο στις 28 Φεβρουαρίου 2009. Ανακτήθηκε στις 25 Μαΐου 2007. Unknown parameter
|dateformat=ignored (βοήθεια)
Πηγές
Επεξεργασία- Χημικές ιδιότητες του εξανίου Αρχειοθετήθηκε 2013-04-11 στο Wayback Machine.
- Η σελίδα της Ε.Ε. για την ταξινόμηση και την επισήμανση των επικίνδυνων ουσιών.
- Τεχνικό δελτίο δεδομένων n-εξανίου από την Shell Chemicals[νεκρός σύνδεσμος]
- Παπαγεωργίου Β.Π., “Εφαρμοσμένη Οργανική Χημεία: Άκυκλες Ενώσεις”, Εκδόσεις Παρατηρητής, Θεσσαλονίκη 1986.
- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Μερικές από τις ενέργειες αντιδράσεων υπολογίστηκαν με χρήση κατάλληλου λογισμικού. Θα διασταυρωθούν και βιβλιογραφικά το συντομότερο για μεγαλύτερη ακρίβεια.
