Τετραφθοριούχο σελήνιο
Το τετραφθοριούχο σελήνιο ή τετραφθοροσελήνιο (αγγλικά: Selenium tetrafluoride) είναι ανόργανη χημική ένωση, που περιέχει σελήνιο και φθόριο, με μοριακό τύπο SeF4. Το χημικά καθαρό τετραφθοριούχο σελήνιο, στις κανονικές συνθήκες περιβάλλοντος, δηλαδή σε θερμοκρασία 25°C και υπό πίεση 1 atm, είναι άχρωμο υγρό, που αντιδρά γρήγορα με το νερό. Χρησιμοποιείται ως φθοριωτικό μέσο σε οργανικές συνθέσεις, δηλάδή στη φθορίωση αλκοολών, καρβοξυλικών οξέων ή καρβονυλικών ενώσεων, υπερέχοντας έναντι του τετραφθροιούχου θείου (SF4) στο ότι σε ήπιες συνθήκες βρίσκεται στην υγρή κατάσταση και όχι στην αέρια (δηλαδή είναι πιο εύχρηστο).
| Τετραφθοριούχο σελήνιο | |||
|---|---|---|---|

| |||
| |||
| Γενικά | |||
| Όνομα IUPAC | Τετραφθοριούχο σελήνιο | ||
| Άλλες ονομασίες | Τετραφθοροσελήνιο | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | SeF4 | ||
| Μοριακή μάζα | 154,954 amu | ||
| Αριθμός CAS | 13465-66-2 | ||
| SMILES | F[Se](F)(F)F | ||
| InChI | 1S/F4Se/c1-5(2,3)4 | ||
| PubChem CID | 123311 | ||
| ChemSpider ID | 109914 | ||
| Δομή | |||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | −13,2°C | ||
| Σημείο βρασμού | 101°C | ||
| Πυκνότητα | 2.770 kg/m³ | ||
| Χημικές ιδιότητες | |||
| Επικινδυνότητα | |||
| Κίνδυνοι κατά NFPA 704 |
|||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Παραγωγή
ΕπεξεργασίαΗ πρώτη σύνθεση τετραφθοριούχου σεληνίου που αναφέρθηκε έγινε το 1907 από τον Πωλ Λαμπεώ (Paul Lebeau), ο οποίος χρησιμοποίησε τη μέθοδο την ολικής σύνθεσης, δηλαδή με απευθείας αντίδραση σεληνίου και φθορίου:[1]
Μια σύνθεση που εμπλέκει πιο ευκολόχρηστα αντιδραστήρια είναι η μέθοδος φθορίωσης διοξειδίου του σεληνίου (SeO2) με τετραφθοριούχο θείο:[2]
Ενδιάμεσα παράγεται σεληνονυλοφθορίδιο (SeOF2). Μια άλλη διαθέσιμη μέθοδος είναι η φθορίωση στοιχειακού σεληνίου από τριφθοριούχο χλώριο (ClF3):
Δομή και δεσμολογία
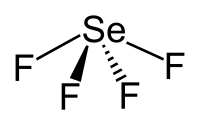
ΕπεξεργασίαΤο σελήνιο στο τετραφθοριούχο σελήνιο έχει βαθμό οξείδωσης +4. Η μοριακή γεωμετρία της ένωσης στην αέρια φάση είναι παρόμοια με αυτήν του τετραφθοριούχου θείου, έχοντας σχήμα τραμπάλας. Η θεωρία σθένους-απώθησης ζευγών ηλεκτρονίων στιβάδας (Valence Shell Electron Pair Repulsion, VSEPR theory) προβλέπει δομή ψευδοτριγωνικής πυραμίδας, εφόσον υπάρχουν πέντε (5) ηλεκτρονιακά ζεύγη γύρω από το άτομο σεληνίου (4 από τους δεσμούς με τα ισάριθμα άτομα φθορίου + 1 μονήρες, δηλαδή μη εμπλεκόμενο σε χημικό δεσμό, ζεύγος που περισσεύει στο άτομο του σεληνίου). Οι δύο (2) «αξονικοί» δεσμοί F-Se-F έχουν μήκος 177 pm και δεσμική γωνία 169,2°, ενώ τα δυο άλλα άτομα φθορίου ενώνονται με βραχύτερους δεσμούς (168 pm) και έχουν δεσμική γωνία 100,6°. Σε (σχετικά) αραιά διαλύματα η παραπάνω αναφερόμενη μονομερική δομή, επίσης, κυριαρχεί. αλλά σε υψηλότερες συγκεντρώσεις (και στην υγρή κατάσταση της καθαρής ένωσης), οι ενδείξεις προτείνουν ότι η ασθενής διαμοριακή έλξη μεταξύ των μονομερών μορίων οδηγεί στο σχηματισμό διεστραμένης οκταεδρικής συναρμογής γύρω από κάθε άτομο σεληνίου. Στη στερεή κατάσταση επίσης τα άτομα σελήνίου βρίσκονται στο κέντρο περιβάλλοντος διεστραμένου οκταέδρου.
Φυσικές ιδιότητες
ΕπεξεργασίαΤο (χημικά καθαρό) τετραφθοριούχο σελἠνιο (στις κανονικές συνθήκες περιβάλλοντος) είναι άχρωμο υγρό αναμείξιμο με το θειικό οξύ (H2SO4), την αιθανόλη (|EtOH|), το διαιθυλαιθέρα (|Et2O|) και το πενταφθοριούχο ιώδιο (IF5).
Χημική συμπεριφορά
ΕπεξεργασίαΣε (υγρό) υδροφθόριο το τετραφθοριούχο σελήνιο συμπεριφέρεται ως ασθενής βάση (με Kb= 4·10−4), ακόμη ασθενέστερη από το τετραφθοριούχο θείο (που έχει Kb= 2·10−2):
Ιονικά σύμμπλοκα που περιέχουν το SeF3+ (τριφθοριούχο σεληνιοκατιόν) σχηματίζονται επίσης με τις ενώσες SbF5 (πενταφθοριούχο αντιμόνιο), AsF5 (πενταφθοριούχο αρσενικό), NbF5 (πενταφθοριούχο νιόβιο), TaF5 (πενταφθοριούχο ταντάλιο) και BF3 (τριφθοριούχο βόριο). [3] Αντίθετα, με το φθοριούχο καίσιο (CsF) σχηματίζεται το SeF5- (πενταφθοριούχο σεληνιανιόν), που έχει δομή τετραγωνικής πυραμίδας, δηλαδή όμοια με το ισοηλεκτρονικό με το πενταφθοριούχο χλώριο (ClF5) και με το πενταφθοριούχο βρώμιο (BrF5).[4] Με τις ενώσεις φθοριούχο 1,1,3,3,5,5-εξαμεθυλοπιπεριδινιώνιο και φθοριούχο (1,2-διμεθυλοπροπυλο)τριμεθυλαμμώνιο {[Me3CCH(Me)NMe3]F}, σχηματίζεται το SeF62- (εξαφθοροσεληνοδιανιόν). Το τελευταίο έχει δομή διεστραμμένου οκταέδρου. σε αντιδιαστολή με τη δομή κανονικού οκταέδρου που έχει το ανάλογο SeCl62- (εξαχλωροσεληνοδιανιόν).[5]
Το τετραφθοριούχο σελήνιο υδρολύεται, σύμφωνα με την ακόλουθη αντίδραση:
Σε οργανικές συνθέσεις, το τετραφθοριούχο σελήνιο χρησιμοποιείται για να μετατρέπει τις ομάδες -COH και >C=O σε -CF και >CF2, αντιστοίχως:[6]
Παρατηρήσεις, υποσημειώσεις και αναφορές
Επεξεργασία- ↑ Paul Lebeau (1907). «Action of Fluorine on Selenium Tetrafluoride of Selenium». Comptes Rendus Acad. Sci., Paris 144: 1042.
- ↑ Konrad Seppelt, Dieter Lentz, Gerhard Klöter "Selenium Tetrafluoride, Selenium Difluoride Oxide (Seleninyl Fluoride), and Xenon Bis[Pentafluorooxoselenate(VI)]"Inorg. Synth, 1987, vol. 24, 27-31. doi:10.1002/9780470132555.ch9
- ↑ R. J. Gillespie; A. Whitla (1970). «Selenium tetrafluoride adducts. II. Adducts with boron trifluoride and some pentafluorides». Can. J. Chem. 48 (4): 657–663. doi:.
- ↑ K. O. Christe; E. C. Curtis; C. J. Schack; D. Pilipovich (1972). «Vibrational Spectra and Force Constants of the Square-Pyramidal Anions SF5−, SeF5−, and TeF5−». Inorganic Chemistry 11 (7): 1679–1682. doi:.
- ↑ Ali Reza Mahjoub; Xiongzhi Zhang; Konrad Seppelt (1995). «Reactions of the Naked Fluoride Ion: Syntheses and Structures of SeF62− and BrF6−». Chemistry: A European Journal 1 (4): 261–265. doi:.
- ↑ Hasek, W. R., «1,1,1-Trifluoroheptane», Org. Synth., http://www.orgsyn.org/orgsyn/orgsyn/prepContent.asp?prep=cv5p1082; Coll. Vol. 5: 1082. Προσαρμογή για το τετραφθοριούχο σελήνιο.
