1,1-διφθοραιθάνιο
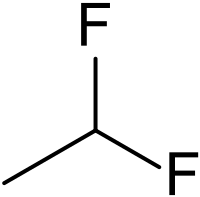
To 1,1-διφθοραιθάνιο[1] (αγγλικά: 1,1-difluoroethane) είναι οργανική χημική ένωση, που περιέχει άνθρακα, υδρογόνο και φθόριο, με μοριακό τύπο C2H4F2, αλλά συχνά αποδίδεται με τον ημισυντακτικό τύπο CH3CHF2. Με βάση το σύστημα κωδικής ονομασίας που ξεκίνησε με τους φθοροχλωράνθρακες έχει τον κωδικό HFC-152a ή R-152a. Ανήκει στα διαλαλκάνια, δηλαδή στους άκυκλους και κορεσμένους διαλυδρονάνθρακες. Το χημικά καθαρό 1,1-διφθοραιθάνιο, στις «συνηθισμένες συνθήκες», δηλαδή θερμοκρασία 25 °C και υπό πίεση 1 atm, είναι άχρωμο αέριο. Με βάση το χημικό τύπο του έχει ένα (1) ισομερές θέσης, το 1,2-διφθοραιθάνιο. Χρησιμοποιήθηκε ως ψυκτικό. Είναι εναλλακτικό απέναντι στους φθοροχλωράνθρακες (CFC), γιατί έχει μηδενικό δυναμικό καταστροφής όζοντος, χαμηλότερο δυναμικό παγκόσμιας θέρμανσης (120), καθώς και βραχύτερη ατμοσφαιρική «διάρκεια ζωής» (1,4 έτη)[2]. Πρόσφατα εγκρίθηκε για χρήση σε εφαρμογές αυτοκινήτων, ως εναλλακτικό του R-134a (δηλαδή του 1,1,1,2-τετραφθοραιθάνιου).
| 1,1-διφθοραιθάνιο | |||
|---|---|---|---|
| |||

| |||

| |||
| Γενικά | |||
| Όνομα IUPAC | 1,1-διφθοραιθάνιο | ||
| Άλλες ονομασίες | Αιθυλιδενοδιφθορίδιο Φρεόν 152α | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | C2H4F2 | ||
| Μοριακή μάζα | 66,05 amu | ||
| Σύντομος συντακτικός τύπος |
CH3CHF2 | ||
| Συντομογραφίες | HFC-152a R-152a DFE | ||
| Αριθμός CAS | 75-37-6 | ||
| SMILES | FC(F)C | ||
| InChI | 1S/C2H4F2/c1-2(3)4/h2H,1H3 | ||
| Αριθμός RTECS | KI1410000 | ||
| Αριθμός UN | 0B1U8K2ME0 | ||
| PubChem CID | 6368 | ||
| ChemSpider ID | 6128 | ||
| Ισομέρεια | |||
| Ισομερή θέσης | 1 1,2-διφθοραιθάνιο | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | −117°C | ||
| Σημείο βρασμού | -25°C | ||
| Πυκνότητα | 2,7014 kg/m³ | ||
| Διαλυτότητα στο νερό |
0,54% @ 0°C | ||
| Ιξώδες | 0,00887 cP | ||
| Τάση ατμών | 510 kPa @ 20 °C 536 kPa @ 21,1°C | ||
| Χημικές ιδιότητες | |||
| Επικινδυνότητα | |||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Ονοματολογία και ισομέρεια
ΕπεξεργασίαΗ ονομασία «1,1-διφθοραιθάνιο» προέρχεται από την ονοματολογία κατά IUPAC. Συγκεκριμένα, το πρόθεμα «αιθ-» δηλώνει την παρουσία δύο (2) ατόμων άνθρακα ανά μόριο της ένωσης, το ενδιάμεσο «-αν-» δείχνει την παρουσία μόνο απλών δεσμών μεταξύ ατόμων άνθρακα στο μόριο και η κατάληξη «-ιο» φανερώνει ότι δεν περιέχει χαρακτηριστικές ομάδες που έχουν χαρακτηριστικές καταλήξεις. Τo αρχικό πρόθεμα «διφθορο-» δηλώνει την παρουσία δύο (2) ατόμων φθορίου ανά μόριο της ένωσης. Τέλος, οι αριθμοί θέσης (1,1-) δείχνουν ότι και τα δυο άτομα φθορίου βρίσκονται ενωμένα με το ίδιο (#1) άτομο άνθρακα της ένωσης. Αυτό βοηθά στη διάκριση της ένωσης από την ισομερή της, 1,2-διφθοραιθάνιο.
Ο κωδικός HFC-152a παράγεται ως εξής: Το HFC προέρχεται από την αγγλόφωνη λέξη HydroFluoroCarbon. Το πρώτο ψηφίο (1) σημαίνει ότι η ένωση περιέχει 1+1 = 2 άτομα άνθρακα (ανά μόριο). Το δεύτερο ψηφίο (5) σημαίνει ότι η ένωση περιέχει 5 - 1 = 4 άτομα υδρογόνου. Και, τέλος, το τελευταίο ψηφίο (2), σημαίνει ότι η ένωση περιέχει δύο (2) άτομα φθορίου. Επειδή με βάση το μοριακό τύπο (C2H4F2) η ένωση έχει δύο (2) ισομερή θέσης, το 1,1-διφθοραιθάνιο και το 1,2-διφθοραιθάνιο, χρειάζεται η χρήση του ψηφίου «a», για να προσδιοριστεί ότι εννοείται το 1,1-διφθοραιθάνιο και όχι το ισομερές του.
Μοριακή δομή
ΕπεξεργασίαΗ μοριακή δομή της ένωσης αντιστοιχεί γεωμετρικά με δυο (2) κατά κορυφή ενωμένα τετράεδρα, με τα άτομα άνθρακα στα δυο κέντρα των τετραέδρων, και με τα υπόλοιπα 6 άτομα, 4 υδρογόνου και 2 φθορίου, στις δυο βάσεις των τετραέδρων. Η δομή αυτή ομοιάζει με αυτήν του αιθανίου.
Παραγωγή
ΕπεξεργασίαΜε προσθήκη σε αιθίνιο
ΕπεξεργασίαΤο 1,1-διφθοραιθάνιο παράγεται με καταλυόμενη από υδράργυρο προσθήκη υδροφθορίου σε αιθίνιο[4][5]:
Όπως φαίνεται και από την παραπάνω στοιχειομετρική εξίσωση, ενδιάμεσα σχηματίζεται φθοραιθένιο, που είναι η μονομερής πρόδρομη ένωση για το πολυβινυλοφθορίδιο.
Με υποκατάσταση χλωρίου από φθόριο
ΕπεξεργασίαΤο 1,1-διφθοραιθάνιο μπορεί να παραχθεί, επίσης, με επίδραση φθοριούχου υφυδραργύρου (Hg2F2) σε 1,1-διχλωραιθάνιο[6]:
Χημικές ιδιότητες
ΕπεξεργασίαΑντιδράσεις υποκατάστασης
Επεξεργασία- Ελάχιστες αντιδράσεις υποκατάστασης είναι πρακτικά εφικτές, γιατί οι δυο δεσμοί άνθρακα - φθορίου που διαθέτει είναι πολύ ισχυροί και ο μηχανισμός που επικρατεί είναι ο SN2, που πρακτικά απαιτεί αλογόνα με μεγαλύτερη πολωσιμότητα από το φθόριο.
Περιφθορίωση
ΕπεξεργασίαΤο 1,1-διφθοραιθάνιο αντιδρά με το τριφθοριούχο κοβάλτιο (CoF3), αντικαθιστώντας όλα τα άτομα υδρογόνου με άτομα φθορίου. Έτσι παράγεται (κυρίως) εξαφθοραιθάνιο[7]:
Υποκατάσταση από χλώριο
ΕπεξεργασίαΜε χρήση χλωριούχου ασβεστίου (CaCl2) είναι δυνατή η μερική ή και η ολική αντικατάσταση του φθορίου, επειδή η καθίζηση του δυσδιάλυτου φθοριούχου ασβεστίου (CaF2) μετακινεί τις χημικές ισορροπίες προς τα δεξιά.
Υποκατάσταση από φαινύλιο
ΕπεξεργασίαΜε επίδραση τύπου Friedel-Crafts σε βενζολίου παράγεται αρχικά (1-φθοραιθυλο)βενζόλιο, και στη συνέχεια, με περίσσεια βενζολίου, προς 1,1-διφαινυλαιθάνιο[8]:
Αναγωγή
Επεξεργασία1. Με LiAlH4, παράγεται αιθάνιο[9]:
2. Με «υδρογόνο εν τω γενάσθαι», δηλαδή μέταλλο + οξύ, παράγεται αρχικά φθοραιθάνιο, και στη συνέχεια αιθάνιο[10]:
3. Με σιλάνιο, παρουσία τριφθοριούχου βορίου, παράγεται αιθάνιο[11]:
4. Με αναγωγή από ένα κασσιτεράνιο, παράγεται αιθάνιο. Π.χ.[12]:
Αντιδράσεις προσθήκης
Επεξεργασία1. Σε αλκένια. Π.χ. με αιθένιο (CH2=CH2) παράγει 1,3-διφθοροβουτάνιο[13]:
2. Σε αλκίνια. Π.χ. με αιθίνιο (HC≡CH) παράγει 1,3-διφθορο-1-βουτένιο[14]:
3. Σε κυκλοαλκάνια που έχουν τριμελή ή τετραμελή δακτύλιο. Π.χ. με κυκλοπροπάνιο παράγει 1,4-διφθοροπεντάνιο[15]:
4. Σε αλκαδιένια. Π.χ. με 1,3-βουταδιένιο παράγει (1,4-προσθήκη), 1,5-διφθορο-2-εξένιο[16]:
5. Σε ετεροκυκλικές ενώσεις που έχουν τριμελή ή τετραμελή δακτύλιο. Π.χ. με οξιράνιο παράγει 2-φθορο-1-(1-φθοραιθοξυ)αιθάνιο[17]:
Αντιδράσεις απόσπασης
ΕπεξεργασίαΜε απόσπαση υδροφθορίου (HF) από 1,1-διφθοραιθάνιο παράγεται αρχικά φθοραιθένιο, και στη συνέχεια, με περίσσεια ισχυρής βάσης, αιθίνιο[18]:
Παρεμβολή καρβενίων
Επεξεργασία
- Η αντίδραση είναι ελάχιστα εκλεκτική και αυτό σημαίνει ότι κατά προσέγγιση έχουμε;
- 1. Παρεμβολή στους τρεις (3) δεσμούς CH2-H. Παράγεται 1,1-διφθοροπροπάνιο.
- 2. Παρεμβολή στον δεσμό C-H: 2. Παράγεται 2,2-διφθοροπροπάνιο.
Προκύπτει επομένως μίγμα 1,1-διφθοροπροπάνιου ~75% και 2,2-διφθοροπροπάνιου ~25%.
Εφαρμογές
ΕπεξεργασίαΕπιπρόσθετα από την υπηρεσία του ως ψυκτικό, το 1,1-διφθοραιθάνιο χρησιμοποιήθηκε επίσης συχνά ως προωθητικό αέριο (gas duster) καταναλωτικών προϊόντων αερολυμάτων, ιδιαιτέρως εκείνων των πτητικών οργανικών ενώσεων (VOC = Volatile organic compound(s)), με τις δυσκολότερες απαιτήσεις.
Θέματα ασφάλειας
ΕπεξεργασίαΗ πρακτική της σκόπιμης εισπνοής ή “huffing” εμφυαλωμένου αερίου μπορεί να είναι από εξαιρετικά επικίνδυνη ή και θανατηφόρα. Η σκόπιμη εισπνοή 1,1-διφθοραιθάνιου προκάλεσε θανατηφόρα καρδιακή αρυθμία σε έναν άνδρα 42 ετών[20]. Σε αρκετές αναφορές από θανατηφόρες συγκρούσεις αυτοκινήτων, ο θάνατος συνδέθηκε με την εισπνοή 1,1-διφθοραιθάνιου[21][22][23]. Εξαιτίας της κατάχρησης εισπνοής, ένα πικραντικό προστέθηκε σε καταναλωτικά προϊόντα εμφυαλωμένων αερίων.
Όμως, σε μια μελέτη της εταιρείας Du Pont, αρουραίοι εκτέθηκαν σε πάνω από 25.000 ppm (που αντιστοιχούν σε 67,485 g/m³), για 6 ώρες την ημέρα, πέντε ημέρες την εβδομάδα, επί δυο (2) χρόνια. Το αποτέλεσμα σε αυτήν την έκθεση ήταν η μη παρατήρηση δυσμενών επιπτώσεων σε αυτό το επίπεδο για την συγκεκριμένη ένωση. Μακρόχρονη έκθεση σε 1,1-διφθοραιθάνιο έχει συνδεθεί με την ανάπτυξη στεφανιαία καρδιακής νόσου στους ανθρώπους και στηθάγχη[24].
Παρόλο που δεν είναι εξαιρετικά εύφλεκτο σε μορφή αεριώδους αφρού, το 1,1-διφθοραιθάνιο μπορεί να καεί κάτω από ορισμένες συνθήκες. Γι' αυτό υπάρχει και μια προειδοποιητική επιγραφή σε κάποια προϊόντα με προωθητικά αέρια. Όταν μετατρέπεται σε υγρό πίδακα, το υπό βρασμό αερόλυμα υδροφθοράνθρακα μπορεί εύκολα να γίνει αναφλέξιμο, παράγοντας μια πολύ μεγάλη έκρηξη ή φλόγα και με ορισμένα εξαιρετικά τοξικά αέρια παράγωγα καύσης, όπως το υδροφθόριο και το διφθοριούχο καρβονύλιο (COF2).
Σημειώσεις και αναφορές
Επεξεργασία- ↑ Για εναλλακτικές ονομασίες και συμβολισμούς δείτε τον πίνακα πληροφοριών.
- ↑ Global Warming Potentials of ODS Substitutes". U.S. Environmental Protection Agency. 2010. Archived from the original on 16 October 2010. Retrieved 20 September 2010.
- ↑ Τα δεδομένα προέρχονται εν μέρει από το «Table of periodic properties of thw Ellements», Sagrent-Welch Scientidic Company και Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, Σελ. 34.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 158, §6.9.1., X = F.
- ↑ Siegemund, Günter; Schwertfeger, Werner; Feiring, Andrew; Smart, Bruce; Behr, Fred; Vogel, Herward; McKusick, Blaine (2010). "Fluorine Compounds, Organic". In Bohnet, Matthias; Bellussi, Giuseppe; Bus, James et al. Ullmann's Encyclopedia of Industrial Chemistry. John Wiley & Sons. doi:10.1002/14356007.a11_349.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 185, §7.2.8.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 185, §7.2β, προσαρμογή αντίδρασης για 1,1-διφθοραιθάνιο
- ↑ Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991, §3.2. σελ.54
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 187, §7.3.3α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 187, §7.3.3β.
- ↑ Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991, σελ. 291-293, §19.1.
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, Σελ. 42, §4.3.
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, §6.3., σελ. 79, για Ε = CH3CHF και Nu = F.
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, §6.3., σελ. 79, εφαρμογή για αλκίνια και για Ε = CH3CHF και Nu = F με βάση και την §8.1, σελ. 114-116.
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, §6.3., σελ. 79, εφαρμογή για κυκλοαλκάνια και για Ε = CH3CHF και Nu = F σε συνδυασμό με Ν. Αλεξάνδρου, Α. Βάρβογλη, Δ. Νικολαΐδη: Χημεία Ετεροχημικών Ενώσεων, Θεσσαλονίκη 1985, §1.2., σελ. 22-25
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, §6.3., σελ. 79, εφαρμογή για αλκαδιένια και για Ε = CH3CHF και Nu = F με βάση και την §8.2, σελ. 116-117.
- ↑ Ν. Αλεξάνδρου, Α. Βάρβογλη, Δ. Νικολαΐδη: Χημεία Ετεροχημικών Ενώσεων, Θεσσαλονίκη 1985, §2.1., σελ. 16-17, εφαρμογή γενικής αντίδρασης για Nu = F.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.153, §6.3.1α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 155, §6.7.3
- ↑ Avella J, Wilson JC, Lehrer M (March 2006). "Fatal cardiac arrhythmia after repeated exposure to 1,1-difluoroethane (DFE)". The American Journal of Forensic Medicine and Pathology 27 (1): 58–60. doi:10.1097/01.paf.0000202715.71009.0e. PMID 16501351.
- ↑ Broussard LA, Brustowicz T, Pittman T, Atkins KD, Presley L (November 1997). "Two traffic fatalities related to the use of difluoroethane". Journal of Forensic Sciences 42 (6): 1186–7. PMID 9397568.
- ↑ Hahn T, Avella J, Lehrer M (October 2006). "A motor vehicle accident fatality involving the inhalation of 1,1-difluoroethane". Journal of Analytical Toxicology 30 (8): 638–42. PMID 17132266. Retrieved 6 June 2010.
- ↑ "Autopsy: man in crash died from inhaling computer cleaner". The Times News. 10 March 2012.
- ↑ "1,1-Difluoroethane". National Library of Medicine HSDB Database. 1994. Retrieved 8 June 2010.
Πηγές
Επεξεργασία- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982