Σπερματογένεση
Η σπερματογένεση είναι η διαδικασία με την οποία αναπτύσσονται απλοειδή σπερματοζωάρια από γεννητικά κύτταρα στα σπερματοφόρους σωληνίσκους του όρχεως. Αυτή η διαδικασία ξεκινά με τη μιτωτική διαίρεση των βλαστοκυττάρων που βρίσκονται κοντά στη βασική μεμβράνη των σωληναρίων.[1] Αυτά τα κύτταρα ονομάζονται σπερματογονικά βλαστοκύτταρα. Η μιτωτική διαίρεση αυτών παράγει δύο τύπους κυττάρων. Τα κύτταρα τύπου Α αναπληρώνουν τα βλαστοκύτταρα και τα κύτταρα τύπου Β διαφοροποιούνται σε πρωτογενή σπερματοκύτταρα. Το πρωτογενές σπερματοκύτταρο διαιρείται μειωτικά (Μείωση I) σε δύο δευτερεύοντα σπερματοκύτταρα. Κάθε δευτερογενές σπερματοκύτταρο διαιρείται σε δύο ίσες απλοειδείς σπερματίδες με τη Μείωση II. Τα σπερματοζωάρια μετατρέπονται σε σπερματοζωάρια με τη διαδικασία της σπερμιογένεσης. Αυτά εξελίσσονται σε ώριμα σπερματοζωάρια.[2] Έτσι, το πρωτογενές σπερματοκύτταρο δημιουργεί δύο κύτταρα, τα δευτερεύοντα σπερματοκύτταρα, και τα δύο δευτερεύοντα σπερματοκύτταρα από την υποδιαίρεση τους παράγουν τέσσερα σπερματοζωάρια και τέσσερα απλοειδή κύτταρα.[3]
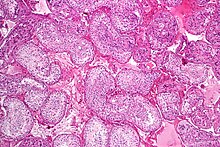

Τα σπερματοζωάρια είναι οι ώριμοι αρσενικοί γαμέτες σε πολλούς οργανισμούς που αναπαράγονται σεξουαλικά. Έτσι, η σπερματογένεση είναι η ανδρική εκδοχή της γαμετογένεσης, της οποίας το θηλυκό ισοδύναμο είναι η ωογένεση. Στα θηλαστικά εμφανίζεται στα σπερματοφόρα σωληνάρια των αρσενικών όρχεων με σταδιακό τρόπο. Η σπερματογένεση εξαρτάται σε μεγάλο βαθμό από τις βέλτιστες συνθήκες για να συμβεί σωστά η διαδικασία και είναι απαραίτητη για τη σεξουαλική αναπαραγωγή. Η μεθυλίωση του DNA και η τροποποίηση ιστόνης έχουν εμπλακεί στη ρύθμιση αυτής της διαδικασίας.[4] Ξεκινά από την εφηβεία και συνήθως συνεχίζεται αδιάκοπα μέχρι το θάνατο, αν και μπορεί να διαπιστωθεί ελαφρά μείωση στην ποσότητα του παραγόμενου σπέρματος με την αύξηση της ηλικίας.
Η σπερματογένεση ξεκινά στο κάτω μέρος των σπερματοφόρων σωληναρίων και, προοδευτικά, τα κύτταρα πηγαίνουν βαθύτερα στα σωληνάρια και κινούνται κατά μήκος τους έως ότου τα ώριμα σπερματοζωάρια φτάσουν στον αυλό, όπου εναποτίθενται τα ώριμα σπερματοζωάρια. Η διαίρεση γίνεται ασύγχρονα: εάν ο σωλήνας κοπεί εγκάρσια παρατηρούνται διαφορετικές καταστάσεις ωρίμανσης. Μια ομάδα κυττάρων με διαφορετικές καταστάσεις ωρίμανσης που δημιουργούνται ταυτόχρονα ονομάζεται κύμα σπερματογένεσης.[5]
Σκοπός
ΕπεξεργασίαΗ σπερματογένεση παράγει ώριμους αρσενικούς γαμέτες, κοινώς ονομαζόμενους σπερματοζωάρια, οι οποίοι είναι σε θέση να γονιμοποιήσουν τον αντίστοιχο θηλυκό γαμέτη, το ωοκύτταρο, κατά τη σύλληψη για να παράγουν ένα μονοκύτταρο άτομο γνωστό ως ζυγώτη. Αυτός είναι ο ακρογωνιαίος λίθος της σεξουαλικής αναπαραγωγής και περιλαμβάνει τους δύο γαμέτες που συνεισφέρουν και οι δύο το ήμισυ του φυσιολογικού συνόλου χρωμοσωμάτων (απλοειδή) για να δημιουργήσουν ένα χρωμοσωμικά φυσιολογικό (διπλοειδή) ζυγώτη.
Για να διατηρηθεί ο αριθμός των χρωμοσωμάτων στους απογόνους – ο οποίος διαφέρει μεταξύ των ειδών – κάθε γαμέτης πρέπει να έχει το μισό από τον συνηθισμένο αριθμό χρωμοσωμάτων που υπάρχουν σε άλλα κύτταρα του σώματος. Διαφορετικά, οι απόγονοι θα έχουν διπλάσιο αριθμό χρωμοσωμάτων από τον κανονικό και μπορεί να προκύψουν σοβαρές ανωμαλίες. Στους ανθρώπους, οι χρωμοσωμικές ανωμαλίες που προκύπτουν από λανθασμένη σπερματογένεση έχουν ως αποτέλεσμα συγγενή ελαττώματα και μη φυσιολογικές γενετικές ανωμαλίες (σύνδρομο Ντάουν, σύνδρομο Κλαϊνφέλτερ) και στις περισσότερες περιπτώσεις, αυτόματη αποβολή του αναπτυσσόμενου εμβρύου.
Τοποθεσία στον άνθρωπο
ΕπεξεργασίαΗ σπερματογένεση λαμβάνει χώρα σε διάφορες δομές του αναπαραγωγικού συστήματος των ανδρών. Τα αρχικά στάδια συμβαίνουν μέσα στους όρχεις και προχωρούν στην επιδιδυμίδα όπου οι αναπτυσσόμενοι γαμέτες ωριμάζουν και αποθηκεύονται μέχρι την εκσπερμάτιση. Τα σπερματοφόρα σωληνάρια των όρχεων είναι το σημείο εκκίνησης της διαδικασίας, όπου τα σπερματογονικά βλαστοκύτταρα δίπλα στο τοίχωμα του εσωτερικού σωληνίσκου διαιρούνται σε κεντρομόλο κατεύθυνση — ξεκινώντας από τα τοιχώματα και προχωρώντας στο πιο εσωτερικό μέρος ή στον αυλό — για να παράγουν ανώριμο σπέρμα.[2] Η ωρίμανση γίνεται στην επιδιδυμίδα. Η θέση [Όρχεις/Όσχεο] είναι ιδιαίτερα σημαντική καθώς η διαδικασία της σπερματογένεσης απαιτεί χαμηλότερη θερμοκρασία για την παραγωγή βιώσιμου σπέρματος, συγκεκριμένα 1°-8 °C χαμηλότερη από την κανονική θερμοκρασία σώματος 37 °C (98,6 °F).[6] Κλινικά, μικρές διακυμάνσεις στη θερμοκρασία, όπως από έναν αθλητικό ιμάντα στήριξης, δεν προκαλούν βλάβη στη βιωσιμότητα ή τον αριθμό των σπερματοζωαρίων.[7]
Διάρκεια
ΕπεξεργασίαΓια τους ανθρώπους, η όλη διαδικασία της σπερματογένεσης υπολογίζεται ποικιλοτρόπως ότι διαρκεί 74 ημέρες[8][9] (σύμφωνα με βιοψίες με επισήμανση τριτίου) και περίπου 120 ημέρες[10] (σύμφωνα με μετρήσεις ρολογιού DNA). Συμπεριλαμβανομένης της μεταφοράς στο σύστημα του πόρου, διαρκεί 3 μήνες. Οι όρχεις παράγουν 200 έως 300 εκατομμύρια σπερματοζωάρια καθημερινά.[11] Ωστόσο, μόνο περίπου τα μισά ή 100 εκατομμύρια από αυτά γίνονται βιώσιμα σπερματοζωάρια.[12]
Στάδια
ΕπεξεργασίαΟλόκληρη η διαδικασία της σπερματογένεσης μπορεί να χωριστεί σε διάφορα διακριτά στάδια, καθένα από τα οποία αντιστοιχεί σε έναν συγκεκριμένο τύπο κυττάρου στον άνθρωπο. Το πρωτογενές σπερματοκύτταρο σταματά μετά τη σύνθεση του DNA και πριν από τη διαίρεση.
Σπερματοκυτταρογένεση
ΕπεξεργασίαΗ σπερματοκυτταρογένεση είναι η ανδρική μορφή γαμετοκυτταρογένεσης και έχει ως αποτέλεσμα τον σχηματισμό σπερματοκυττάρων που κατέχουν το ήμισυ του φυσιολογικού γενετικού υλικού. Στη σπερματοκυτταρογένεση, ένα διπλοειδές σπερματογόνιο, το οποίο βρίσκεται στο βασικό διαμέρισμα των σπερματοζωαρίων, διαιρείται μιτωτικά, παράγοντας δύο διπλοειδή ενδιάμεσα κύτταρα που ονομάζονται πρωτογενή σπερματοκύτταρα. Κάθε πρωτογενές σπερματοκύτταρο μετακινείται στη συνέχεια στο περιαυλικό διαμέρισμα των σωληναρίων και αντιγράφει το DNA του και στη συνέχεια υφίσταται μείωση Ι για να παράγει δύο απλοειδή δευτερεύοντα σπερματοκύτταρα, τα οποία αργότερα θα διαιρεθούν για άλλη μια φορά σε απλοειδή σπερματοζωάρια. Αυτή η διαίρεση εμπλέκει πηγές γενετικής διαφοροποίησης, όπως η τυχαία συμπερίληψη των γονικών χρωμοσωμάτων και η χρωμοσωμική διασταύρωση που αυξάνει τη γενετική μεταβλητότητα του γαμέτη. Ο μηχανισμός απόκρισης βλάβης DNA (DDR) παίζει σημαντικό ρόλο στη σπερματογένεση. Η πρωτεΐνη FMRP συνδέεται με μειοτικά χρωμοσώματα και ρυθμίζει τη δυναμική του μηχανισμού DDR κατά τη διάρκεια της σπερματογένεσης.[13] Η FMRP φαίνεται να είναι απαραίτητη για την επιδιόρθωση της βλάβης του DNA.
Κάθε κυτταρική διαίρεση από ένα σπερματογόνιο σε σπερματίδα είναι ατελής. Τα κύτταρα παραμένουν συνδεδεμένα μεταξύ τους με γέφυρες κυτταροπλάσματος για να επιτρέψουν τη σύγχρονη ανάπτυξη. Δεν διαιρούνται όλα τα σπερματογόνια για να παράγουν σπερματοκύτταρα, διαφορετικά το απόθεμα σπερματογόνιων θα εξαντλούταν. Αντίθετα, τα σπερματογονικά βλαστοκύτταρα διαιρούνται μιτωτικά για να παράγουν αντίγραφα του εαυτού τους, διασφαλίζοντας τη σταθερή παροχή σπερματογόνιων για την τροφοδοσία της σπερματογένεσης.[14]
Σπερματιδογένεση
ΕπεξεργασίαΗ σπερματογένεση είναι η δημιουργία σπερματίδων από δευτερογενή σπερματοκύτταρα. Τα δευτερογενή σπερματοκύτταρα που παράγονται νωρίτερα εισέρχονται γρήγορα στη μείωση II και διαιρούνται για να παράγουν απλοειδή σπερματοζωάρια. Η μικρή διάρκεια αυτού του σταδίου σημαίνει ότι τα δευτερογενή σπερματοκύτταρα εμφανίζονται σπάνια σε ιστολογικές μελέτες.
Σπερμιογένεση
ΕπεξεργασίαΚατά τη διάρκεια της σπερμογένεσης, οι σπερματίδες αρχίζουν να σχηματίζουν μια ουρά αναπτύσσοντας μικροσωληνίσκους σε ένα από τα κεντριόλια, τα οποία μετατρέπονται σε βασικό σώμα. Αυτοί οι μικροσωληνίσκοι σχηματίζουν ένα αξόνημα. Αργότερα το κεντριόλιο τροποποιείται στη διαδικασία της μείωσης του κεντροσώματος.[15] Το πρόσθιο τμήμα της ουράς παχαίνει επειδή τα μιτοχόνδρια είναι διατεταγμένα γύρω από το αξόνημα για να εξασφαλίσουν την παροχή ενέργειας. Το DNA των σπερματίδων συμπυκνώνεται πολύ. Το DNA συσκευάζεται αρχικά με συγκεκριμένες πυρηνικές βασικές πρωτεΐνες, οι οποίες στη συνέχεια αντικαθίστανται με πρωταμίνες κατά την επιμήκυνση των σπερματίδων. Η προκύπτουσα σφιχτά συσκευασμένη χρωματίνη είναι μεταγραφικά ανενεργή. Η συσκευή Γκόλτζι περιβάλλει τον συμπυκνωμένο τώρα πυρήνα και γίνεται το ακρόσωμα.
Στη συνέχεια, η ωρίμανση λαμβάνει χώρα υπό την επίδραση της τεστοστερόνης, η οποία αφαιρεί το εναπομείναν περιττό κυτταρόπλασμα και οργανίδια. Το πλεονάζον κυτταρόπλασμα, γνωστό ως υπολειμματικά σώματα, φαγοκυτταρώνεται από τα περιβάλλοντα κύτταρα Σερτόλι στους όρχεις. Τα προκύπτοντα σπερματοζωάρια είναι πλέον ώριμα αλλά δεν έχουν κινητικότητα. Τα ώριμα σπερματοζωάρια απελευθερώνονται από τα προστατευτικά κύτταρα Σερτόλι στον αυλό του σπερματοφόρου σωληναρίου, μια διαδικασία που ονομάζεται σπερμίαση.
Τα μη κινητικά σπερματοζωάρια μεταφέρονται στην επιδιδυμίδα σε υγρό των όρχεων που εκκρίνεται από τα κύτταρα Σερτόλι με τη βοήθεια της περισταλτικής συστολής. Όσο βρίσκονται στην επιδιδυμίδα τα σπερματοζωάρια αποκτούν κινητικότητα και γίνονται ικανά για γονιμοποίηση. Ωστόσο, η μεταφορά των ώριμων σπερματοζωαρίων μέσω του υπολοίπου του αναπαραγωγικού συστήματος του αρσενικού επιτυγχάνεται μέσω μυϊκής συστολής και όχι της κινητικότητας του σπερματοζωαρίου.
Ρόλος των κυττάρων Σερτόλι
ΕπεξεργασίαΣε όλα τα στάδια της διαφοροποίησης, τα σπερματογόνα κύτταρα βρίσκονται σε στενή επαφή με τα κύτταρα Σερτόλι, τα οποία πιστεύεται ότι παρέχουν δομική και μεταβολική υποστήριξη στα αναπτυσσόμενα σπερματοζωάρια. Ένα μόνο κύτταρο Σερτόλι εκτείνεται από τη βασική μεμβράνη μέχρι τον αυλό του σπερματοφόρου σωληνίσκου, αν και οι κυτταροπλασματικές διεργασίες είναι δύσκολο να διακριθούν με μικροσκόπιο φωτός.
Τα κύτταρα Σερτόλι εξυπηρετούν μια σειρά από λειτουργίες κατά τη διάρκεια της σπερματογένεσης και υποστηρίζουν τους αναπτυσσόμενους γαμέτες με τους ακόλουθους τρόπους:
- Συντηρούν το περιβάλλον που είναι απαραίτητο για την ανάπτυξη και την ωρίμανση, μέσω του φραγμού αίματος-όρχεως
- Εκκρίνουν ουσίες που ξεκινούν τη μείωση
- Εκκρίνουν υποστηρικτικό ορχικό υγρό
- Εκκρίνουν την πρωτεΐνη που δεσμεύει τα ανδρογόνα (ABP), η οποία συγκεντρώνει την τεστοστερόνη κοντά στους αναπτυσσόμενους γαμέτες
- Η τεστοστερόνη χρειάζεται σε πολύ υψηλές ποσότητες για τη διατήρηση της αναπαραγωγικής οδού και η ABP επιτρέπει πολύ υψηλότερο επίπεδο γονιμότητας
- Εκκρίνουν ορμόνες που επηρεάζουν τον έλεγχο της σπερματογένεσης από την υπόφυση, ιδιαίτερα την πολυπεπτιδική ορμόνη, αναστολίνη
- Φαγοκυττάρωση υπολειμματικού κυτταροπλάσματος που έχει απομείνει από τη σπερμογένεση
- Η έκκριση αντι-μυλέριας ορμόνης[16]
- Προστατεύοτν τις σπερματίδες από το ανοσοποιητικό σύστημα του αρσενικού, μέσω του φραγμού των αίματος-όρχεων
- Συμβάλλουν στη θέση σπερματογονικών βλαστοκυττάρων
Τα μόρια διακυτταρικής προσκόλλησης ICAM-1 και διαλυτό ICAM-1 έχουν ανταγωνιστικά αποτελέσματα στις σφιχτές συνδέσεις που σχηματίζουν το φράγμα αίματος-όρχεως.[17] Τα μόρια ICAM-2 ρυθμίζουν την προσκόλληση των σπερματιδών στην κορυφαία πλευρά του φραγμού (προς τον αυλό).[17]
Παράγοντες επιρροής
ΕπεξεργασίαΗ διαδικασία της σπερματογένεσης είναι ιδιαίτερα ευαίσθητη στις διακυμάνσεις του περιβάλλοντος, ιδιαίτερα στις ορμόνες και τη θερμοκρασία. Η τεστοστερόνη απαιτείται σε μεγάλες συγκεντρώσεις τοπικά για να διατηρηθεί η διαδικασία, η οποία επιτυγχάνεται μέσω της δέσμευσης της τεστοστερόνης από την πρωτεΐνη που δεσμεύει ανδρογόνα. Η τεστοστερόνη παράγεται από τα διάμεση κύτταρα, γνωστά και ως κύτταρα Λέιντιγκ, τα οποία βρίσκονται δίπλα στα σπερματοζωάρια.
Το σπερματοφόρο επιθήλιο είναι ευαίσθητο στην αυξημένη θερμοκρασία στον άνθρωπο και σε ορισμένα άλλα είδη και επηρεάζεται αρνητικά από θερμοκρασίες όπως η κανονική θερμοκρασία του σώματος. Επιπλέον, η σπερματογονία δεν επιτυγχάνει ωριμότητα στη θερμοκρασία του σώματος στα περισσότερα θηλαστικά, καθώς η β-πολυμεράση και η ανασυνδυάση του σπέρματος έχει συγκεκριμένη βέλτιστη θερμοκρασία λειτουργίας.[18] Κατά συνέπεια, οι όρχεις βρίσκονται έξω από το σώμα σε ένα σάκο δέρματος που ονομάζεται όσχεο. Η βέλτιστη θερμοκρασία διατηρείται στους 2 °C (άνθρωπος) (8 °C ποντίκι) κάτω από τη θερμοκρασία του σώματος. Αυτό επιτυγχάνεται με τη ρύθμιση της ροής του αίματος[19] και την μετακίνησή του προς και μακριά από τη θερμότητα του σώματος από τον κρεμαστήρα μυ και τον δαρτό μυ στο όσχεο.
Διατροφικές ελλείψεις (όπως βιταμίνες Β, Ε και Α), αναβολικά στεροειδή, μέταλλα (κάδμιο και μόλυβδος), έκθεση σε ακτίνες Χ, διοξίνη, αλκοόλ και μολυσματικές ασθένειες επηρεάζουν επίσης αρνητικά τον ρυθμό σπερματογένεσης.[20] Επιπλέον, η αρσενική βλαστική σειρά είναι επιρρεπής σε βλάβες του DNA που προκαλείται από το οξειδωτικό στρες και αυτή η βλάβη πιθανότατα έχει σημαντικό αντίκτυπο στη γονιμοποίηση και την εγκυμοσύνη.[21] Η έκθεση σε φυτοφάρμακα επηρεάζει επίσης τη σπερματογένεση.[22]
Ορμονικός έλεγχος
ΕπεξεργασίαΟ ορμονικός έλεγχος της σπερματογένεσης ποικίλλει μεταξύ των ειδών. Στον άνθρωπο ο μηχανισμός δεν είναι πλήρως κατανοητός. Ωστόσο είναι γνωστό ότι η έναρξη της σπερματογένεσης συμβαίνει στην εφηβεία λόγω της αλληλεπίδρασης του υποθαλάμου, της υπόφυσης και των κυττάρων Λέυντιγκ. Εάν αφαιρεθεί η υπόφυση, η σπερματογένεση μπορεί ακόμα να ξεκινήσει με την ωοθυλακιοτρόπο ορμόνη (FSH) και την τεστοστερόνη.[23] Σε αντίθεση με την FSH, η ωχρινοτρόπος ορμόνη (LH) φαίνεται να παίζει μικρό ρόλο στη σπερματογένεση εκτός από την πρόκληση παραγωγής τεστοστερόνης στις γονάδες.[23][24]
Η FSH διεγείρει τόσο την παραγωγή της πρωτεΐνης που δεσμεύει τα ανδρογόνα (ABP) από τα κύτταρα Σερτόλι, όσο και τον σχηματισμό του φραγμού αίματος-όρχεως. Η ABP είναι απαραίτητη για τη συγκέντρωση της τεστοστερόνης σε επίπεδα αρκετά υψηλά ώστε να ξεκινήσει και να διατηρηθεί η σπερματογένεση. Τα επίπεδα της τεστοστερόνης στον όρχυ είναι 20-100 ή 50-200 φορές υψηλότερα από τη συγκέντρωση που βρίσκεται στο αίμα, αν και υπάρχει διακύμανση σε ένα εύρος 5 έως 10 φορές μεταξύ των υγιών ανδρών.[25][26] Η FSH μπορεί να ξεκινήσει τη δέσμευση της τεστοστερόνης στους όρχεις, αλλά απαιτείται μόνο η τεστοστερόνη για τη διατήρηση της σπερματογένεσης.[23] Ωστόσο, η αύξηση των επιπέδων της FSH θα αυξήσει την παραγωγή σπερματοζωαρίων αποτρέποντας την απόπτωση της σπερματογονίας τύπου Α. Η ορμόνη ινχιμπίνη δρα στη μείωση των επιπέδων της FSH. Μελέτες από μοντέλα τρωκτικών υποδηλώνουν ότι οι γοναδοτροπίνες (τόσο η LH όσο και η FSH) υποστηρίζουν τη διαδικασία της σπερματογένεσης καταστέλλοντας τα προαποπτωτικά σήματα και επομένως προάγουν την επιβίωση των σπερματογόνων κυττάρων.[27]
Τα ίδια τα κύτταρα Σερτόλι μεσολαβούν σε μέρη της σπερματογένεσης μέσω της παραγωγής ορμονών. Είναι ικανά να παράγουν τις ορμόνες οιστραδιόλη και ινχιμπίνη. Τα κύτταρα Λέυνιγκ είναι επίσης ικανά να παράγουν οιστραδιόλη εκτός από το κύριο προϊόν τους τεστοστερόνη. Τα οιστρογόνα έχει βρεθεί ότι είναι απαραίτητα για τη σπερματογένεση στα ζώα.[28][29] Ωστόσο, ένας άνδρας με σύνδρομο μη ευαισθησίας στα οιστρογόνα βρέθηκε ότι παράγει σπέρμα με φυσιολογικό αριθμό σπερματοζωαρίων, αν και ασυνήθιστα χαμηλή βιωσιμότητα σπέρματος. Δεν ήταν σαφές ήταν στείρος ή όχι.[30] Πολύ υψηλά επίπεδα οιστρογόνων μπορεί να είναι επιζήμια για τη σπερματογένεση λόγω της καταστολής της έκκρισης γοναδοτροπίνης και κατ' επέκταση της παραγωγής τεστοστερόνης εντός του όρχεως.[31] Η προλακτίνη φαίνεται επίσης να είναι σημαντική για τη σπερματογένεση.[24]
Διαταραχές
ΕπεξεργασίαΟι διαταραχές της σπερματογένεσης μπορεί να προκαλέσουν ολιγοσπερμία, στην οποία το σπέρμα έχει χαμηλή συγκέντρωση σπερματοζωαρίων[32] και είναι ένα κοινό εύρημα στην ανδρική υπογονιμότητα.
Παραπομπές
Επεξεργασία- ↑ de Kretser, D. M.; Loveland, K. L.; Meinhardt, A.; Simorangkir, D.; Wreford, N. (1998-04-01). «Spermatogenesis» (στα αγγλικά). Human Reproduction 13 (suppl_1): 1–8. doi:. ISSN 0268-1161. PMID 9663765. https://academic.oup.com/humrep/article/13/suppl_1/1/788755.
- ↑ 2,0 2,1 «Localization of epithelial sodium channel (ENaC) and CFTR in the germinal epithelium of the testis, Sertoli cells, and spermatozoa.». Journal of Molecular Histology 49 (2): 195–208. 2018. doi:. PMID 29453757.
- ↑ «The Spermatozoön, in Gray's Anatomy». Ανακτήθηκε στις 7 Οκτωβρίου 2010.
- ↑ Song, Ning; Liu, Jie; An, Shucai; Nishino, Tomoya; Hishikawa, Yoshitaka; Koji, Takehiko (2011). «Immunohistochemical Analysis of Histone H3 Modifications in Germ Cells during Mouse Spermatogenesis». Acta Histochemica et Cytochemica 44 (4): 183–90. doi:. PMID 21927517.
- ↑ Schulze, W. (24 April 2009). «Evidence of a Wave of Spermatogenesis in Human Testis». Andrologia 14 (2): 200–207. doi:. PMID 7103139.
- ↑ "scrotum". Encyclopædia Britannica. Encyclopædia Britannica Online. Encyclopædia Britannica Inc., 2015. Web. 14 Jan. 2015 <http://www.britannica.com/EBchecked/topic/530078/scrotum>.
- ↑ «Effect of increased scrotal temperature on sperm production in normal men». Fertil. Steril. 68 (2): 334–9. 1997. doi:. PMID 9240266.
- ↑ «Kinetics of the germinal epithelium in man». Recent Prog Horm Res 20: 545–571. 1964. PMID 14285045.
- ↑ «The cycle of the seminiferous epithelium in humans: a need to revisit?». J Androl 29 (5): 469–487. 2008. doi:. PMID 18497337.
- ↑ «Elevated germline mutation rate in teenage fathers». Proc R Soc B 282 (1803): 20142898. 2015. doi:. PMID 25694621.
- ↑ Padubidri, VG, επιμ. (2011). Shaw's Textbook of Gynaecology (15th έκδοση). σελ. 201. ISBN 978-81-312-2548-6.
- ↑ «Further quantification of human spermatogenesis: germ cell loss during postprophase of meiosis and its relationship to daily sperm production». Biol. Reprod. 29 (1): 207–15. 1983. doi:. PMID 6615966.
- ↑ «A chromatin-dependent role of the fragile X mental retardation protein FMRP in the DNA damage response». Cell 157 (4): 869–81. May 2014. doi:. PMID 24813610.
- ↑ Fishelson, Lev; Gon, Ofer; Holdengreber, Vered; Delarea, Yakob (2007). «Comparative spermatogenesis, spermatocytogenesis, and spermato-zeugmata formation in males of viviparous species of clinid fishes (Teleostei: Clinidae, Blennioidei)». The Anatomical Record 290 (3): 311–23. doi:. PMID 17525946.
- ↑ Atypical centrioles during sexual reproduction Tomer Avidor-Reiss*, Atul Khire, Emily L. Fishman and Kyoung H. Jo Curr Biol. 2015 Nov 16;25(22):2956-63. doi: 10.1016/j.cub.2015.09.045. Epub 2015 Oct 17. http://journal.frontiersin.org/article/10.3389/fcell.2015.00021/full
- ↑ Hadley, Mac E.· Levine, Jon E. (2007). Endocrinology (6th έκδοση). Upper Saddle River, NJ: Prentice Hall. σελ. 369. ISBN 978-0-13-187606-4.
- ↑ 17,0 17,1 Xiao, X.; Mruk, D. D.; Cheng, C. Y. (2013). «Intercellular adhesion molecules (ICAMs) and spermatogenesis». Human Reproduction Update 19 (2): 167–86. doi:. PMID 23287428.
- ↑ «Spermatogenesis». Spermatogenesis. Ανακτήθηκε στις 12 Ιανουαρίου 2022.
- ↑ Harrison, RG; Weiner, JS (1949). «Vascular patterns of the mammalian testis and their functional significance». The Journal of Experimental Biology 26 (3): 304–16, 2 pl. doi:. PMID 15407652.
- ↑ Jenardhanan, Pranitha; Panneerselvam, Manivel; Mathur, Premendu P. (2016-11-01). «Effect of environmental contaminants on spermatogenesis» (στα αγγλικά). Seminars in Cell & Developmental Biology. Molecular Mechanisms in Spermatogenesis 59: 126–140. doi:. ISSN 1084-9521. https://www.sciencedirect.com/science/article/pii/S1084952116300854.
- ↑ Lewis, S. E. M.; Aitken, R. J. (24 May 2005). «DNA damage to spermatozoa has impacts on fertilization and pregnancy». Cell and Tissue Research 322 (1): 33–41. doi:. PMID 15912407.
- ↑ Mehrpour, Omid; Karrari, Parissa; Zamani, Nasim; Tsatsakis, Aristides M.; Abdollahi, Mohammad (October 2014). «Occupational exposure to pesticides and consequences on male semen and fertility: A review». Toxicology Letters 230 (2): 146–156. doi:. PMID 24487096.
- ↑ 23,0 23,1 23,2 William J. Kraemer· A. D. Rogol (15 Απριλίου 2008). The Encyclopaedia of Sports Medicine: An IOC Medical Commission Publication, The Endocrine System in Sports and Exercise. John Wiley & Sons. σελίδες 286–. ISBN 978-0-470-75780-2.
- ↑ 24,0 24,1 «Effects of drugs on the male and female reproductive systems». Ann. Clin. Lab. Sci. 15 (6): 451–8. 1985. PMID 4062226.
- ↑ Wolf-Bernhard Schill· Frank H. Comhaire (26 Αυγούστου 2006). Andrology for the Clinician. Springer Science & Business Media. σελίδες 76–. ISBN 978-3-540-33713-3.
- ↑ Eberhard Nieschlag· Hermann M. Behre (26 Ιουλίου 2012). Testosterone: Action, Deficiency, Substitution. Cambridge University Press. σελίδες 130–. ISBN 978-1-107-01290-5.
- ↑ Pareek, Tej K.; Joshi, Ayesha R.; Sanyal, Amartya; Dighe, Rajan R. (2007). «Insights into male germ cell apoptosis due to depletion of gonadotropins caused by GnRH antagonists». Apoptosis 12 (6): 1085–100. doi:. PMID 17268770.
- ↑ «Estrogen and spermatogenesis». Endocr. Rev. 22 (3): 289–318. 2001. doi:. PMID 11399746.
- ↑ «Role of estrogens in spermatogenesis». Front Biosci 4: 1–11. 2012. doi:. PMID 22201851.
- ↑ Smith, Eric P.; Boyd, Jeff; Frank, Graeme R.; Takahashi, Hiroyuki; Cohen, Robert M.; Specker, Bonny; Williams, Timothy C.; Lubahn, Dennis B. και άλλοι. (1994). «Estrogen Resistance Caused by a Mutation in the Estrogen-Receptor Gene in a Man». New England Journal of Medicine 331 (16): 1056–1061. doi:. ISSN 0028-4793. PMID 8090165.
- ↑ Edmund S. Sabanegh, Jr. (20 Οκτωβρίου 2010). Male Infertility: Problems and Solutions. Springer Science & Business Media. σελίδες 83–. ISBN 978-1-60761-193-6.
- ↑ thefreedictionary.com > oligospermia Citing: Dorland's Medical Dictionary for Health Consumers, 2007 by Saunders; The American Heritage Medical Dictionary 2007, 2004 by Houghton Mifflin Company; Mosby's Medical Dictionary, 8th edition 2009; McGraw-Hill Concise Dictionary of Modern Medicine, 2002 by The McGraw-Hill Companies