Φαινολοφθαλεΐνη
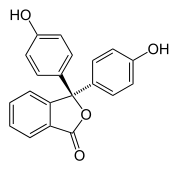
Φαινολοφθαλεΐνη είναι η εμπειρική ονομασία της οργανικής χημικής ένωσης που, σύμφωνα με την κατά IUPAC ονοματολογία, ονομάζεται 3,3-δι(4-υδροξυφαινυλο)-2-βενζοφουραν-1(3Η)-όνη[2]. Η ένωση έχει αρκετές ακόμα ονομασίες[4][5] όπως 2-(δι-(4-υδροξυφαινυλο)μεθυλο)βενζοικό οξύ, 3,3-δι(p-υδροξυφαινυλο)φθαλίδιο, 3,3-δι(4-υδροξυφαινυλο)-1(3H)-ισοβενζοφουρανόνη, α-(παρα-υδροξυφαινυλο)-α-(4-οξο-2,5-κυκλοεξαδιεν-1-υλιδενο)-ορθοτολουολικό οξύ, ενώ διαθέτει και πολλές εμπορικές επωνυμίες[4][6] όπως Agoral, Alophen, Correctol, Doxidan, Euchessina, Phenolax, Purgophen, Evac-U-Lax, Modane, Prifinol, Fructosan κ.ά. επειδή μέχρι πρόσφατα είχε χρησιμοποιηθεί και ως φάρμακο.
Έχει μοριακό τύπο C20H14O4 και περιεκτικότητα % w/w 75,5 % C, 4,43 % Η και 20,1 % Ο. Αποδίδεται συντομογραφικά ως phph.
Η φαινολοφθαλεΐνη ανακαλύφθηκε το 1871 από τον Γερμανό χημικό Άντολφ φον Μπέγιερ (Adolf von Baeyer)[7] και δεν υπάρχει ως φυσικό προϊόν[4].
Χρησιμοποιήθηκε για πρώτη φορά ως συνθετικός δείκτης αλλαγής χρώματος από το Luck το 1877[8] και από τότε χρησιμοποιείται ευρέως ως δείκτης για τον προσδιορισμό του pH του τελικού σημείου της ογκομέτρησης διαλυμάτων οξέων, κυρίως ασθενών, από ισχυρές βάσεις, ενώ παλαιότερα είχε χρησιμοποιηθεί και ως καθαρτικό.
| Φαινολοφθαλεΐνη | |||
|---|---|---|---|
| |||

| |||

| |||
| Γενικά | |||
| Όνομα IUPAC | 3,3-δι(4-υδροξυφαινυλο)-2-βενζοφουραν-1(3Η)-όνη | ||
| Άλλες ονομασίες | 2-(δι-(4-υδροξυφαινυλο)μεθυλο)βενζοικό οξύ, 3,3-δι(p-υδροξυφαινυλο)φθαλίδιο, | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | C20H14O4 | ||
| Μοριακή μάζα | 318,3228 g/mol | ||
| Συντομογραφίες | HIn, phph | ||
| Αριθμός CAS | 77-09-8 | ||
| SMILES | C1=CC=C2C(=C1)C(=O)OC2(C3=CC=C (C=C3)O)C4=CC=C(C=C4)O | ||
| InChI | 1/C20H14O4/c21-15-9-5-13(6-10-15)20(14-7-11- 16(22)12-8-14)18-4-2-1-3-17(18)19(23)24- | ||
| Αριθμός EINECS | 201-004-7 | ||
| Αριθμός RTECS | SM8380000 | ||
| PubChem CID | 4764 | ||
| ChemSpider ID | 4600 | ||
| Δομή | |||
| Κρυσταλλική δομή στερεού |
Τρικλινείς κρύσταλλοι[1] | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | 260°C | ||
| Σημείο βρασμού | 557,8°C[2] | ||
| Πυκνότητα | 1,385 g/cm3 | ||
| Διαλυτότητα στο νερό |
Αδιάλυτη | ||
| Διαλυτότητα σε άλλους διαλύτες |
πολύ διαλυτή στην αιθανόλη (80 g/mol) πολύ διαλυτή στο διαιθυλαιθέρα, | ||
| Δείκτης διάθλασης , nD |
1,57 ή 1,693[2] | ||
| Τάση ατμών | 6,74·10-13 mmHg | ||
| Εμφάνιση | λευκό ή λευκοκίτρινο στερεό[1] | ||
| Χημικές ιδιότητες | |||
| pKa | 9,7[3][4] | ||
| Ελάχιστη θερμοκρασία ανάφλεξης |
206,5°C[2] | ||
| Επικινδυνότητα | |||

| |||
| Φράσεις κινδύνου | 45, 62, 68 | ||
| Φράσεις ασφαλείας | 53, 45 | ||
| Κίνδυνοι κατά NFPA 704 |
|||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Χαρακτηριστικές ιδιότητες
ΕπεξεργασίαΗ φαινολοφθαλεΐνη είναι λευκή έως υποκίτρινη, άοσμη και άγευστη μη αναφλέξιμη κρυσταλλική σκόνη και θεωρείται παράγωγο της φθαλεΐνης αλλά και του βενζο-φουρανίου[9].
Κρυσταλλώνεται στο τρικλινές σύστημα (σε θερμοκρασία δωματίου) και είναι πρακτικά αδιάλυτη στο νερό αφού διαλύονται περίπου 400 mg ουσίας/1 L νερού[3] ή λιγότερο από 0,1 g ουσίας/100 mL νερού[10]. Διαλύεται εύκολα (1 g ουσίας/12 mL αιθανόλης) σε αιθυλική αλκοόλη (οινόπνευμα), στο διαιθυλαιθέρα (1 g ουσίας/100 mL αιθέρα), σε αραιά διαλύματα υδροξειδίων, σε θερμά διαλύματα ανθρακικών αλάτων αλκαλιμετάλλων, σε ακετόνη, στο τολουόλιο, στο πυρένιο[9], ενώ είναι λίγο διαλυτή στο χλωροφόρμιο και στο διμεθυλοσουλφοξείδιο[1].
Έχει σημείο τήξης 260 °C[5] ή 262,5 °C[3] και πυκνότητα 1,385 g/cm3[2] ή 1,29 gr/cm3[5]
Παρασκευή
ΕπεξεργασίαΗ φαινολοφθαλεΐνη μπορεί να παρασκευαστεί με συνθέρμανση φαινόλης και φθαλικού ανυδρίτη παρουσία πυκνού θειικού οξέος. Το μίγμα θερμαίνεται στους 120 °C για 10–12 ώρες σύμφωνα με την αντίδραση :
Το προϊόν εκχυλίζεται με βραστό νερό και το κατάλοιπο διαλύεται σε αραιό διάλυμα υδροξειδίου του νατρίου, φιλτράρεται και καθιζάνει με οξύ. Έχει αναφερθεί ότι στις αρχές του 1990 παράχθηκαν 197 τόνοι φαινολοφθαλεΐνης από έναν μόνο κατασκευαστή στις Η.Π.Α., ενώ στοιχεία του 1999 δείχνουν ότι η ένωση παρασκευαζόταν σε 33 χώρες[4].
Παρασκευή δείκτη - Τοξικότητα - Προφυλάξεις
ΕπεξεργασίαΤο διάλυμα που θα χρησιμοποιηθεί ως δείκτης παρασκευάζεται με τη διάλυση 0,05 g φαινολοφθαλεΐνης σε μίγμα αποτελούμενο από 50 mL νερό και 50 mL αιθανόλη. Το διάλυμα αυτό μπορεί να είναι ερεθιστικό για τα μάτια και το δέρμα, γι' αυτό επιβάλλεται η χρήση ειδικών γυαλιών στο εργαστήριο κατά τη χρήση του.
Μέχρι τα μέσα της δεκαετίας του 1990, η φαινολοφθαλεΐνη θεωρήθηκε ως μη τοξική και ασφαλής για κατανάλωση, αν και οι λαμβανόμενες από το στόμα θεραπευτικές δόσεις παρήγαγαν κατά καιρούς κοιλιακή δυσφορία, διάρροια, ναυτία, μειωμένη αρτηριακή πίεση και τάση λιποθυμίας. Σοβαρές ανεπιθύμητες ενέργειες έχουν αναφερθεί σε περιπτώσεις υπερβολικής κατανάλωσης. Το κύριο όργανο-στόχος για τις τοξικές επιδράσεις της φαινολοφθαλεΐνης φέρεται να είναι το έντερο. Αδιάκριτη χρήση φαινολοφθαλεΐνης οδηγεί σε χρόνια δυσκοιλιότητα και εξάρτηση απ' αυτήν, απώλεια της φυσιολογικής λειτουργίας και ερεθισμό του εντέρου[4].
Έρευνες σε ζωικά πρότυπα έδειξαν ότι σχετίζεται με αυξημένο κίνδυνο νεοπλασμάτων των ωοθηκών, επινεφριδίων, νεφρών και του αιμοποιητικού συστήματος. Παρόλα αυτά, σε κλινική μελέτη δεν υπήρχε συσχέτιση καρκίνου και τη χρήση φαινολοφθαλεΐνης ως καθαρτικό σε ανθρώπους, πιθανώς επειδή η χορηγούμενη δόση στα πειραματόζωα ήταν αρκετά υψηλότερη.[11]
Χρήσεις
ΕπεξεργασίαΗ βασική χρήση της φαινολοφθαλεΐνης είναι ως δείκτη ενεργής οξύτητας (pH) διαλυμάτων και ιδιαιτέρως στις ογκομετρήσεις των ασθενών οξέων. Η μεταβολή του χρώματός της είναι σαφής και η επίδραση της θερμοκρασίας όχι ουσιώδης. Μία άλλη χρήση της φαινολοφθαλεΐνης ως δείκτη είναι να καθορίζει το βάθος ενανθράκωσης του σκυροδέματος, το οποίο είναι ένας δείκτης έναρξης της διάβρωσης[9]. Επιπλέον χρησιμοποιείται και ως οργανικό αντιδραστήριο στην ποιοτική ανάλυση. Έχει διαπιστωθεί ότι ορισμένα υδροξείδια μετάλλων όπως του μολύβδου, του καδμίου, του ψευδαργύρου και του μαγνησίου, με επίδραση φαινολοφθαλεΐνης παρέχουν χαρακτηριστικά χρώματα που οφείλονται στην ενεργό προσρόφηση του δείκτη[12].
Χρησιμοποιείται επίσης στην Ιατροδικαστική για τη δοκιμασία Kastle-Meyer (Kastle-Meyer test) για την ανίχνευση αιμοσφαιρίνης: Προκειμένου να διαπιστωθεί αν μια κηλίδα προέρχεται από αίμα, λαμβάνεται ξηρό δείγμα της σε διηθητικό χαρτί, στο οποίο προστίθενται μερικές σταγόνες καθαρού οινοπνεύματος, μερικές σταγόνες διαλύματος φαινολοφθαλεΐνης και, τέλος, λίγες σταγόνες διαλύματος υπεροξειδίου του υδρογόνου (οξυζενέ): Αν το δείγμα λάβει ρόδινη χροιά, πρόκειται περί αίματος. Η δοκιμασία αυτή έχει το πλεονέκτημα ότι δεν καταστρέφει το αρχικό δείγμα[13].
Η φαινολοφθαλεΐνη χρησιμοποιείται ακόμα σε μερικά παιχνίδια ως συστατικό "μελάνης" που εξαφανίζεται. Κατά τον ίδιο τρόπο χρησιμοποιήθηκε στην αλλαγή χρώματος των μαλλιών της γνωστής κούκλας "Μπάρμπι" (Barbie): Η χρωστική (φαινολοφθαλεΐνη) των μαλλιών αναμιγνύεται με υδροξείδιο του νατρίου και το pH της ανέρχεται σε τιμές άνω του 8,2, οπότε τα μαλλιά της κούκλας είχαν κοκκινωπό χρώμα. Όταν το μίγμα αυτό έρθει σε επαφή με τον αέρα, το υδροξείδιο του νατρίου αντιδρά με το διοξείδιο του άνθρακα (CO2) της ατμόσφαιρας:
- 2NaOH + CO2 → Na2CO3 + H2O
και απομακρύνεται από τα μαλλιά με αποτέλεσμα η χρωστική να μετατρέπεται από ρόδινη σε άχρωμη. Όταν τα μαλλιά ψεκαστούν εκ νέου με αλκαλικό διάλυμα, το ρόδινο χρώμα επανέρχεται. Με ανάλογο τρόπο χρησιμοποιείται και η χρωστική θυμολοφθαλεΐνη, η οποία δίνει μπλε χρώμα στα μαλλιά[14].
Η φαινολοφθαλεΐνη χρησιμοποιήθηκε μέχρι πρόσφατα ως καθαρτικό. Η καθαρτική δράση της ανακαλύφθηκε το 1902 και από τότε και για περίπου έναν αιώνα έγινε χρήση χωρίς ιατρική συνταγή. Επίσης χρησιμοποιήθηκε για τη θεραπεία της δυσκοιλιότητας και για την εκκένωση του εντέρου πριν από χειρουργικές επεμβάσεις. Η ουσία αποσύρθηκε από την αγορά τη δεκαετία του 1990 λόγω τοξικολογικών μελετών και του γεγονότος ότι είναι πιθανώς καρκινογόνος για τον άνθρωπο[4][15].
Η φαινολοφθαλεΐνη ως δείκτης
ΕπεξεργασίαΜηχανισμός δράσης
ΕπεξεργασίαΟι περισσότεροι δείκτες, παράγωγα της φθαλεΐνης είναι άχρωμοι σε όξινα διαλύματα και έντονα χρωματισμένοι σε αλκαλικά (βασικά) διαλύματα. Σε υψηλές τιμές pH παρατηρείται σε πολλά παράγωγα αποχρωματισμός και το γεγονός αυτό είναι ένα σοβαρό μειονέκτημα της τάξης αυτής[12].
Ως ένωση η φαινολοφθαλεΐνη είναι σταθερή και από το συντακτικό της τύπο φαίνεται ότι έχει δομή λακτόνης[Σημ. 1]. Συμπεριφέρεται ως ασθενές διπρωτικό οξύ, έχει σταθερά Κa = 2×10−10, γεγονός που σημαίνει ότι σε διάλυμα παρέχει υδροξώνια (κατιόντα υδρογόνου) Η3Ο+ σε δύο βαθμίδες ιονισμού :
- H2In(άχρωμο) + Η2Ο ⇌ Η3Ο+ + InH-(άχρωμο)
- InH-(άχρωμο) + H2Ο ⇌ H3O+ + In2-(σκούρο ρόδινο-κόκκινο)
Στο παρακάτω σχήμα τα δύο παραπάνω στάδια ιοντισμού φαίνονται μαζί και η ένωση (1) είναι η H2In ενώ η μορφή είναι η In2-. Με μετατόπιση των ηλεκτρονίων και θραύση του λακτονικού δεσμού C-Ο σχηματίζεται ελεύθερο καρβοξυλικό ιόν (μορφή 2)-μεσομερής μορφή. Η κινοειδής μορφή που σχηματίζεται, η οποία έχει τη δυνατότητα εναλλαγής προς τον άλλο δακτύλιο, και το εκτεταμένο συζυγιακό σύστημα (μορφές 2 σε pH=8-12) το οποίο προκύπτει, προκαλεί την παρατηρούμενη βαθυχρωμία. Επιπλέον, η μορφή (2) επειδή έχει δύο αρνητικά φορτία έχει σαφώς πολικό χαρακτήρα[12].
Σε υψηλές τιμές pH (>12) όμως που εμφανίζονται με προσθήκη αυξημένης ποσότητας ΟΗ-, παρατηρείται πυρηνόφιλη προσβολή του ΟΗ- στον κοινό άνθρακα που συνδέει τους τρεις εξαμελείς δακτυλίους, δημιουργία της μορφής (3), με αποτέλεσμα οι προϋποθέσεις που αναφέρθηκαν προηγουμένως να μην υφίστανται πλέον και το διάλυμα καθίσταται άχρωμο[12].
Η φαινολοφθαλεΐνη λοιπόν εμφανίζεται με τέσσερις μορφές ανάλογα με το pH του διαλύματος στο οποίο βρίσκεται :
| Μηχανισμός δράσης: H3In+ → H2In → In2− → In(OH)3− |
Επιλογή δείκτη σε ογκομετρήσεις εξουδετέρωσης
ΕπεξεργασίαΚατά τις ογκομετρήσεις εξουδετέρωσης, έχει θεμελιώδη σημασία η επιλογή του κατάλληλου δείκτη η αλλαγή χρώματος του οποίου θα μας δείξει και το τελικό σημείο (συντομογραφία τ.σ.) δηλ. το τέλος του πειράματος και της εξουδετέρωσης. Αυτή η αλλαγή χρώματος θα δείξει και πότε έχουν αναμιχθεί τέτοιες ποσότητες οξέος και βάσης ώστε να εξουδετερώσει το ένα το άλλο και να μην περισσέψει στο τελικό διάλυμα ούτε οξύ ούτε βάση. Το τελικό σημείο δεν πρέπει να συγχέεται με το ισοδύναμο σημείο (συντομογραφία ι.σ.) της εξουδετέρωσης στο οποίο έχουν αναμιχθεί στοιχειομετρικές ποσότητες οξέος-βάσης καθοριζόμενες από τη χημική εξίσωση[16]. Τα δύο αυτά σημεία είναι τιμές pH του διαλύματος που σχηματίζεται με την ανάμιξη του οξέος και της βάσης και δεν ταυτίζονται πάντοτε[Σημ. 2]. Επιδίωξή μας λοιπόν είναι να επιλέξουμε κατάλληλο δείκτη ώστε το τ.σ. (δηλ. η αλλαγή χρώματος) να πραγματοποιείται όσο γίνεται πιο κοντά στο ι.σ. της εξουδετέρωσης.
Ο κατάλληλος δείκτης σε κάθε περίπτωση επιλέγεται με βάση δύο κριτήρια : α) Το pH που αναμένουμε να έχει το δ/μα που προκύπτει από την εξουδετέρωση και β) Το pK του δείκτη. Συνήθως, όταν συμβαίνει pΚ = pΗ ± 1, τότε η επιλογή του δείκτη είναι επιτυχημένη. Η φαινολοφθαλεΐνη έχει pK = 9,7, οπότε θα αλλάζει χρώμα σε τιμές pH από 8,7 έως 10,7. Στην πράξη η περιοχή pH είναι περίπου από 8,3 έως 10,5. [Σημ. 3]. Τέτοια pH δημιουργούνται όταν εξουδετερώνονται ασθενή οξέα π.χ. CH3COOH από ισχυρές βάσεις π.χ. NaOH :
- NaOH + CH3COOH CH3COONa + H2O
οπότε το διάλυμα που προκύπτει μετά την πλήρη αντίδραση του οξέος με τη βάση, περιέχει μόνο άλας το οποίο διίσταται πλήρως :
- CH3COONa CH3COO— + Na+
και του οποίου το ανιόν δρα ως βάση δημιουργώντας ανιόντα ΟΗ— :
- CH3COO— + H2Ο CH3COOH + OH—
και δίνοντας στο διάλυμα pH > 7[16].
Στην περίπτωση εξουδετέρωσης ισχυρού οξέος-ισχυρής βάσης (π.χ. HCl-NaOH), το δ/μα που προκύπτει έχει ι.σ. με pH = 7 και η φαινολοφθαλεΐνη παραμένει άχρωμη, οπότε δε γίνεται αντιληπτό το τέλος της εξουδετέρωσης. Στην περίπτωση εξουδετέρωσης ισχυρού οξέος- ασθενούς βάσης (π.χ. HCl-ΝΗ3), το δ/μα που προκύπτει έχει ι.σ. με pH < 7 και η φαινολοφθαλεΐνη παραμένει και πάλι άχρωμη. Στην περίπτωση εξουδετέρωσης ασθενούς οξέος-ασθενούς βάσης, το δ/μα που προκύπτει έχει ι.σ. που μπορεί να έχει pH = 7, pH < 7 ή pH > 7 εξαρτώμενο από τις σταθερές ιοντισμού (Ka και Kb) του οξέος και της βάσης. Μόνο στην τελευταία περίπτωση κατά την οποία pH > 7[Σημ. 4] μπορεί να χρησιμοποιηθεί η φαινολοφθαλεΐνη ως δείκτης[16]. Στις άλλες περιπτώσεις πρέπει να επιλεγεί άλλος δείκτης.
Στην περίπτωση εξουδετέρωσης πολυπρωτικών οξέων (π.χ. φωσφορικού οξέος), η επιλογή δείκτη είναι δυσκολότερη αφού τα οξέα αυτά έχουν περισσότερα του ενός στάδια ιοντισμού και επομένως περισσότερα από ένα ισοδύναμα σημεία. Συνήθως η ογκομέτρηση γίνεται με χρήση πεχάμετρου.
Σημειώσεις
Επεξεργασία- ↑ Οι λακτόνες είναι κυκλικοί οργανικοί εστέρες που σχηματίζονται από την συνένωση καρβοξυλικού ιόντος και υδροξυλίου ή αλογόνου που είναι παρόντα στο ίδιο μόριο
- ↑ Ταυτίζονται μόνο στην περίπτωση ανάμιξης ισχυρού οξέος με ισχυρή βάση π.χ. ανάμιξη δ/τος HCl με δ/μα NaOH ή στην περίπτωση ανάμιξης ασθενούς οξέος με ασθενή βάση που έχουν όμως σταθερές ιοντισμού με την ίδια τιμή π.χ. ανάμιξη δ/των NH3 (Kb = 1,8×10-5) και CH3COOH (Ka = 1,8×10-5), οπότε το pH του δ/τος που προκύπτει, και που καθορίζεται από το άλας που σχηματίζεται, είναι 7. Σε άλλες περιπτώσεις το pH του δ/τος που προκύπτει είναι μεγαλύτερο ή μικρότερο του 7 διότι κάποιο από τα ιόντα του άλατος που σχηματίζεται δρα ως οξύ ή βάση κατεβάζοντας ή ανεβάζοντας το pH αντίστοιχα πάνω από το 7 (στους 25°C)
- ↑ Ας σημειωθεί ότι στους 100°C η περιοχή αλλαγή χρώματος είναι 8,1 - 9,0
- ↑ Όπως π.χ. στην αντίδραση HCN (Ka = 4×10-10) με ΝΗ3 (Kb = 1,8×10-5) όπου Kb > Ka
Παραπομπές
Επεξεργασία- ↑ 1,0 1,1 1,2 The Merck Index[νεκρός σύνδεσμος]
- ↑ 2,0 2,1 2,2 2,3 2,4 ChemSpider. The free chemical database
- ↑ 3,0 3,1 3,2 «U.S. Department of Health & Human Services. Chemical Information. National Library of Medicine. ChemIDplus Lite». Αρχειοθετήθηκε από το πρωτότυπο στις 7 Μαρτίου 2011. Ανακτήθηκε στις 11 Ιουλίου 2011.
- ↑ 4,0 4,1 4,2 4,3 4,4 4,5 4,6 (PDF) Some Antiviral and Antineoplastic Drugs, and Other Pharmaceutical Agents. PHENOLPHTHALEIN. 76. World Health Organisation. International Agency for Research on Cancer (IARC). Monographs on the Evaluation of Carcinogenic Risks to Humans. 2000, σελ. 387-415. http://monographs.iarc.fr/ENG/Monographs/vol76/mono76-15.pdf. Ανακτήθηκε στις 12/7/2011.
- ↑ 5,0 5,1 5,2 «Oxford University HSci web site». Αρχειοθετήθηκε από το πρωτότυπο στις 7 Οκτωβρίου 2011. Ανακτήθηκε στις 8 Ιουλίου 2011.
- ↑ National Center for Biotechnology Information, phenolphthalein
- ↑ Encyclopedia Britannica
- ↑ Ferenc Szabadváry (1993). History of analytical chemistry (επανεκτύπωση, εικονογραφημένη έκδοση). Taylor & Francis. ISBN 2881245692.
- ↑ 9,0 9,1 9,2 U.S. Department of Health and Human Services. National Toxicology Program. Report on Carcinogens, 12th Edition (2011)
- ↑ Chemical Book
- ↑ Patricia F. Coogan, Lynn Rosenberg, Julie R. Palmer, Brian L. Strom, Ann G. Zauber, Paul D. Stolley and Samuel Shapiro Phenolphthalein Laxatives and Risk of Cancer JNCI J Natl Cancer Inst (2000) 92 (23): 1943-1944
- ↑ 12,0 12,1 12,2 12,3 Γεώργιος Σ. Βασιλικιώτης (1977). «Κεφάλαιον όγδοον. Δείκται Αλκαλιμετρίας-Οξυμετρίας». Αναλυτική Χημεία. ΠΟΣΟΤΙΚΗ ΑΝΑΛΥΣΙΣ. τεύχος πρώτον (2η έκδοση). Θεσσαλονίκη.
- ↑ U.S. National Criminal Justice Reference Service (pdf)
- ↑ David A. Katz (2002). CHEMISTRY IN THE TOY STORE (PDF) (6 έκδοση). David A. Katz. Ανακτήθηκε στις 11 Ιουλίου 2011.
- ↑ June K. Dunnick and James R. Hailey, Phenolphthalein Exposure Causes Multiple Carcinogenic Effects in Experimental Model Systems Journal of Cancer research
- ↑ 16,0 16,1 16,2 Κ. Μανωλκίδης - Κ. Μπέζας (1993). Χημεία Γ'2 (16 έκδοση). Αθήνα: Βιβλιοεκδοτική Αναστασάκη.
Εξωτερικοί σύνδεσμοι
Επεξεργασία- Παίζοντας με τη φαινολοφθαλεΐνη και τις βάσεις
- ΕΡΓΑΣΤΗΡΙΑΚΟΣ ΟΔΗΓΟΣ ΑΝΑΛΥΣΗΣ ΤΡΟΦΙΜΩΝ. ΜΕΤΡΗΣΗ ΟΞΥΤΗΤΑΣ ΤΡΟΦΙΜΩΝ
- ΟΓΚΟΜΕΤΡΙΑ ΕΞΟΥΔΕΤΕΡΩΣΗΣ (ΟΞΥΜΕΤΡΙΑ - ΑΛΚΑΛΙΜΕΤΡΙΑ)
- ACID-BASE INDICATORS
- Acid-base titration. Indicators preparation
- titrations
- Acid-base titration » End point indicators
