Οξικό οξύ
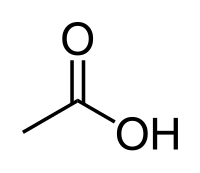
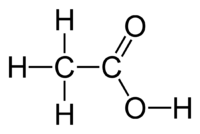
Το οξικό οξύ[1] (αγγλικά acetic acid, Ε260) είναι οργανική χημική ένωση, με μοριακό τύπο C2H4O2, αν και συνηθέστερα παριστάνεται με τους ημισυντακτικούς τύπους CH3COOH και CH3CO2H, ή και συντομογραφικά MeCOOH ή AcOH[2]. Πιο συγκεκριμένα, το οξικό οξύ είναι το καρβοξυλικό οξύ που δίνει στο ξύδι τη γνωστή (ξινή) γεύση και οσμή. Το χημικά καθαρό οξικό οξύ, στις «κανονικές συνθήκες περιβάλλοντος», δηλαδή σε θερμοκρασία 25 °C και υπό πίεση 1 atm, είναι άχρωμο υγρό, που πολλές φορές αποκαλείται «παγόμορφο» (glacial). Το ξύδι αποτελείται από οξικό οξύ σε περιεκτικότητα που κυμαίνεται περίπου από 4% - 8% σε οξικό οξύ κατ' όγκο, οπότε το οξικό οξύ είναι το δεύτερο κυριότερο συστατικό του ξυδιού, μετά από το νερό. Εκτός από την παραγωγή του οικιακού ξυδιού, το οξικό οξύ παράγεται περισσότερο ως πρόδρομη ένωση για τον οξικό πολυβινυλεστέρα και για την οξική κυτταρίνη. Παρ' όλο που ταξινομείται σαν μετρίως ασθενές οξύ, παρουσιάζοντας δηλαδή μερική μόνο διάσταση σε υδατικό διάλυμα, το πυκνό οξικό οξύ είναι διαβρωτικό και προκαλεί επώδυνα (χημικά) εγκαύματα στο δέρμα.
| Οξικό οξύ | |||
|---|---|---|---|
| |||
| |||

| |||

| |||

| |||
| Γενικά | |||
| Όνομα IUPAC | Αιθανικό οξύ | ||
| Άλλες ονομασίες | Οξικό οξύ | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | C2H4O2 | ||
| Μοριακή μάζα | 60,05 amu | ||
| Σύντομος συντακτικός τύπος |
CH3COOH | ||
| Συντομογραφίες | MeCOOH AcOH | ||
| Αριθμός CAS | 64-19-7 | ||
| SMILES | CC(=O)O | ||
| Αριθμός EINECS | 200-580-7 | ||
| Κωδικός προσθέτου τροφίμων |
Ε260 | ||
| Δομή | |||
| Διπολική ροπή | 1,74 D | ||
| Ισομέρεια | |||
| Ισομερή θέσης | 9 | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | 16,5 °C | ||
| Σημείο βρασμού | 118,1 °C | ||
| Πυκνότητα | 1.049 kg/m3 (20 °C) | ||
| Διαλυτότητα στο νερό |
Πλήρως αναμείξιμο | ||
| Ιξώδες | 1,22 mPa·s | ||
| Εμφάνιση | άχρωμο καυστικό υγρό | ||
| Χημικές ιδιότητες | |||
| pKa | 4,8 | ||
| Ελάχιστη θερμοκρασία ανάφλεξης |
43 °C | ||
| Επικινδυνότητα | |||
| Διαβρωτικό (C) Εύφλεκτο (F) | |||
| Φράσεις κινδύνου | R10, R35 | ||
| Φράσεις ασφαλείας | (S1/2) S23 S26 S45 | ||
| MSDS | Εξωτ. Σύνδεσμος MSDS | ||
| Κίνδυνοι κατά NFPA 704 |
|||
| Ιδιότητες εκρηκτικού | |||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Το οξικό οξύ είναι το δεύτερο απλούστερο καρβοξυλικό οξύ, μετά από μόνο το μυρμηκικό οξύ (HCO2H). Δομικά, αποτελείται από μια μεθυλομάδα (CH3-) ενωμένη με μια καρβοξυλομάδα (-CO2H).
Είναι σημαντικό χημικό αντιδραστήριο και σημαντικό βιομηχανικό χημικό, που χρησιμοποιείται κυρίως για την παραγωγή της οξικής κυτταρίνης, φωτογραφικών φιλμ, οξικού πολυβινυλεστέρα, για ξυλόκολλα, αλλά και συνθετικών ινών, από τις οποίες, με τη σειρά τους, παράγονται συνθετικά υφάσματα. Στα νοικοκυριά, διαλύματα οξικού οξέος συχνά χρησιμοποιούνται ως αφαιρετικά αλάτων. Στη βιομηχανία τροφίμων, το οξικό οξύ χρησιμοποιείται ως πρόσθετο με τον κωδικό E260, ως ρυθμιστής οξύτητας και ως καρύκευμα. Η χρήση του ως πρόσθετο τροφίμων, έχει εγκριθεί από πολλές χώρες, που ενδεικτικά συμπεριλαμβάνουν τον Καναδά[3], την Ευρωπαϊκή Ένωση[4], τις ΗΠΑ[5], την Αυστραλία και τη Νέα Ζηλανδία[6].
Στη βιοχημεία, η ακετυλομάδα, που παράγεται από το οξικό οξύ, είναι θεμελιώδης για όλες τις (γνωστές) μορφές ζωής. Όταν συνδέεται με το συνένζυμο Α (CoA, CoASH), σχηματίζει το ακετυλοσυνένζυμο Α, που αποτελεί κεντρικό σημείο για το μεταβολισμό υδατανθράκων και λιπών.
Η ετήσια παγκόσμια ζήτηση σε οξικό οξύ ήταν (το 2005) γύρω στους 6,5 εκατομμύρια τόνους, από τους οποίους 1,5 εκατομμύρια τόνοι προέρχονται από ανακύκλωση, ενώ η υπόλοιπη ζήτηση καλύπτεται κυρίως από υλικά με πετροχημική προέλευση[7]. Οι βιολογικές πηγές οξικού οξέος έχουν ενδιαφέρον, αλλά γενικά είναι μη ανταγωνιστικές (οικονομικά). Το ξύδι είναι κυρίως αραιό υδατικό διάλυμα οξικού οξέος, που παράγεται συχνά από τη ζύμωση και την επακόλουθη οξείδωση της αιθανόλης.
Το οξικό οξύ, με βάση το χημικό τύπο του, C2H4O2, ανήκει στους «τυπικούς» υδατάνθρακες, γιατί περιέχει άνθρακα και επιπλέον υδρογόνο και οξυγόνο στην αναλογία 2:1, που ισχύει για το νερό, αλλά δεν είναι σάκχαρο.
Ονοματολογία και συμβολισμοί
ΕπεξεργασίαΤο εμπειρικό όνομα «οξικό οξύ» χρησιμοποιείται πιο συχνά και είναι παραδεκτό και από την IUPAC. Το συστηματικό όνομα «οξικό οξύ» είναι η συστηματική ονομασία της ένωσης κατά IUPAC, και παράγεται σύμφωνα με την ονοματολογία υποκατάστασης[8]. Η χρησιμοποιούμενη αγγλόφωνη εμπειρική ονομασία acetic acid προέρχεται από τη λατινική λέξη acetum, που είναι η λατινική λέξη για το ξύδι, και είναι συγγενική επίσης και με την (αγγλική) λέξη acid. Το ελληνόφωνο εμπειρικό όνομα «οξικό οξύ» προέρχεται, ομοίως, από την αρχαία ελληνική λέξη «ὄξος», που επίσης σημαίνει ξύδι στο νεοελληνικά και επίσης είναι συγγενική με την αντίστοιχη λέξη «ὀξύ».
Ο όρος «παγόμορφο οξικό οξύ» είναι το εμπειρικό όνομα για το άνυδρο οξικό οξύ. Ομοίως, η γερμανόφωνη ονομασία Eisessig, που κυριολεκτικά στα ελληνικά σημαίνει «παγωμένο ξύδι», προέρχεται από τους παγόμορφους κρυστάλλους που σχηματίζει το οξικό οξύ σε θερμοκρασία 16,6 °C, λίγο μικρότερη από τη θερμοκρασία δωματίου (20 °C). Η παρουσία ύδατος σε συγκέντρωση 1‰ μειώνει την (κανονική) θερμοκρασία τήξης του οξικού οξέος κατά 0,2 °C[9].
Μια συνηθισμένη συντομογραφία για το οξικό οξύ είναι AcOH, όπου το Ac αναφέρεται στην ακετυλομάδα (CH3CO), ενώ το οξικό ανιόν (CH3COO-) παριστάνεται συντομογραφικά ως AcO-. Σε αυτές τις συντομογραφίες το Ac δεν πρέπει να συγχέεται με το χημικό στοιχείο ακτίνιο[10]. Για την καλύτερη απόδοση της δομή του, το οξικό οξύ συχνά παριστάνεται με τους ημισυντακτικούς τύπους CH3C(O)OH, CH3C(=O)OH, CH3COOH ή και CH3CO2H. Σε οξεοβασικές αντιδράσεις χρησιμοποιήθηκε επίσης μερικές φορές ο λίγο διαφορετικός συντομογραφικός συμβολισμός για το οξικό οξύ HAc[11], που μεταβάλλεται σε Ac-, για το οξικό ανιόν. Το οξικό ανιόν είναι το ανιόν που προκύπτει όταν το οξικό οξύ χάσει ένα πρωτόνιο. Ο όρος «οξικός» μπορεί επίσης να αναφέρεται σε άλατα ή εστέρες του οξικού οξέος[12].
Ιστορία
ΕπεξεργασίαΤο ξύδι ήταν γνωστό από νωρίς (τουλάχιστον) στον πολιτισμένο κόσμο, ως φυσικό προϊόν της έκθεσης στον ατμοσφαιρικό αέρα μπύρας ή κρασιού, εφόσον τα βακτήρια που μεταβολίζουν αιθανόλη σε οξικό οξύ βρίσκονται σ' όλον τον κόσμο.
Η χρήση του οξικού οξέος στην αλχημεία επεκτάθηκε κατά τον 3ο π.Χ. αιώνας, όταν ο Έλληνας φιλόσοφος Θεόφραστος περιέγραψε πώς το ξύδι επιδρά πάνω στα μέταλλα, δημιουργώντας έτσι χρήσιμες (ιδιαίτερα στην τέχνη) χρωστικές, που περιλάμβαναν το «λευκό μόλυβδο»[13] και τον «πράσινο χαλκό»[14].
Οι Ρωμαίοι έβραζαν ξινισμένο κρασί σε μολύβδινα (Pb) δοχεία για να παρασκευάσουν ένα πολύ γλυκό σιρόπι που ονομάζονταν «sapa». Η «sapa» ήταν πλούσια σε οξικό μόλυβδο, μια πολύ γλυκιά στη γεύση ουσία, που την απομόνωναν, την αποκαλούσαν «ζάχαρη του Κρόνου» και τη χρησιμοποιούσαν ως γλυκαντικό και ως φάρμακο, αλλά οδηγούσε σε μολυβδίαση[15] τη ρωμαϊκή αριστοκρατία (κυρίως) που την κατανάλωνε[16].
Κατά το 16ο αιώνα, ο Γερμανός αλχημιστής Ανδρέας Λιβάνιους (Andreas Libavius) περιέγραψε την παραγωγή ακετόνης με ξηρή απόσταξη οξικού μολύβδου, που αντιστοιχεί σε κετονική αποκαρβοξυλίωση. Η παρουσία νερού στο ξύδι έχει τόσο προφανείς επιπτώσεις στις ιδιότητες του οξικού οξέος, ώστε για αιώνες οι χημικοί πίστευαν (εσφαλμένα) ότι το παγόμορφο οξικό οξύ και το οξύ που βρίσκεται στο ξύδι είναι δυο διαφορετικές ουσίες, αλλά ο Γάλλος χημικός Πιερ Αντέτ (Pierre Adet) απέδειξε (τελικά) ότι είναι ταυτόσιμες[16][17].
Το 1845 ο Γερμανός χημικός Χέρμαν Κολμπέ (Hermann Kolbe) συνέθεσε για πρώτη φορά οξικό οξύ από ανόργανες χημικές ενώσεις. Συγκεκριμένα, χρησιμοποίησε αρχικά χλωρίωση του διθειάνθρακα (CS2, αμφιλεγόμενη ως ανόργανη ένωση) σε τετραχλωράνθρακα (CCl4). Στη συνέχεια ακολούθησε πυρόλυση του τετραχλωράνθρακα σε τετραχλωραιθένιο (Cl2C=CCl2), καταλήγοντας σε ηλεκτρολυτική αναγωγή του τελευταίου προς οξικό οξύ.[18]
Μέχρι το 1910, το περισσότερο παγόμορφο οξικό οξύ λαμβάνονταν από το πυρολιγνώδες υγρό, ένα προϊόν της απόσταξης ξύλου. Συγκεκριμένα, το οξικό οξύ απομονώνονταν από το υγρό αυτό μετά από επίδραση σε αυτό με «γάλα της ασβέστου» [Ca(OH)2], που οδηγούσε σε ενδιάμεση παραγωγή οξικού ασβεστίου [Ca(OAc)2], ακολουθούμενη από οξύνιση με θειικό οξύ (H2SO4), για την ανάκτηση του οξικού οξέος. Μέχρι εκείνη την εποχή η Γερμανία παρήγαγε 10.000 τόνους παγόμορφου οξικού οξέος, το 30% του οποίου αξιοποιούνταν στην παραγωγή ινδικής βαφής.[16][19]
Επειδή τόσο η μεθανόλη (MeOH), όσο και το μονοξείδιο του άνθρακα (CO) αποτελούν εμπορεύσιμες πρώτες ύλες, η καρβονυλίωση μεθανόλης φαίνονταν για μακρύ χρονικό διάστημα ως ελκυστική μέθοδος παραγωγής οξικού οξέος. Ο Βρετανός Χέντρι Ντρέυφους (Henri Dreyfus) στην (εταιρεία) British Celanese ανέπτυξε ένα πιλοτικό εργοστάσιο καρβοξυλίωσης μεθανόλης από το 1925. Ωστόσο, η έλλειψη πρακτικών υλικών που θα μπορούσαν να περιέχουν το σχετικό διαβρωτικό αντιδρών μείγμα υό τις υψηλές απαιτούμενες πιέσεις (≥ 200 atm) αποθάρρυναν την εμπορευματοποίηση τέτοιων διεργασιών. Η πρώτη εμπορικά εκμεταλλεύσιμη διεργασία καρβονυλίωσης μεθανόλης, που χρησιμοποιούσε καταλύτη κοβαλτίου, αναπτύχθηκε από τη Γερμανική χημική εταιρεία BASF, το 1963. To 1968, ανακαλύφθηκε ένας καταλύτης βασισμένος στο ρόδιο, {cis−[Rh(CO)2I2]−}, που μπορούσε να λειτουργεί αποτελεσματικά υπό χαμηλή πίεση, σχεδόν χωρίς παραπροϊόντα. Η Αμερικάνικη εταιρεία Monsanto Company έχτισε το πρώτο εργοστάσιο που χρησιμοποιούσε αυτήν τη μέθοδο το 1970. Έκτοτε η καταλυόμενη από ρόδιο καρβονυλίωση μεθανόλης έγινε η κυρίαρχη μέθοδος, με την επωνυμία «διεργασία Μονσάντο». Στα τέλη της δεκαετίας του 1990, η εταιρεία BP Chemicals εμπορευματοποίησε τον καταλύτη Cativa { [Ir(CO)2I2]–}, που βασίζεται στο ιρίδιο, με ακόμη μεγαλύτερη αποτελεσματικότητα σε σύγκριση με το κοβάλτιο, όντας επιπλέον φιλικότερη για το περιβάλλον, οπότε άρχισε να αντικαθιστά σταδιακά και σε μεγάλο βαθμό τη διεργασία Μονσάντο, ακόμη και μέσα στα ίδια παραγωγικά εργοστάσια.[20]
Παρουσία στο διαστρικό διάστημα
ΕπεξεργασίαΔιαστρικό οξικό οξύ ανακαλύφθηκε το 1996 από μια ομάδα υπό την ηγεσία του Ντέιβιντ Μέρινγκερ (David Mehringer)[21] χρησιμοποιώντας την πρώην Berkeley-Illinois-Maryland Association array, που βρίσκεται στο Ραδιοτηλεσκόπιο Χατ Κρηκ (Hat Creek Radio Observatory) και την πρώην Millimeter Array, που βρίσκεται στο Ραδιοτηλεσκόπιο Όουενς Βάλλεϋ (Owens Valley Radio Observatory). Πρωτοανιχνεύτηκε στο βόρειο μοριακό νέφος Τοξότη Β2 (που είναι επίσης γνωστό ως Μεγάλη Μοριακή πηγή Χέιματ του Τοξότη Β2, Sgr B2 Large Molecule Heimat source). Το οξικό οξύ έχει τη διάκριση να είναι το πρώτο μόριο που ανακαλύφθηκε στο διαστρικό διάστημα χρησιμοποιώντας μόνο ραδιοϋπερερυθρόμετρα. Σε όλες τις προηγούμενες μοριακές ανακαλύψεις διαστρικού διαστήματος που έγιναν στις περιοχές μηκών κύματος χιλιοστομέτρων και εκατοστομέτρων, τα απλά ραδιοτηλεσκόπια δίσκων ήταν τουλάχιστον μερικώς υπεύθυνα για τις ανιχνεύσεις.[21]
Δομή
ΕπεξεργασίαΕίναι το δεύτερο απλούστερο καρβονικό οξύ, μετά το μυρμηκικό οξύ.
| Δεσμοί[22] | ||||
| Δεσμός | τύπος δεσμού | ηλεκτρονική δομή | Μήκος δεσμού | Ιονισμός |
|---|---|---|---|---|
| C#2-H | σ | 2sp³-1s | 109 pm | 3% C- H+ |
| C#2-C#1 | σ | 2sp³-2sp² | 151 pm | |
| C=O | σ | 2sp²-2sp² | 132 pm | 19% C+ O- |
| π | 2p-2p | |||
| C-O | σ | 2sp²-2sp³ | 147 pm | 19% C+ O- |
| O-H | σ | 2sp³-1s | 96 pm | 32% O- H+ |
| Γωνίες | ||||
| HCH | 109°28' | |||
| HCC | 109°28' | |||
| CCO | 120° | |||
| COO | 120° | |||
| OCO | 120° | |||
| COH | 104,45° | |||
| Στατιστικό ηλεκτρικό φορτίο[23] | ||||
| Ο (OH) | -0,51 | |||
| Ο (=O) | -0,38 | |||
| C#2 | -0,09 | |||
| Η (HC) | +0,03 | |||
| Η (OH) | +0,32 | |||
| C#1 | +0,57 | |||
Ισομέρεια
Επεξεργασία- μυρμηκικός μεθυλεστέρας: Ένας καρβονικός εστέρας με τύπο: HCOOCH3.
- Υδροξυαιθανάλη: Μια υδροξυαλδεΰδη με τύπο: HOCH2CHO.
- 1,1-αιθενοδιόλη: Μια ασταθής αλκενοδιόλη, έλασσον ταυτομερές του οξικού οξέος, με τύπο: CH2=C(OH)2.
- 1,2-αιθενοδιόλη: Μια ασταθής αλκενοδιόλη, έλασσον ταυτομερές της υδροξυαιθανάλης, με τύπο: HOCH=CHOH. Έχει δύο (2) γεωμετρικά ισομερή.
- Οξιρανόλη: Μια ετεροκυκλική αλκοόλη με τύπο:
- 1,2-διοξετάνιο: Ένα ετεροκυκυκλικό υπεροξείδιο με τύπο:
- 1,3-διοξετάνιο: Ένας ετεροκυκλικός διαιθέρας με τύπο:
- Μεθυλοδιοξιράνιο: Ένα ετεροκυκυκλικό υπεροξείδιο με τύπο:
- Βινυλυδροϋπεροξείδιο ή βινυλοδιοξειδάνιο, με ημισυντακτικό τύπο CH2=CHO2H.
- 1-υδροϋπεροξυαιθυλιδένιο, με ημισυντακτικό τύπο CH3C(O2H):.
- 2-υδροϋπεροξυαιθυλιδένιο, με ημισυντακτικό τύπο :CHCH2O2H.
- Μεθυλυπεροξυμεθυλιδένιο, με ημισυντακτικό τύπο CH3O2CH:.
- 2,2-διυδροξυαιθυλιδένιο, με ημισυντακτικό τύπο :CHCH(OH)2.
- 1,2-διυδροξυαιθυλιδένιο, με ημισυντακτικό τύπο HOCH2C(OH):.
- Μεθοξυδροξυμεθυλιδένιο, με ημισυντακτικό τύπο CH3OC(OH):.
- Υδροξυμεθοξυμεθυλιδένιο, με ημισυντακτικό τύπο :CHOCH2OH.
- Έχει δηλαδή δεκαέξι (16) ισομερή θέσης. Αν συνυπολογιστούν και τα γεωμετρικά, έχει συνολικά δεκαεπτά (17) ισομερή.
Παραγωγή
ΕπεξεργασίαΤο οξικό οξύ παράγεται τόσο συνθετικά όσο και βιοχημικά, δηλαδή με τη βοήθεια κάποιου ενζύμου. Ο δεύτερος τρόπος χρησιμοποιείται σχεδόν αποκλειστικά για την παραγωγή ξυδιού, γιατί σε πολλές χώρες του κόσμου η νομοθεσία απαιτεί τόσο το επιτραπέζιο ξύδι, όσο και αυτό που χρησιμοποιείται με άλλους τρόπους στα τρόφιμα, να είναι βιολογικής προέλευσης.
Βιοχημικές μέθοδοι
ΕπεξεργασίαΑερόβια ζύμωση[24]
ΕπεξεργασίαΜε την οξική ζύμωση, δηλαδή την οξείδωση της αιθυλικής αλκοόλης που περιέχεται σε αλκοολούχα ποτά, παράγεται οξικό οξύ. Η οξείδωση αυτή γίνεται με τη βοήθεια ορισμένων βακτηρίων ή μυκήτων τα οποία μεταφέρουν το ένζυμο αιθανολοξειδάση που καταλύει την απευθείας αντίδραση της αιθανόλης (CH3CH2OH) με διοξυγόνο (O2), που προέρχεται από τον ατμοσφαιρικό αέρα. Η συνολική στοχειομετρική εξίσωση της αντίδρασης που γίνεται είναι η εξής:
Η χημικά καθαρή αλκοόλη δεν οξειδώνεται έτσι σε οξικό οξύ. Αυτό συμβαίνει γιατί δεν περιέχει τους μύκητες που παράγουν την αιθανολοξειδάση. Οι μύκητες για να ζήσουν χρειάζονται κατάλληλες αζωτούχες θρεπτικές ουσίες, τις οποίες δεν περιέχει η χημικά καθαρή αλκοόλη. Επομένως για να γίνει η οξοποίηση, πρέπει να υπάρχει κρασί ή γενικότερα αλκοολούχο μείγμα που να συμπεριέχει τις κατάλληλες θρεπτικές ουσίες, μύκητες και (ανεκτή από τους τελευταίους) θερμοκρασία (συνήθως 18-35 °C). Επίσης η συγκέντρωση της αιθανόλης δεν πρέπει να είναι ούτε μικρότερη του 2% ούτε ανώτερη του 12%, γιατί τότε οι μύκητες αδρανοποιούνται.
Έχουν αναπτυχθεί διάφορες μέθοδοι ζύμωσης, με απώτερο σκοπό την επιτάχυνση της διαδικασίας:
- Μέθοδος της Ορλεάνης: Το αλκοολούχο μείγμα μπαίνει σε μεγάλα δοχεία με τρύπες μαζί με έτοιμο ξύδι και αφήνεται για μεγάλο διάστημα. Ύστερα αφαιρείται μια ποσότητα ξυδιού και προστίθεται μια ίση ποσότητα ποτού. Αυτό συνεχίζεται όσο χρειάζεται.
- Γερμανική μέθοδος ή μέθοδος γρήγορης οξοποίησης: Εφαρμόστηκε για πρώτη φορά στη Γερμανία το 1823 και θεωρείται η πρώτη μοντέρνα εμπορική διαδικασία. Αποβλέπει στην γρήγορη μετατροπή του αλκοολούχου μείγματος σε ξύδι, με την αύξηση της επιφάνειας του διαλύματος που έρχεται σε επαφή με τον αέρα, ώστε να επιταχυνθεί η οξείδωση. Αυτό επιτυγχάνεται με τη διαβίβαση του διαλύματος, αναμεμειγμένου με ξύδι, από την κορυφή μέσα σε δρύινα βαρέλια που περιέχουν ροκανίδια εμποτισμένα με ξύδι. Από τον πυθμένα διαβιβάζεται ο αέρας είτε φυσικά είτε με κάποια μηχανική μέθοδο. Το μείγμα διαχωρίζεται σε σταγόνες, άρα αποκτά μεγάλη επιφάνεια επαφής με τον αέρα και η μετατροπή γίνεται πολύ γρήγορα, σε εβδομάδες αντί για μήνες της προηγούμενης μεθόδου.
- Σήμερα, η μεγαλύτερη ποσότητα ξυδιού παράγεται με μια μέθοδο που περιέγραψαν πρώτοι το 1949 οι Otto Hromatka και Heinrich Ebner. Το αλκοολούχο διάλυμα υφίσταται ζύμωση προς ξύδι σε μια δεξαμενή που αναδεύεται συνεχώς, ενώ το οξυγόνο τροφοδοτείται με μορφή φυσαλίδων μέσα στο διάλυμα. Με αυτό τον τρόπο, ξύδι με 15% οξικό οξύ μπορεί να παρασκευαστεί μέσα σε 2 – 3 ημέρες.
Αναερόβια ζύμωση
ΕπεξεργασίαΟρισμένα είδη αναερόβιων βακτηρίων, όπως πολλά μέλη του γένους Clostridium, μπορούν να μετατρέψουν τη γλυκόζη που περιέχεται σε σάκχαρα, όπως η ζάχαρη ή το άμυλο, κατευθείαν σε οξικό οξύ, χωρίς την παρουσία ενδιάμεσης αιθανόλης. Η συνολική στοχειομετρική εξίσωση της αντίδρασης που γίνεται είναι η εξής:
Τα βακτήρια όμως αυτά είναι λιγότερο ανθεκτικά στα οξέα με αποτέλεσμα να μπορούν να παράγουν ξίδι πολύ χαμηλής περιεκτικότητας σε οξικό οξύ, σε αντίθεση με τα αερόβια που μπορούν να φτάσουν μέχρι και 20%. Έτσι, παρόλο που αυτά τα βακτήρια ήταν γνωστά από το 1940, η βιομηχανική χρήση τους παραμένει περιορισμένη.
Συνθετικές βιομηχανικές μέθοδοι
ΕπεξεργασίαΣυνθετικά το οξικό οξύ παρασκευάζεται με τέσσερες (4) διαφορετικές μεθόδους: με οξείδωση του αιθενίου, οξείδωση του βουτανίου και καρβοξυλίωση της μεθανόλης[25]:
Οξείδωση αιθενίου
ΕπεξεργασίαΠρώτη ύλη της μεθόδου αυτής, είναι το αιθένιο (CH2=CH2), από το οποίο παρασκευάζεται η αιθανάλη (CH3CHO). Η ενός σταδίου διαδικασία Wacker, περιλαμβάνει τη χρήση χλωριούχου χαλκού (CuCl2), σε υδατικό διάλυμα, και μια μικρής ποσότητας χλωριούχου παλλαδίου (PdCl2), ως καταλύτη:
- Η απόδοση φτάνει το 95%, ενώ με περαιτέρω οξείδωση παράγεται οξικό οξύ:
- Ως καταλύτες χρησιμοποιούνται οξικό μαγγάνιο [(CH3COO)2Mn] ή κοβάλτιο [(CH3COO)2Co], σε θερμοκρασία 55 – 80 °C και πίεση 1 – 5 bar. Η απόδοση φτάνει στο 95%.
Οξείδωση βουτανίου
ΕπεξεργασίαΗ δεύτερη αυτή συνθετική μέθοδος χρησιμοποιεί ως πρώτη ύλη το βουτάνιο το οποίο παραλαμβάνεται ως κλάσμα του πετρελαίου, ενώ η οξείδωση γίνεται με ατμοσφαιρικό αέρα. Η διαδικασία κάνει χρήση οξικού κοβαλτίου, μαγγανίου ή χρωμίου [(CH3COO)3Cr], ως καταλύτη και πραγματοποιείται σε θερμοκρασία 50 – 250 °C και πίεση ~55 bar:
Καρβονυλίωση μεθανόλης
ΕπεξεργασίαΗ τρίτη και πιο σημαντική μέθοδος περιλαμβάνει την αντίδραση της μεθανόλης (CH3OH) με μονοξείδιο του άνθρακα (CO), με χρήση κοβάλτιου, ρόδιου, ιρίδιου ή υδροϊωδίου (HI), ως καταλύτη, σε θερμοκρασία 175 °C και πίεση 1 bar:
Η απόδοση της μεθόδου φτάνει το 99% με βάση τη μεθανόλη και το 90% με βάση το μονοξείδιο του άνθρακα. Η διαδικασία περιλαμβάνει τρία (3) στάδια, όπως φαίνεται παρακάτω για την περίπτωση που χρησιμοποιείται ως «καταλύτης» το υδροϊώδιο:
Άλλες συνθετικές μέθοδοι
ΕπεξεργασίαΜε καρβοξυλίωση μεθυλαλογονιδίων
ΕπεξεργασίαΜε καρβοξυλίωση με διοξείδιο του άνθρακα (CO2) μεθυλαλογονιδίων, μέσω οργανομαγνησιακών ενώσεων (αντιδραστήρια Grignard) παράγεται οξικό οξύ[26]::
Με υδρόλυση αιθανονιτριλίου
ΕπεξεργασίαΜε υδρόλυση αιθανονιτριλίου (CH3CN) σε όξινο περιβάλλον παράγεται οξικό οξύ[27]:
Με οξείδωση αιθανίου, 2-βουτενίου, αιθανόλης ή αιθανάλης
Επεξεργασία1. Καταλυτική οξείδωση αιθανίου παράγεται αιθανάλη, με παραπέρα οξείδωση της οποίας (παραπάνω και παρακάτω αναγράφονται αρκετές μέθοδοι) παράγεται οξικό οξύ:
2. Με οξείδωση βουτενίου-2 (CH3CH=CHCH3) παράγεται οξικό οξύ[28]:
3. Με οξείδωση αιθανόλης (CH3CH2OH) παράγεται οξικό οξύ[29]:
4. Με οξείδωση αιθανάλης (CΗ3CHO) παράγεται οξικό οξύ[29]:
Από μηλονικό οξύ
ΕπεξεργασίαΑπό μηλονικό οξύ παράγεται οξικό οξύ[30]:
Φυσικές και φυσικοχημικές ιδιότητες
ΕπεξεργασίαΣε κανονικές συνθήκες είναι άχρωμο, διαβρωτικό και εύφλεκτο υγρό, με έντονη οσμή. Έχει σημείο τήξης στους 16,5 °C και κάτω από τη θερμοκρασία αυτή το καθαρό οξικό οξύ στερεοποιείται σχηματίζοντας κρυστάλλους, οπότε ονομάζεται παγόμορφο (glacial). Είναι πλήρως διαλυτό στο νερό και την αιθυλική αλκοόλη αλλά αδιάλυτο στον διθειάνθρακα.
Στο στερεό (κρυσταλλικό) οξικό οξύ τα μόρια σχηματίζουν ζεύγη (παρουσιάζει δηλαδή το φαινόμενο της συζεύξεως). Η σύζευξη αυτή των δυο μορίων που σχηματίζουν κάθε ζεύγος γίνεται με δεσμούς υδρογόνου[31]. Τα διμερή αυτά μόρια ανιχνεύονται και σε ατμούς της ένωσης, στους 120 °C. Τα διμερή μόρια υπάρχουν σε αρκετό βαθμό και στην υγρή φάση, καθώς και σε διαλύματα οξικού οξέος σε διαλύτες που δεν περιέχουν δεσμούς υδρογόνου[32], αλλά διασπώνται όταν το οξικό οξύ διαλύεται σε διαλύτες που περιέχουν δεσμούς υδρογόνου (όπως το νερό). Η ενέργεια διάσπασης του διμερούς μορίου εκτιμήθηκε σε 65-66 kJ/mol, ενώ η εντροπία διάσπασης σε 154-157 J mol−1 K−1[33]. Άλλα κατώτερα καρβοξυλικά οξέα επίσης διμερίζονται ομοίως[34].
Το υγρό οξικό οξύ είναι ένας υδρόφιλος πολικός πρωτικός διαλύτης παρόμοιος με το νερό και την αιθανόλη. Έχοντας μέτρια διηλεκτρική σταθερά (6,2) διαλύει όχι μόνο πολικές ενώσεις όπως τα ανόργανα άλατα και τα σάκχαρα, αλλά επίσης και μη πολικές χημικές ουσίες, όπως τα έλαια και κάποια χημικά στοιχεία όπως το θείο και το ιώδιο. Αναμιγνύεται ταχύτατα με άλλους πολικούς διαλύτες, όπως το νερό, αλλά και με μη πολικούς διαλύτες όπως το χλωροφόρμιο και το εξάνιο. Αλλά με ανώτερα αλκάνια, αρχίζοντας από το οκτάνιο, το οξικό οξύ δεν είναι πλέον τελείως αναμείξιμο και η αναμειξιμότητά του συνεχίζει να μειώνεται με την αύξηση του μήκους της ανθρακικής αλυσίδας των κανονικών αλκανίων[35]. Η διαλυτική ικανότητα και η αναμειξιμότητα του οξικού οξέος το κάνει να βρίσκει συχνά βιομηχανικές εφαρμογές, όπως η χρήση του ως διαλύτης για την παραγωγή διμεθυλοτερεφθαλικού οξέος[36].
Χημικές ιδιότητες και παράγωγα
Επεξεργασία΄Οξινος χαρακτήρας και καρβοξυλικά άλατα
ΕπεξεργασίαΟ πυρήνας του ατόμου υδρογόνου του καρβοξυλίου στα καρβοξυλικά οξέα, όπως και το οξικό οξύ, μπορεί να αποσπαστεί από το μόριο με ιονισμό:
Εξαιτίας της απελευθέρωσης υδρογονοκατιόντος (H+), το οξικό οξύ έχει όξινο χαρακτήρα. Το οξικό οξύ είναι ένα ασθενές μονοπρωτικό οξύ. Σε υδατικό περιβάλλον έχει pKa = 4,76. Η συζυγής του βάση είναι το οξικό ανιόν (CH3CO2−). Ένα υδατικό διάλυμα οξικού οξέος συγκέντρωσης 1 Μ, δηλαδή περίπου στη συγκέντρωση που έχει το οικιακό ξύδι, έχει pH = 2,4, δείχνοντας ότι μόλις το 4‰ των μορίων του οξικού οξέος έχει διασταθεί. Ωστόσο, σε ένα πολύ αραιό υδατικό διάλυμα οξικού οξέος (< 10−6 M), διίσταται περίπου το 90% των μορίων του.
Το οξικό οξύ αντιδρά με ορισμένα μέταλλα μέταλλα και βάσεις σχηματίζοντας άλατα με σύγχρονη έκλυση υδρογόνου ή νερού αντίστοιχα:
Αποκαρβοξυλίωση
Επεξεργασία1. Με θέρμανση οξικού νατρίου παίρνουμε διοξείδιο του άνθρακα και μεθάνιο[37]:
2. Με ηλεκτρόλυση οξικού νατρίου (μέθοδος Kolbe), παράγονται διοξείδιο του άνθρακα και αιθάνιο[38]:
3. Με θέρμανση αλάτων του με ασβέστιο (ή βάριο) παράγεται προπανόνη[39]:
4. Με επίδραση βρωμίου σε οξικό άργυρο παράγεται μεθυλοβρωμίδιο - Αντίδραση Hunsdiecker[40]:
Αναγωγή
ΕπεξεργασίαΤo οξικό οξύ ανάγεται με λιθιοαργιλιοϋδρίδιο (LiAlH4) ή νατριοβοριοϋδρίδιο (NaBH4) προς αιθανόλη[41]:
Οξείδωση
ΕπεξεργασίαΤo οξικό οξύ οξειδώνεται σε οξικό υπεροξύ από το υπεροξείδιο του υδρογόνου (H2O2), σε όξινο περιβάλλον[42]:
Εστεροποίηση
Επεξεργασία
Αλογόνωση
Επεξεργασία1. Με επίδραση αλογόνων, παρουσία ερυθρού φωσφόρου, παράγεται αλοξικό οξύ:
- Η επίδραση φθορίου (F2) αποφεύγεται για λόγους ασφαλείας.
2. Με επίδραση αλογονωτικών μέσων παράγονται ακετυλοαλογονίδια[44]::
- α. Με SOCl2:
- β. Με PCl5:
- γ. Με PX3, όπου X: Cl, Br, I.
- Για το ακετυλοφθορίδιο προτιμάται η υποκατάσταση σε ακετυλοχλωρίδιο:
Επίδραση καρβενίων
ΕπεξεργασίαΜε επίδραση καρβενίων παράγεται ένα μίγμα προϊόντων. Π.χ. με μεθυλένιο έχουμε περίπου την παρακάτω στοιχειομετρική εξίσωση:
- Η παραπάνω στοιχειομετρική εξίσωση είναι άθροισμα κατά μέλη των ακόλουθων δράσεων:
- Παρεμβολή στους τρεις (3) δεσμούς C-H. Παράγεται προπανικό οξύ, ένα καρβονικό οξύ.
- Παρεμβολή στον ένα (1) δεσμό O-H. Παράγεται οξικός μεθυλεστέρας, ο μεθυλεστέρας του οξικού οξέος.
- Κυκλοπροσθήκη στον ένα (1) δεσμό C=O. Παράγεται 2-μεθυλοξιρανόλη, μια ετεροκυκλική αλκοόλη.
- Συνολικά δηλαδή πέντε (5) παράγωγα προϊόντα, που είναι πρακτικά ισοδύναμα (σ' αυτήν την περίπτωση) σε παραγωγή, εξαιτίας της μεγάλης δραστικότητας του μεθυλενίου, που ως δίριζα κάνει σχεδόν απόλυτα κινητικές (δηλαδή όχι εκλεκτικές) τις αντιδράσεις του.
Βιοχημεία
ΕπεξεργασίαΣε φυσιολογικά pH το οξικό οξύ βρίσκεται συνήθως σε μεγάλο βαθμό ιονισμένο, δηλαδή στη μορφή των οξικών ανιόντων. Η ακετυλομάδα, που παράγεται από το οξικό οξύ, είναι θεμελιώδης για όλες τις (γνωστές) μορφές ζωής. Όταν συνδέεται με το συνένζυμο Α, αποτελεί κεντρική για το μεταβολισμό των σακχάρων και των λιπών. Αντιθετα από τα μακρύτερης ανθρακικής αλυσίδας καρβοξυλικά οξέα (που ονομάζονται λιπαρά οξέα), το οξικό οξύ δεν βρίσκεται στη φύση με τη μορφή τριγλυκεριδίων του. Ωστόσο, το τεχνητό τριγλυκερίδιο του οξικού οξέος, που ονομάζεται τριακετίνη (τριοξικός γλυκερινεστέρας) είναι συνηθισμένο πρόσθετο τροφίμων και βρίσκεται σε κοσμιτικά υλικά και σε ορισμένα φαρμακευτικά προϊόντα[45].
Εφαρμογές
ΕπεξεργασίαΗ αρχαιότερη και πιο γνωστή, αν και όχι η μεγαλύτερη, χρήση του οξικού οξέος είναι με τη μορφή του ξυδιού. Το ξίδι είναι ένα αραιό διάλυμα του οξικού οξέος σε νερό, το οποίο παράγεται συνήθως με οξείδωση της αιθυλικής αλκοόλης. Το παραγόμενο ξίδι έχει κατά το περισσότερο δυνατόν, το άρωμα, τη γεύση και το χρώμα της πρώτης ύλης που χρησιμοποιήθηκε (κρασί, μπύρα κτλ). Τα διάφορα ξύδια έχουν οξύτητα η οποία εκφράζεται σε οξικό οξύ από 4%-12% με συνηθισμένες τιμές 5 – 8%. Πάνω από 12% δεν υπάρχουν ξίδια διότι θανατώνονται οι μικροοργανισμοί που τα παράγουν.
Η μεγαλύτερη χρήση του οξικού οξέος είναι ως πρώτη ύλη για την παραγωγή του οξικού βινυλεστέρα. Στην αντίδραση επιπλέον συμμετέχει αιθυλένιο και οξυγόνο ή ακετυλένιο παρουσία παλλαδίου ως καταλύτη:
Ο οξικός βινυλεστέρας χρησιμοποιείται ως πρώτη ύλη (μονομερές) για την παραγωγή είτε του ομοπολυμερούς του είτε συμπολυμερών με άλλα μονομερή όπως για παράδειγμα ο ακρυλικός βουτυλεστέρας. Τα πολυμερή αυτά έχουν ευρεία χρήση σήμερα ως συγκολλητικά (κυρίως για ξύλα) και ως επικαλυπτικά (πλαστικά χρώματα).
Η αμέσως επόμενη μεγαλύτερη χρήση είναι στην παραγωγή του οξικού ανυδρίτη με αντίδραση συμπύκνωσης δύο μορίων οξικού οξέος. Το προϊόν στη συνέχεια χρησιμοποιείται για την παραγωγή οξικής κυτταρίνης, πρώτης ύλης στις μαγνητικές ταινίες, συνθετικών ινών ενώ με θέρμανσή του (οξικού ανυδρίτη) με σαλικυλικό οξύ παράγεται η ασπιρίνη (ακετυλοσαλικυλικό οξύ). Με παρόμοια αντίδραση η μορφίνη παράγει ηρωίνη.
Επίσης χρησιμοποιείται στην παραγωγή άλλων σημαντικών οξικών εστέρων όπως ο οξικός αιθυλεστέρας και ο οξικός βουτυλεστέρας, σημαντικών διαλυτών βιομηχανικής χρήσης, ενώ το ίδιο χρησιμοποιείται ως διαλύτης στην παραγωγή του τερεφθαλικού οξέος, πρώτης ύλης των γνωστών πλαστικών μπουκαλιών PET.
Ακόμα χρησιμοποιείται σαν πρόσθετο τροφίμων (Ε260), κυρίως ως μέσο οξίνισης και αντιβακτηριδιακό.
Ασφάλεια - Υγεία
ΕπεξεργασίαΤο πυκνό οξικό οξύ είναι εύφλεκτο και διαβρωτικό υγρό, γι' αυτό χρειάζεται ιδιαίτερη προσοχή τόσο στη χρήση του όσο και στο υλικό των δεξαμενών μέσα στο οποίο θα αποθηκευτεί.
Η Ευρωπαϊκή Ένωση έχει κατατάξει τα διαλύματα του οξικού οξέος σε τρεις κατηγορίες ανάλογα με την περιεκτικότητά τους. Έτσι:[46]
| Συγκέντρωση κατά βάρος | Επισήμανση | Φράσεις R |
|---|---|---|
| ≥ 90% | Διαβρωτικό (C) | 35 |
| 25% - 90% | Διαβρωτικό (C) | 34 |
| 10% - 25% | Ερεθιστικό (Xi) | 36/38 |
Αντίθετα τα αραιά διαλύματα, όπως το ξύδι ή με τη μορφή που χρησιμοποιείται ως πρόσθετο στα τρόφιμα, είναι αβλαβές και δεν έχει αναφερθεί καμία παρενέργεια στους ανθρώπους. Πρέπει μόνο να αποφεύγεται από άτομα που έχουν (πολύ σπάνια) δυσανεξία στο ξύδι[47].
Αναφορές και σημειώσεις
Επεξεργασία- ↑ Σημείωση:Για εναλλακτικές ονομασίες δείτε τον πίνακα πληροφοριών.
- ↑ Σημείωση: Το Ac αντιστοιχεί εδώ με συντομογραφία της ακετυλομάδας (CH3CO). Να μη συγχέεται αυτό το Ac με το χημικό σύμβολο του ακτίνιου, που είναι χημικόστοιχείο. Για το λόγο αυτό ενίοτε γράφεται και AcOH. Επίσης σε μέρος της βιβλιογραφίας το Ac αντιστοιχεί με την αιθανική ομάδα (CH3COO), οπότε στην περίπτωση αυτή η συντομογραφία του αιθανικού οξέος γίνεται AcH.
- ↑ "Food and Drug Regulations (C.R.C., c. 870)". Consolidated Regulations. Canadian Department of Justice. 31 May 2013. Retrieved 21 July 2013.
- ↑ UK Food Standards Agency: "Current EU approved additives and their E Numbers". Retrieved 27 October 2011.
- ↑ US Food and Drug Administration: "Listing of Food Additives Status Part I". Retrieved 27 October 2011.
- ↑ Australia New Zealand Food Standards Code"Standard 1.2.4 - Labeling of ingredients". Retrieved 27 October 2011.
- ↑ Hosea Cheung; Robin S. Tanke; G. Paul Torrence (2005), "Acetic Acid", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a01_045.pub2
- ↑ IUPAC Provisional Recommendations 2004 Chapter P-12.1; page 4
- ↑ Armarego,W.L.F. and Chai,Christina (2009). Purification of Laboratory Chemicals, 6th edition. Butterworth-Heinemann. ISBN 1-85617-567-7.
- ↑ Cooper, Caroline (9 August 2010). Organic Chemist's Desk Reference (2 ed.). CRC Press. pp. 102–104. ISBN 1-4398-1166-0.
- ↑ DeSousa, Luís R. (1995). Common Medical Abbreviations. Cengage Learning. p. 97. ISBN 0-8273-6643-4.
- ↑ Hendrickson, James B.; Cram, Donald J.; Hammond, George S. (1970). Organic Chemistry (3 ed.). Tokyo: McGraw Hill Kogakusha. p. 135.
- ↑ Οξικός μόλυβδος [(AcO)2Pb]
- ↑ Ένα μίγμα αλάτων του χαλκού (Cu), που περιλαμβάνει τον οξικό χαλκό [(AcO)2Cu]
- ↑ Δηλητηρίαση από μόλυβδο
- ↑ 16,0 16,1 16,2 Martin, Geoffrey (1917). Industrial and Manufacturing Chemistry (Part 1, Organic ed.). London: Crosby Lockwood. pp. 330–31.
- ↑ Adet, P. A. (1798). «Mémoire sur l'acide acétique (Memoir on acetic acid)». Annales de Chimie 27: 299–319.
- ↑ Goldwhite, Harold (September 2003). «This month in chemical history». New Haven Section Bulletin American Chemical Society 20 (3): 4. Αρχειοθετήθηκε από το πρωτότυπο στις 2009-09-29. https://web.archive.org/web/20090929005735/http://membership.acs.org/N/NewHaven/bulletins/Bulletin_2003-09.pdf. Ανακτήθηκε στις 2020-12-02.
- ↑ Schweppe, Helmut (1979). «Identification of dyes on old textiles». Journal of the American Institute for Conservation 19 (1/3): 14–23. doi:. Αρχειοθετήθηκε από το πρωτότυπο στις 2009-05-29. https://web.archive.org/web/20090529021302/http://aic.stanford.edu/jaic/articles/jaic19-01-003_1.html. Ανακτήθηκε στις 12 October 2005.
- ↑ Zoeller, J. R.; Agreda, V. H.; Cook, S. L.; Lafferty, N. L.; Polichnowski, S. W.; Pond, D. M. (1992). «Eastman Chemical Company Acetic Anhydride Process». Catalysis Today 13 (1): 73–91. doi:.
- ↑ 21,0 21,1 Mehringer, David M. και άλλοι. (1997). «Detection and Confirmation of Interstellar Acetic Acid». Astrophysical Journal Letters 480 (1): L71. doi:. Bibcode: 1997ApJ...480L..71M.
- ↑ Τα δεδομένα προέρχονται εν μέρει από το «Table of periodic properties of thw Ellements», Sagrent-Welch Scientidic Company και Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, Σελ. 34.
- ↑ Υπολογισμένο βάση του ιονισμού από τον παραπάνω πίνακα
- ↑ Ηλεκτρονική Εγκυκλοπαίδεια “Επιστήμη & Ζωή”.
- ↑ Speight J. G., “Chemical and Process Design Handbook”, McGraw-Hill, 2002.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.283, §12.2.1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.283, §12.2.2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.283, §12.2.3α.
- ↑ 29,0 29,1 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.283, §12.2.3β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.283, §12.2.4.
- ↑ Jones, R.E.; Templeton, D.H. (1958). «The crystal structure of acetic acid». Acta Crystallographica 11 (7): 484–487. doi:.
- ↑ Briggs, James M.; Toan B. Nguyen; William L. Jorgensen (1991). «Monte Carlo simulations of liquid acetic acid and methyl acetate with the OPLS potential functions». Journal of Physical Chemistry 95 (8): 3315–3322. doi:.
- ↑ Togeas, James B. (2005). «Acetic Acid Vapor: 2. A Statistical Mechanical Critique of Vapor Density Experiments». Journal of Physical Chemistry A 109 (24): 5438–5444. doi:. PMID 16839071.
- ↑ McMurry, John (2000). Organic Chemistry (5 έκδοση). Brooks/Cole. σελ. 818. ISBN 0-534-37366-6.
- ↑ Zieborak, K.; K. Olszewski (1958). «none». Bulletin de L'Academie Polonaise des Sciences-Serie des Sciences Chimiques Geologiques et Geographiques 6 (2): 3315–3322.
- ↑ Hosea Cheung; Robin S. Tanke; G. Paul Torrence. «Ullmann's Encyclopedia of Industrial Chemistry». Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:. ISBN 978-3527306732.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.285, §12.4.3α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.285, §12.4.3β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.285, §12.4.3γ.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.285, §12.4.3δ.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.285, §12.4.4.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.285, §12.4.5α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.285, §12.4.8α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.285, §12.4.8β.
- ↑ Fiume, M. Z.; Cosmetic Ingredients Review Expert Panel (June 2003). «Final report on the safety assessment of triacetin». International Journal of Toxicology 22 (Suppl 2): 1–10. doi:. PMID 14555416. http://www.ncbi.nlm.nih.gov/pubmed/14555416.
- ↑ «Η σελίδα της Ε.Ε. για την ταξινόμηση και την επισήμανση των επικίνδυνων ουσιών.». Αρχειοθετήθηκε από το πρωτότυπο στις 14 Ιουνίου 2007. Ανακτήθηκε στις 28 Ιουλίου 2008.
- ↑ Μία σελίδα με πληροφορίες για τα πρόσθετα τροφίμων.
Πηγές
Επεξεργασία- Ν. Αλεξάνδρου, Γενική Οργανική Χημεία, ΘΕΣΣΑΛΟΝΙΚΗ 1985
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
- Πολυχρόνη Σ. Καραγκιοζίδη: Ονοματολογία οργανικών ενώσεων, Θεσσαλονίκη 1991, Έκδοση Β΄.
- Ν. Αλεξάνδρου, Α. Βάρβογλη, Δ. Νικολαΐδη: Χημεία Ετεροκυκλικών Ενώσεων, Θεσσαλονίκη 1985, Έκδοση Β΄.
- Δ. Νικολαΐδη: Ειδικά κεφάλαια Οργανικής Χημεία, Θεσσαλονίκη 1983.
