Κυκλοπροπαναμίνη
Η κυκλοπροπαναμίνη[5] (αγγλικά cyclopropanamine) είναι μια οργανική χημική ένωση, που περιέχει άνθρακα, υδρογόνο και άζωτο, έχει χημικό τύπο C3H7N, είναι η απλούστερη κυκλοαλκαναμίνη, δηλαδή μονοκυκλική κορεσμένη μονοαμίνη. Η καθαρή κυκλοπροπαναμίνη, στις συνηθισμένες συνθήκες, δηλαδή σε θερμοκρασία 25°C και υπό πίεση 1 atm, είναι άχρωμο υγρό, παράγωγο της αμμωνίας, από την οποία προκύπτει (θεωρητικά) με αντικατάσταση ενός ατόμου υδρογόνου από κυκλοπροπύλιο. Ομοίως, όμως, μπορεί να θεωρηθεί ως παράγωγο του κυκλοπροπανίου, με αντικατάσταση ενός ατόμου υδρογόνου από αμινομάδα (-NH2). Με βάση το χημικό τύπο του (C3H7N) έχει τα ακόλουθα 11 ισομερή θέσης:
- 1-προπεν-1-αμίνη με σύντομο συντακτικό τύπο: CH3CH=CHNH2 (σε δύο (2) γεωμετρικά ισομερή).
- 1-προπεν-2-αμίνη με σύντομο συντακτικό τύπο: CH2=CHCH2NH2.
- 2-προπεναμίνη με σύντομο συντακτικό τύπο: CH3C(NH2)=CH2.
- N-μεθυλαιθεναμίνη ή βινυλομεθυλαμίνη με σύντομο συντακτικό τύπο: CH3NHCH=CH2.
- 1-προπανιμίνη με σύντομο συντακτικό τύπο: CH3CH2CH=NH.
- 2-προπανιμίνη με σύντομο συντακτικό τύπο: CH3C(=NH)CH3.
- N-μεθυλαιθανιμίνη με σύντομο συντακτικό τύπο: CH3N=CHCH3.
- Ν-αιθυλομεθανιμίνη με σύντομο συντακτικό τύπο: CH2=NCH2CH3.
- Αζετιδίνη ή 1,3-επαζωπροπάνιο με σύντομο συντακτικό τύπο
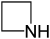 .
. - 2-μεθυλαζιριδίνη ή 1,2-επαζωπροπάνιο με σύντομο συντακτικό τύπο
 .
. - N-μεθυλαζιριδίνη ή Ν-μεθυλεπαζαιθάνιο με σύντομο συντακτικό τύπο
 .
.
| Κυκλοπροπαναμίνη | |||
|---|---|---|---|

| |||
| Γενικά | |||
| Όνομα IUPAC | Κυκλοπροπαναμίνη | ||
| Άλλες ονομασίες | Κυκλοπροπυλαμίνη Μονοκυκλοπροπυλαμίνη Αμινοκυκλοπροπάνιο | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | C3H7N | ||
| Μοριακή μάζα | 57,09 amu[1] | ||
| Σύντομος συντακτικός τύπος |
C3H5NH2 | ||
| Συντομογραφίες | cPrNH2 MCPA | ||
| Αριθμός CAS | 765-30-0 | ||
| SMILES | C1CC1N | ||
| InChI | HTJDQJBWANPRPF-UHFFFAOYSA-N[2] | ||
| Αριθμός EINECS | 212-142-2 | ||
| Αριθμός RTECS | GZ0685500[3] | ||
| PubChem CID | 24847670 | ||
| Ισομέρεια | |||
| Ισομερή θέσης | 11 | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | -50°C | ||
| Σημείο βρασμού | 49-50°C | ||
| Πυκνότητα | 824 kg/m3 | ||
| Δείκτης διάθλασης , nD |
1,420 | ||
| Τάση ατμών | 32.199 Pa | ||
| Εμφάνιση | Άχρωμο αέριο | ||
| Χημικές ιδιότητες | |||
| Ελάχιστη θερμοκρασία ανάφλεξης |
-26 °C | ||
| Σημείο αυτανάφλεξης | 275 °C[4] | ||
| Επικινδυνότητα | |||
| LD50 | 445 mg/kg | ||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Ονοματολογία Επεξεργασία
Η ονομασία «κυκλοπροπαναμίνη» προέρχεται από την ονοματολογία κατά IUPAC. Συγκεκριμένα, το αρχικό πρόθεμα «κυκλο-» δηλώνει την παρουσία ενός (1) δακτυλίου ανά μόριο της ένωσης, το πρόθεμα «προπ-» δηλώνει την παρουσία τριών (3) ατόμων άνθρακα στην κύρια (και μοναδική εφόσον δεν δηλώνονται υποκαταστάτες) ανθρακική αλυσίδα της ένωσης, το ενδιάμεσο «-αν-» δείχνει την παρουσία μόνο απλών δεσμών μεταξύ ατόμων άνθρακα στο μόριο και η κατάληξη «-αμίνη» φανερώνει ότι περιέχει μια αμινομάδα ως κύρια χαρακτηριστική ομάδα.
Δομή Επεξεργασία
Η δομή της μπορεί να βρεθεί αν αντικατασταθεί ένα άτομο υδρογόνου από ένα μόριο κυκλοπροπανίου με αμινομάδα.
| Δεσμοί[6] | ||||
| Δεσμός | τύπος δεσμού | ηλεκτρονική δομή | Μήκος δεσμού | Ιονισμός |
|---|---|---|---|---|
| C-H | σ | 2sp2-1s | 108,7 pm | 3% C- H+ |
| C-C-C | σ τριών ηλεκτρονίων και τριών κέντρων | 2sp2-2sp2-2sp2 | 151 pm (C-C) | |
| C-C-C | π τριών ηλεκτρονίων και τριών κέντρων | 2p-2p-2p | 151 pm (C-C) | |
| C-N | σ | 2sp2-2sp3 | 149 pm | 6% C+ Ν- |
| Ν-H | σ | 2sp3-1s | 101,7 pm | 17% N- H+ |
| Κατανομή φορτίων σε ουδέτερο μόριο | ||||
| N | -0,40 | |||
| C#2,#3 | -0,06 | |||
| C#1 | +0,03 | |||
| Η (Η-C) | +0,03 | |||
| Η (H-N) | +0,17 | |||
Παραγωγή Επεξεργασία
Με αμμωνία και αλοκυκλοπροπάνιο Επεξεργασία
Με επίδραση αμμωνίας (NH3) σε αλοκυκλοπροπάνιο (μέθοδος Hofmann) παράγεται κυκλοπροπαναμίνη[7]:
- Συμπαράγονται δικυκλοπροπυλαμίνη και τρικυκλοπροπυλαμίνη. Η χημική κινητική καθορίζει την τελική αναλογία αυτών των προϊόντων.
Με κυκλοπροπυλίωση φθαλιμιδικού καλίου Επεξεργασία
Με κυκλοπροπυλίωση φθαλιμιδικού καλίου (σύνθεση Gabriel) παράγεται κυκλοπροπαναμίνη[8]:
Με αναγωγή αζωτούχων ενώσεων Επεξεργασία
1. Με αναγωγή νιτροκυκλοπροπανίου παράγεται κυκλοπροπαναμίνη[9]:
2. Με αναγωγή κυκλοπροπανιμίνης παράγεται κυκλοπροπαναμίνη[10]:
Με αποικοδόμηση κυκλοπροπυλμεθαναμίδιου Επεξεργασία
Με αποικοδόμηση κυκλοπροπυλομεθαναμίδιου, μετάθεση Hofmann) παράγεται κυκλοπροπαναμίνη[11]:
- Το BrOK παράγεται επιτόπου («in citu») με την αντίδραση:
Με χλωραμίνη σε κυκλοπροπυλομαγνησιοαλογονίδιο Επεξεργασία
Με επίδραση χλωραμίνης (NH2Cl) σε αλοκυκλοπροπυλομαγνήσιο παράγεται κυκλοπροπαναμίνη[12]:
Από 1,3-διαλο-2-προπαναμίνη Επεξεργασία
Με επίδραση ψευδαργύρου σε 1,3-διαλο-2-προπαναμίνη παράγεται κυκλοπροπαναμίνη, με ενδομοριακή αντίδραση Wurtz[13]:
Χημικές ιδιότητες και παράγωγα Επεξεργασία
- Η κυκλοπροπαναμίνη συνδυάζει τις ιδιότητες αμίνης με εκείνες ένωσης με κυκλοπροπυλικό δακτύλιο (αντιδράσεις κυκλοπροσθήκης).
Παραδείγματα αντιδράσεων κυκλοπροσθήκης Επεξεργασία
Καταλυτική υδρογόνωση Επεξεργασία
Με καταλυτική υδρογόνωση σε κυκλοπροπαναμίνη παράγεται προπαναμίνη[14]:
Υδραλογόνωση Επεξεργασία
Με κυκλοπροσθήκη υδραλογόνου (ΗΧ) σε κυκλοπροπαναμίνη παράγεται αρχικά η ασταθής 1-αλοπροπαναμίνη, που αφυδραλογονώνεται παράγοντας τελικά προπανιμίνη:
Υδροξυαλογόνωση Επεξεργασία
Με κυκλοπροσθήκη υπαλογονώδους οξέος (HOX) σε κυκλοπροπαναμίνη παράγεται αρχικά η ασταθής 3-αλο-1-αμινο-1-προπανόλη, που αφυδατώνεται παράγοντας τελικά 3-αλοπροπανιμίνη:
Ενυδάτωση Επεξεργασία
Με κυκλοπροσθήκη ύδατος σε κυκλοπροπαναμίνη παράγεται ΄ 1-αμινο-1-προπανόλη, που αφυδατώνεται παράγοντας τελικά προπανιμίνη:
Διυδροξυλίωση Επεξεργασία
Με επίδραση υπεροξείδιο του υδρογόνου σε κυκλοπροπαναμίνη, παρουσία καρβονικών οξέων παράγεται κυκλοπροπαναμίνη 1-αμινο-1,3-προπανoδιόλη, που αφυδατώνεται παράγοντας τελικά 3-ιμινο-1-προπανόλη:
Αντιδράσεις ως αμίνη Επεξεργασία
Συμπεριφορά βάσης Επεξεργασία
Αλκυλίωση Επεξεργασία
Παράγει δευτεροταγείς κυκλοπροπυλαμίνες με αλκυλαλογονίδια (RX). Π.χ.:
Ακυλίωση Επεξεργασία
Παράγει δευτεροταγή αμίδια με ακυλαλογονίδια (RCOX). Π.χ.:
Ιμίνες Επεξεργασία
Με καρβονυλικές ενώσεις δείνει ιμίνες. Π.χ. με αλδεΰδες (RCHO) δίνει:
Οξείδωση Επεξεργασία
Οξειδώνεται προς νιτροκυκλοπροπάνιο:
Παρεμβολή καρβενίων Επεξεργασία
- Η αντίδραση είναι ελάχιστα εκλεκτική και αυτό σημαίνει ότι κατά προσέγγιση έχουμε;
- 1. Παρεμβολή στους τέσσερεις (4) ισότιμους δεσμούς C#2,#3H2-H. Παράγεται 2-μεθυλοκυκλοπροπαναμίνη.
- 2. Παρεμβολή στους δύο (2) ισότιμους δεσμούς NH-H. Παράγεται N-μεθυλοκυκλοπροπαναμίνη.
- 3. Παρεμβολή στον δεσμό C#1-H. Παράγεται 1-μεθυλοκυκλοπροπαναμίνη.
Προκύπτει, επομένως, μίγμα 2-μεθυλοκυκλοπροπαναμίνης ~57%, N-μεθυλοκυκλοπροπαναμίνης ~29% και 1-μεθυλοκυκλοπροπαναμίνης ~14%.
Σημειώσεις και αναφορές Επεξεργασία
- ↑ Διαδικτυακός τόπος sigmaaldrich.com
- ↑ Διαδικτυακός τόπος PubChem
- ↑ Διαδικτυακός τόπος «Chemical Book»
- ↑ Διαδικτυακός τόπος Chemicalland21.com
- ↑ Για εναλλακτικές ονομασίες δείτε τον πίνακα πληροφοριών.
- ↑ Τα δεδομένα προέρχονται εν μέρει από το «Table of periodic properties of thw Ellements», Sagrent-Welch Scientidic Company και Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, Σελ. 34.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.243, §10.2Α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.243, §10.2Β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.243, §10.2B2α και σελ. 247, §10.6.4α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.243, §10.2B2δ.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.243, §10.2B3.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.243, §10.2Γ3.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.154, §6.5.Β1
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 160, §6.11.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 155, §6.7.3.
Πηγές Επεξεργασία
- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, Οργανική Χημεία, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982