2-προπεν-1-όλη
Η 2-προπεν-1-όλη ή αλλυλική αλκοόλη είναι ονομασία της απλούστερης σταθερής αλκενόλης, δηλαδή ακόρεστης άκυκλης μονοσθενής αλκοόλης με ένα διπλό δεσμό. Ειδικότερα, αποτελεί και την απλούστερη και πιο αντιπροσωπευτική αλκοόλη της ομάδας των αλλυλικών αλκοολών, δηλαδή των αλκοολών που έχουν το υδροξύλιό τους σε άτομο άνθρακα που βρίσκεται αμέσως δίπλα (και όχι πάνω) από έναn (τουλάχιστον) διπλό δεαμό. Συνήθως αντιπροσωπεύεται από τους τύπους CH2=CHCH2OH και ViCH2OH. Με βάση το χημικό της τύπο, C3H6Ο έχει τα ακόλουθα οκτώ (8) ισομερή:
- 1-προπεν-1-όλη (ελάσσων ταυτομερές της προπανάλης) με σύντομο συντακτικό τύπο CH3CH=CHOH.
- 2-προπενόλη (ελάσσων ταυτομερές της προπανόνης) με σύντομο συντακτικό τύπο CH3C(OH)=CH2.
- Βινυλμεθυλαιθέρας ή μεθοξυαιθένιο με σύντομο συντακτικό τύπο CH3OCH=CH2.
- Κυκλοπροπανόλη με σύντομο συντακτικό τύπο
 .
. - Προπανάλη (κύριο ταυτομερές) της 1-προπεν-1-όλης με σύντομο συντακτικό τύπο CH3CH2CHO.
- Προπανόνη (κύριο ταυτομερές) της 2-προπενόλης με σύντομο συντακτικό τύπο CH3COCH3.
- Οξετάνιο με σύντομο συντακτικό τύπο
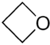 .
. - Μεθυλοξιράνιο με σύντομο συντακτικό τύπο

| 2-προπεν-1-όλη | |||
|---|---|---|---|

| |||
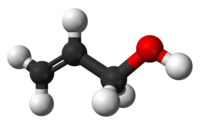
| |||
| Γενικά | |||
| Όνομα IUPAC | 2-προπεν-1-όλη | ||
| Άλλες ονομασίες | Αλλυλική αλκοόλη | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | C3H6O | ||
| Μοριακή μάζα | 58,08 amu | ||
| Σύντομος συντακτικός τύπος |
CH2=CHCH2OH | ||
| Συντομογραφίες | ViCH2OH | ||
| Αριθμός CAS | 107-18-6 | ||
| SMILES | C=CCO | ||
| InChI | 1/C3H6O/c1-2-3-4/h2,4H,1,3H2 | ||
| ChemSpider ID | 13872989 | ||
| Δομή | |||
| Ισομέρεια | |||
| Ισομερή θέσης | 9 | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | −129 °C | ||
| Σημείο βρασμού | 97 °C | ||
| Πυκνότητα | 854 kg/m3 | ||
| Διαλυτότητα στο νερό |
Αναμίξιμη | ||
| Χημικές ιδιότητες | |||
| Σημείο αυτανάφλεξης | 21 °C | ||
| Αυτοδιάσπαση | 378 °C | ||
| Επικινδυνότητα | |||
 
| |||
| Φράσεις κινδύνου | R10, R23/24/25, R36/37/38, R50 | ||
| Φράσεις ασφαλείας | (S1/2), S36/37/39, S38, S45, S61 | ||
| Κίνδυνοι κατά NFPA 704 |
|||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Είναι ένα υδατοδιαλυτό, άχρωμο υγρό (στις συνηθιαμένες συνθήκες) αλλά είναι περισσότερο τοξική από τις άλλες τυπικές (σχετικά) μικρομοριακές αλκοόλες. Χρησιμοποιήθηκε ως πρώτη ύλη για την 1,2,3-προπανοτριόλη, αλλά επίσης και για πολλές άλλες ενώσεις.
Παραγωγή
ΕπεξεργασίαΑπό αλλυλαλογονίδια
Επεξεργασία1. Με υδρόλυση αλλυλαγολογονιδίων (CH2=CHCH2X) παράγεται προπεν-2-όλη-1[1]:
- Χρειάζεται αραιό διάλυμα υδροξειδίου του νατρίου, γιστί διαφορετικά το αλογόνο μπορεί να αποσπαστεί, οπότε παίρνουμε προπαδιένιο. Επίσης η επιλογή ενός λιγότερο δραστικού αλογόνου, όπως το φθόριο ή έστω χλώριο, μπορεί να βοηθήσει να αποφευχθεί η απόσπαση. Εναλλακτικά μπορούμε να χρησιμοποιήσουμε υδροξείδιο του αργύρου, για μεγαλύτερη σιγουριά:
2. Με επίδραση καρβοξυλικών αλάτων (RCOONa) παράγονται αρχικά καρβοξυλικοί αλλυλεστέρες (RCOOCH2H=CH2), που υδρολόνται προς προπεν-2-όλη-1[2]:
Από αλλυλεστέρες
ΕπεξεργασίαΜε υδρόλυση μεθυλεστέρων (RCOOCH3) παράγεται προπεν-2-όλη-1[3]:
Από προπεν-2-άλη
ΕπεξεργασίαΜε αναγωγή προπεν-2-άλης (CH2=CHCHO):
Με λιθιοαργιλιοϋδρίδιο (LiAlH4)[4]:
Από προπενικό οξύ
ΕπεξεργασίαΜε αναγωγή προπενικού οξέος (CH2=CHCOOH) με LiAlH4[4]:
Από προπεν-2-αμίνη-1
ΕπεξεργασίαΜε επίδραση νιτρώδους οξέος (ΗΝΟ2) σε προπεν-2-αμίνη-1 (CH2=CHCH2NH2)[5]:
Από βουτεν-3-όλη-1
ΕπεξεργασίαΜε αποικοδόμιση της ανθρακικής αλυσίδας από βουτεν-3-όλη-1[6]::
Από προπένιο και αιθανικό οξύ
ΕπεξεργασίαΜε επίδραση οξυγόνου και αιθανικού οξέος σε προπένιο παράγεται προπεν-2-όλη-1:
- Η μέθοδος αυτή λέγεται αλλυλική οξυακετυλίωση.
Από προπένιο με αλλυλική οξείδωση από διοξείδιο του σεληνίου
ΕπεξεργασίαΜε επίδραση διοξειδίου του σεληνίου σε προπένιο παράγεται προπεν-2-όλη-1:
- Η μέθοδος αυτή ονομάζεται αλλυλική οξείδωση.
Με καταλυτική αφυδρογόνωση προπανόλης-1
ΕπεξεργασίαΜε καταλυτική αφυδρογόνωση προπανόλης-1 παράγεται προπεν-2-όλη-1:
Με αφυδάτωση προπανοδιόλης-1,3
ΕπεξεργασίαΜε ενδομοριακή αφυδάτωση προπανοδιόλης-1,3 παράγεται προπεν-2-όλη-1. Η αντίδραση ευνοείται σε σχετικά υψηηλές θερμοκρασίες, >150 °C[7]:
Με απόσπαση υδραλογόνου
ΕπεξεργασίαΜε απόσπαση υδραλογόνου (HX) από 3-αλοπροπανόλη-1 παράγεται προπεν-2-όλη-1[8]:
Με απόσπαση αλογόνου
ΕπεξεργασίαΜε απόσπαση αλογόνου (X2) από 2,3-διαλοπροπανόλη-1 παράγεται προπεν-2-όλη-1[9]:
Με μερική καταλυτική υδρογόνωση
ΕπεξεργασίαΜε μερική καταλυτική υδρογόνωση προπιν-2-όλης-1 παράγεται προπεν-2-όλη-1[10]
Χημικές ιδιότητες και παράγωγα
ΕπεξεργασίαΠαράγωγα ως αλκοόλης
ΕπεξεργασίαΑλκοολικά άλατα
Επεξεργασία1. Αντίδραση με αλκαλιμέταλλα[11]:
2. Αντίδραση με αμίδια μετάλλων[12]::
3. Αντίδραση με αιθινικά μέταλλα[13]::
4. Αντίδραση με αντιδραστήρια Grignard[14]::
- Ενδεικτική σειρά οξύτητας ορισμένων ενώσεων: νερό (H2O) > προπεν-2-όλη-1 (CH2=CHCH2OH) >μεθανόλη (CH3OH) > αιθίνιο (HC ≡ CH) > αμμωνία (NH3) > μεθάνιο (CH4).
Υποκατάσταση από αλογόνα
Επεξεργασία- Η αντίδραση με υδροαλογόνα δίνει και προϊόντα προσθήκης στο διπλό δεσμό. Γι' αυτό διαφοροποιούνται οι μέθοδοι από το αν και η προσθήκη είναι επιθυμητή ή αν η προσθήκη είναι ανεπιθύμητη:
1. Αντίδραση με υδροϊώδιο. Παράγεται 1,2-διιωδοπροπάνιο[15]:
2. Αντίδραση με άλλα αλογόνα (X: F, Cl, Br)[16]:
3. Αντίδραση με ισχυρά χλωριωτικά μέσα[17]:
- 1. Με PCl5:
4. Αντίδραση με τριβρωμιούχο φωσφόρο. Παράγεται αλλυλοβρωμίδιο[20]:
5. Αντίδραση με τριιωδιούχο φωσφόρο. Παράγεται αλλυλοϊωδίδιο[21]:
Αλλυλυλαιθέρες
ΕπεξεργασίαΠαραγωγή διαλλυλυλαιθέρα[22]:
Καρβοξυλικοί εστέρες
ΕπεξεργασίαΑντίδραση με ακυλιωτικά μέσα:
1. Εστεροποίηση με καρβοξυλικό οξύ[23]:
2. Εστεροποίηση με ανυδρίτη καρβοξυλικού οξέος[24]:
3. Εστεροποίηση με ακυλαλογονίδιο[25]:
- Όπου Py: πυριδίνη.
Οξείδωση
Επεξεργασία1. Με υπερμαγγανικό κάλιο (KMnO4). Παράγεται προπενικό οξύ[26]:
2. Με τριοξείδιο του χρωμίου (CrO3). Παράγεται αρχικά προπεν-2-άλη και στη συνέχεια, με περίσσεια τριοξειδίου του χρωμίου, προπενικό οξύ[27]:
- Η διαφορά είναι ότι στην περίπτωση #2, η οξείδωση μπορεί να σταματήσει στην προπεν-2-άλη.
- Στην περίπτωση #1 χρησιμοποιείται αραιό διάλυμα KMnO4. Αν χρησιμοποιηθεί πυκνό, το προπενικό οξύ οξοπροπανοδιιικό οξύ (HOOCCOCOOH)).
Ανοικοδόμηση προς βουτεν-3-όλη-1
ΕπεξεργασίαΥπάρχει μία (τουλάχιστον) μέθοδος για ανοικοδόμηση προπεν-2-όλη-1 προς βουτεν-3-όλη-1[6]:
1. Αρχίζει με την παραγωγή αλλυλοϊωδίδιου και μετά βουτεν-3-νιτρίλιου:
2. Υδρόλυση βουτεν-3-νιτρίλιου προς βουτεν-3-ικό οξύ και μετά αναγωγή προς βουτεν-3-όλη-1:
Ανοικοδόμηση προς πεντεν-4-όλη-1
ΕπεξεργασίαΑρχίζει με την παραγωγή αλλυλοϊωδίδιου και μετά, με επίδραση οξιρανίου σε αλλυλομαγνησιοϊωδίδιο, παράγεται πεντεν-4-όλη-1[6]:
Με αφυδάτωση προς προπαδιένιο
ΕπεξεργασίαΜε ενδομοριακή αφυδάτωση Προπεν-2-όλης-1 παράγεται προπαδιένιο. Η αντίδραση ευνοείται σε σχετικά υψηηλές θερμοκρασίες, >150 °C[7]:
Αντιδράσεις διπλού δεσμού
ΕπεξεργασίαΕνυδάτωση
Επεξεργασία1. Επίδραση θειικού οξέος και στη συνέχεια νερού (ενυδάτωση). Παράγεται προπανοδιόλη-1,2[28]:
2. Υδροβορίωση και στη συνέχεια επίδραση με υπεροξείδιο του υδρογόνου. Παράγεται αρχικά τρι(3-υδροξυπροπυλο)βοράνιο και στη συνέχεια προπανοδιόλη-1,3[29]:
- Προσθήκη διβορανίου έχει το ίδιο αποτέλεσμα.
3. Αντίδραση με οξικό υδράργυρο και έπειτα αναγωγή. Παράγεται προπανοδιόλη-1,2:
4. Υπάρχει ακόμη η δυνατότητα αλλυλικής υδροξυλίωσης κατά Prins με επίδραση αλδευδών ή κετονών σε προπένιο απουσία νερού. Π.χ. με μεθανάλη προκύπτει βουτεν-2-διόλη-1,4:
Προσθήκη υποαλογονώδους οξέως
ΕπεξεργασίαΜε επίδραση (προσθήκη) υποαλογονώδους οξέος (HOX) σε προπεν-2-όλη-1 παράγεται 3-αλοπροπανοδιόλη-1,2[30]:
- Το HOX παράγεται συνήθως επιτόπου με την αντίδραση:
Καταλυτική υδρογόνωση
ΕπεξεργασίαΜε καταλυτική υδρογόνωση προπεν-2-όλης-1 σχηματίζεται προπανόλη-1. Π.χ.[31]:
Αλογόνωση
ΕπεξεργασίαΜε προσθήκη αλογόνου (X2) (αλογόνωση) σε προπεν-2-όλη-1 έχουμε προσθήκη στο διπλό δεσμό. Παράγεται 2,3-διαλοπροπανόλη-1. Π.χ.[32]:
Υδραλογόνωση
ΕπεξεργασίαΜε προσθήκη υδραλογόνων (HX) (υδραλογόνωση) σε προπεν-2-όλη-1[33]:
1. Με τον πολικό μηχανισμό. Παράγεται 2-αλοπροπανόλη-1:
2. Με το μηχανισμό ελευθέρων ριζών. Παράγεται 3-αλοπροπανόλη-1:
Καταλυτική αμμωνίωση
Επεξεργασία1. Προσθήκη αμμωνίας (NH3). Παράγεται 2-αμινοπροπανόλη-1. Π.χ.:
2. Προσθήκη πρωτοταγούς αμίνης. Π.χ. με μεθαναμίνη παράγεται 2-μεθυλαμινοπροπανόλη-1:
3. Προσθήκη δευτεροταγούς αμίνης. Π.χ. με διμεθυλαμίνη παράγεται 2-διμεθυλαμινοπροπανόλη-1:
- Τα παραπάνω μέταλλα που αναφέρονται στη θέση του καταλύτη χρησιμοποιούνται με τη μορφή συμπλόκων τους και όχι σε μεταλλική μορφή.
Καταλυτική φορμυλίωση
ΕπεξεργασίαΜε προσθήκη μεθανάλης (CO + H2) σε προπένιο παράγεται 2-μεθυλο-3-υδροξυπροπανάλη ή 4-υδροξυβουτανάλη. Π.χ.:
- Τα παραπάνω μέταλλα που αναφέρονται στη θέση του καταλύτη χρησιμοποιούνται με τη μορφή συμπλόκων τους και όχι σε μεταλλική μορφή.
- Όπου . Εξαρτάται από την επιλογή του καταλύτη. Οι σχετικά ογκώδεις καταλύτες ευνοούν το δεύτερο παραγωγο.
Προσθήκη αλδεΰδών ή κετονών κατά Prins
ΕπεξεργασίαΜε επίδραση περίσσειας αλδευδών ή κετονών σε προπένιο απουσία νερού, σε χαμηλή θερμοκρασία παράγεται παράγωγο διοξανίου. Π.χ. με μεθανάλη παράγεται 4-υδροξυμεθυλο-1,3-διοξάνιο και 5-υδροξυμεθυλο-1,3-διοξάνιο:
Διυδροξυλίωση
ΕπεξεργασίαΗ διυδροξυλίωση προπενίου, αντιστοιχεί σε προσθήκη υπεροξείδιου του υδρογόνου (H2O2)[34]:
1. Επίδραση αραιού διαλύματος υπερμαγγανικού καλίου. Παράγει προπανοτριόλη-1,2,3:
2. Επίδραση καρβονικού οξέος και υπεροξείδιου του υδρογόνου. Παράγει προπανοτριόλη-1,2,3:
3. Μέθοδος Sharpless. Παράγει προπανοτριόλη-1,2,3:
4. Μέθοδος Woodward. Παράγει προπανοτριόλη-1,2,3:
5. Υπάρχει ακόμη δυνατότητα για 1,3-διυδροξυλίωση με επίδραση αλδεϋδών ή κετονών σε αιθένιο, παρουσία νερού. Αντίδραση Prins. Π.χ. με μεθανάλη παράγεται βουτανοτριόλη-1,2,4:
Οζονόλυση
ΕπεξεργασίαΜε επίδραση όζοντος (οζονόλυση) σε προπεν-2-όλη-1, παράγεται ασταθές οζονίδιο που τελικά διασπάται σε μεθανάλη και υδροξυαιθανάλη[35]:
Επίδραση πυκνού υπερμαγγανικού καλίου
ΕπεξεργασίαΜε επίδραση πυκνού διαλύματος υπερμαγγανικού καλίου (KMnO4) παράγεται τελικά διοξείδιο του άνθρακα[36]:
- Ενδιάμεσα παράγεται μεθανικό οξύ και αιθανοδιικό οξύ, που όμως είναι ευαίσθητα στην παρουσία περίσσειας υπερμαγγανικού καλίου και οξειδώνοται παραπέρα:
Αντίδραση Diels–Adler
ΕπεξεργασίαΚατά την επίδραση αλκαδιενίου (διένιου) σε προπεν-2-όλη-1 (διενόφιλο) έχουμε την ονομαζόμενη (αντίδραση Diels–Adler) που οδηγεί σε παραγωγή παραγώγου κυκλοεξενίου. Π.χ. με βουταδιένιο-1,3 παίρνουμε κυκλοεξεν-3-υλομεθαανόλη[37]:
Αντίδραση Pauson-Khand
ΕπεξεργασίαΚατά την επίδραση αλκίνια και μονοξειδίου του άνθρακα σε προπεν-2-όλη-1 έχουμε την ονομαζόμενη αντίδραση Pauson-Khand που στην περίπτωση αυτή οδηγεί σε παραγωγή παραγώγων κυκλοπεντόνης. Π.χ. με αιθίνιο παράγεται 4-υδροξυμεθυλοκυκλοπεντεν-2-όνη και 5-υδροξυμεθυλοκυκλοπεντεν-2-όνη:
Πολυμερισμός
ΕπεξεργασίαΔιακρίνονται τα ακόλουθα είδη πολυμερισμού προπεν-2-όλης-1, που όλα παράγουν πολυαλλυλική αλκοόλη[38]:
1. Κατιονικός. Π.χ.:
2. Ελευθέρων ριζών. Π.χ.:
- Όπου v ο βαθμός πολυμερισμού.
Φωτοχημικός διμερισμός
ΕπεξεργασίαΚατά το φωτοχημικό διμερισμό προπενίου σχηματίζεται 3-υδροξυμεθυλοκυκλοβουτυλομεθανόλη. Π.χ.[39]:
Φωτοχημική προσθήκη αλδεϋδών ή κετονών
ΕπεξεργασίαΜε επίδραση αλδευδών ή κετονών σε προπένιο απουσία νερού σχηματίζονται και φωτοχημικά παράγωγα οξετανίου (Αντίδραση Paterno–Büchi). Π.χ. με μεθανάλη παράγεται 3-υδροξυμεθυλοξετάνιο:
Προσθήκη καρβενίων
ΕπεξεργασίαΚατά την προσθήκη μεθυλενίου σε προπεν-2-όλη-1 παράγεται ένα μίγμα παραγώγων, με σύνθεση που δίνεται λίγο πιο κάτω[40]:
- Η αντίδραση είναι ελάχιστα εκλεκτική και αυτό σημαίνει ότι κατά προσέγγιση έχουμε:
- 1. Παρεμβολή στους δύο (2) δεσμούς =CH-H. Παράγεται βουτεν-2-όλη-1.
- 2. Παρεμβολή στους δύο (2) δεσμούς -CH(OH)-H: Παράγεται βουεν-3-όλη-1.
- 3. Παρεμβολή στον (1) δεσμό C-H. Παράγεται μεθυλοπροπεν-2-άλη-1.
- 4. Παρεμβολή στον (1) δεσμό O-H. Παράγεται αλλυλομεθυλαιθέρας.
- 5. Προσθήκη στον (ένα διπλό) δεσμό: 1. Παράγεται κυκλοπροπυλομεθανόλη.
Προκύπτει επομένως μίγμα βουτεν-2-όλης-1 ~29%, βουεν-3-όλης-1 ~29%, μεθυλοπροπεν-2-άλης-1 ~14%, αλλυλομεθυλαιθέρα και κυκλοπροπυλομεθανόλης ~14%.
- Με τη χρήση μεθυλενοδιιωδιδίου (CH2I2) και ψευδαργύρου (Zn) επικρατεί η προσθήκη, οπότε είναι:
Εφαρμογές
ΕπεξεργασίαΗ προπεν-2-όλη-1 χρησιμοποιείται κυρίως για την παραγωγή της προπανοτριόλης-1,2,3. Επίσης παράγει μια ποικιλία από πολυμεριζόμενους εστέρες. Π.χ. ο φθαλικός διαλλυλεστέρας[41].
Ασφάλεια
ΕπεξεργασίαΗ προπεν-2-όλη-1 είναι πιο τοξική από τις σχετικές μ' αυτήν αλκοόλες. Το κατώφλι ασφαλείας (TLV) της είναι 2 ppm. Είναι ένα δακρυγόνο[41]
Παραπομπές
Επεξεργασία- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.197, §8.2.3α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.197, §8.2.3β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.198, §8.2.5.
- ↑ 4,0 4,1 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 197, §8.2.2α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.198, §8.2.6.
- ↑ 6,0 6,1 6,2 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.198, §8.2.7.
- ↑ 7,0 7,1 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.153, §6.3.3.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.153, §6.3.1α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.153, §6.3.1β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.158, §6.9.4.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.199, §8.2.4α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.199, §8.2.4β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.199, §8.2.4γ.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.199, §8.2.4δ.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.199, §8.4.2β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.199, §8.4.2γ.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.199, §8.4.3α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.199, §8.4.3β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.199, §8.4.3γ.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.199, §8.4.3β., Br αντί Cl.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.199, §8.4.3β., I αντί Cl.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.199, §8.4.5β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.199, §8.4.4α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.199, §8.4.4β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.199, §8.4.4γ.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.200, §8.4.6α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.200, §8.4.6β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.3.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.5.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.4.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.6.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 157, §6.8.9.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 157, §6.8.10.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 158, §6.9.8.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 160, §6.10.2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 157, §6.8.11.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 157, §6.8.12.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 157, §6.8.7., σελ. 155, §6.7.3, R = HOCH2CH=CH ή HOCH2C=CH2 ή HOCHCΗ=CH2 ή OCH2CΗ=CH2
- ↑ 41,0 41,1 Ludger Krähling, Jürgen Krey, Gerald Jakobson, Johann Grolig, Leopold Miksche “Allyl Compounds” Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim. doi:10.1002/14356007.a01_425
Πηγές
Επεξεργασία- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
- Δημήτριου Ν. Νικολαΐδη: Ειδικά μαθήματα Οργανικής Χημείας, Θεσσαλονίκη 1983.
