Κυανιούχο κάλιο
Το κυανιούχο κάλιο (αγγλικά: potassium cyanide) είναι η ανόργανη ένωση με εμπειρικό τύπο KCN. Είναι το άλας που προκύπτει (θεωρητικά) από την εξουδετέρωση του υδροκυανίου (HCN) από το υδροξείδιο του καλίου (KOH).
| Κυανιούχο κάλιο | |||
|---|---|---|---|

| |||
| |||
| Γενικά | |||
| Όνομα IUPAC | Κυανιούχο κάλιο | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | KCN | ||
| Μοριακή μάζα | 65,12 amu | ||
| Αριθμός CAS | 151-50-8 | ||
| Αριθμός EINECS | 205-792-3 | ||
| Αριθμός RTECS | TS8750000 | ||
| Αριθμός UN | 1680 | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | 634,5 °C | ||
| Σημείο βρασμού | 1.625 °C | ||
| Πυκνότητα | 1.520 kg/m³ | ||
| Διαλυτότητα στο νερό |
716 kg/m³ (25 °C) 1.000 kg/m³ (100 °C) | ||
| Διαλυτότητα σε άλλους διαλύτες |
491 kg/m³ (20 °C, MeOH) 146 kg/m³ (HCHO) 57 kg/m³ (EtOH) 410 kg/m³ (NH2OH) διαλυτό στη γλυκερόλη | ||
| Δείκτης διάθλασης , nD |
1,410 | ||
| Εμφάνιση | Λευκό κρυσταλλικό στερεό | ||
| Χημικές ιδιότητες | |||
| pKa | 11,0 | ||
| Επικινδυνότητα | |||
   
| |||
| Φράσεις κινδύνου | R26/27/28, R32, R50/53 | ||
| Φράσεις ασφαλείας | S1/2, S7, S28, S29, S45, S60, S61 | ||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Υπό κανονικές συνθήκες περιβάλλοντος, το κυανιούχο κάλιο είναι μία λευκή, κρυσταλλική στερεή, με απατηλή εμφάνιση παρόμοια με της ζάχαρης, πολύ υδατοδιαλυτή. Το περισσότερο κυανιούχο κάλιο χρησιμοποιείται στην εξόρυξη χρυσού, στην οργανική σύνθεση, και στο γαλβανισμό. Μικρότερες εφαρμογές του συνπεριλαμβάνουν την κοσμηματοποιία, για επιχρύσωση και λείανση.[1]
Το κυανιούχο κάλιο είναι ιδιαίτερα τοξικό. Παρουσία υγρασίας, το στερεό κυανιούχο κάλιο εκπέμπει ποσότητες υδροκυανίου, εξαιτίας υδρόλυσης, το οποίο έχει οσμή που ομοιάζει με αυτήν των πικραμύγδαλων. [2] Ωστόσο δεν μπορούν όλοι οι άνθρωποι να αντιληφθούν τη μυρωδιά αυτή. Η ικανότητα οσφρητικής ανίχνευσης υδροκυανίου αποτελεί γενετικό χαρακτηριστικό.[3] Η γεύση του κυανιούχου καλίου έχει περιγραφεί ως ξυνή με μια αίσθηση καψίματος.[4]
Ιστορία
ΕπεξεργασίαΠριν από το 1900, δηλαδή πριν από την εφεύρεση της διεργασίας Κάστνερ (Castner process), το κυανιούχο κάλιο ήταν η πιο σημαντική πηγή παραγωγής των υπολοίπων κυανιούχων αλκαλιμετάλλων.[1] Μετά από αυτήν την ιστορική διεργασία (Κάστνερ), το κυανιούχο κάλιο παράχθηκε με θερμική αποσύνθεση σιδηροκυαιούχου καλίου {K4[Fe(CN)6]}:[5]
Παραγωγή
ΕπεξεργασίαΤο κυανιούχο κάλιο παράγεται με επίδραση υδροκυανίου σε υδατικό διάλυμα υδροξειδίου του καλίου, ακολουθούμενη από εξαέρωση του διαλύτη υπό κενό:[6]
Επειδή το υδροκυάνιο είναι επικίνδυνο στο χειρισμό, συχνά προτιμάται η χρήση μεθαναμίδιου (HCONH2) στη θέση του:
Περίπου 50.000 τόνοι κυανιούχου καλίου το χρόνο παράγονται παγκοσμίως.[1]
Δομή
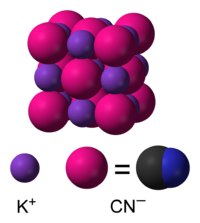
ΕπεξεργασίαΣε υδατικά διαλύματα, το κυανιούχο κάλιο διίσταται σε ενυδατωμένα κατιόντα καλίου (K+) και ενυδατωμένα κυανιούχα ανιόντα (CN-). Η συνηθισμένη μορφή του κυανιούχου καλίου, που είναι σταθερή υπό κανονικές συνθήκες περιβάλλοντος, το κρυσταλλικό του πλέγμα έχει την ίδια κυβική δομή με το χλωριούχο νάτριο (NaCl), με κάθε κατιόν καλίου να περιβάλλεται από έξι (6) κυανιούχα ανιόντα, και αντιστρόφως. Παρόλο που τα κυανιούχα ανιόντα είναι διατομικά, και επομένως λιγότερο συμμετρικά από τα μονοατομικά χλωριούχα ανιόντα, η περιστροφή τους είναι τόσο γρήγορη, που το μέσο σχήμα τους στο χρόνο είναι σφαιρικό. Σε χαμηλές θερμοκρασίες και υπό υψηλές πιέσεις, αυτή η ελεύθερη περιστροφή εμποδίζεται, δίνοντας μια λιγότερο συμμετρική κρυσταλλική δομή, κατά την οποία τα κυανιούχα ανιόντα τοποθετούνται σε διάταξη φύλλων.[7][8]
Εφαρμογές
ΕπεξεργασίαΤόσο το κυανιούχο κάλιο, όσο και το κυανιούχο νάτριο (NaCN) χρησιμοποιήθηκαν ευρύτατα στην οργανική σύνθεση, για την παραγωγή νιτριλίων (RCN) και καρβοξυλικών οξέων (RCO2H), ιδιαίτερα με την αντίδραση βον Ρίχτερ (von Richter reaction). Επίσης χρησιμοποιήθηκαν για τη σύνθεση υδαντοϊνών, που με τη σειρά τους μπορούν να είναι χρήσιμα συνθετικά ενδιάμεσα, όταν αντιδρούν με καρβονυλικές ενώσεις, όπως οι αλδεΰδες (RCHO), οι κετόνες (R2CO) και οι εστέρες (R2CO2), παρουσία ανθρακικού αμμωνίου [(NH4)2CO3].
Το κυανιούχο κάλιο χρησιμοποιήθηκε ως φωτογραφικός σταθεροποιητής, στη διεργασία υγρής πλάκας κολλοειδούς.[9] Το κυανιούχο κάλιο διαλύει τον άργυρο όπου δεν είχε γίνει αδιάλυτος, κατά την ανάπτυξη. Αυτό αποκαλύπτει και σταθεροποιεί την εικόνα, καθιστώντας τη μη φωτοευαίσθητη πλέον. Οι πιο σύγχρονες φωτογραφικές πλάκες προτιμούν να χρησιμοποιούν λιγότερο τοξικούς σταθεροποιητές, όπως για παράδειγμα θειοθειικό νάτριο (Na2S2O3), αλλά το κυανιούχο κάλιο εξακολουθεί επίσης να βρίσκεται σε χρήση.
Χρησιμοποιήθηκε από επαγγελματίες εντομολόγους ως μέσω θανάτωσης σε φιάλες συλλογής, καθώς τα έντομα που συγκεντρώνονται στο εσωτερικό τέτοιων φιαλών θανατώνονται μέσα σε δευτερόλεπτα, καθώς εισπνέουν τους ατμούς του υδροκυανίου που εκλύει το διάλυμα κυανιούχου καλίου που περιέχουν, ελαχιστοποιώντας έτσι τις βλάβες στο υπόλοιπο σώμα ακόμη και των πιο εύθραυστων δειγμάτων.
Χρυσοκυανιούχο κάλιο
ΕπεξεργασίαΣτην εξόρυξη χρυσού, το κυανιούχο κάλιο σχηματίζει με το ευγενές μέταλλο το υδατοδιαλυτό άλας χρυσοκυανιούχο κάλιο {K[Au(CN)2]} και υδροξείδιο του καλίου, μαζί με την παρουσία του οξυγόνου, συνήθως από τον περιβάλλοντα ατμοσφαιρικό αέρα, καθώς και νερού:
Με εντελώς όμοια διεργασία, αν χρησιμοποιηθεί κυανιούχο νάτριο, παράγεται χρυσοκυανιούχο νάτριο {Na4[Au(CN)2]}.
Τοξικότητα
ΕπεξεργασίαΤο κυανιούχο κάλιο αποτελεί ισχυρό αναστολέα για την κυτταρική αναπνοή, ενεργώντας στη μιτοχονδριακή οξειδάση του κυτοχρώματος c, με αποτέλεσμα να μπλοκάρει την οξειδωτική φωσφορυλίωση. Αυτή η δράση εμποδίζει το σώμα από το να οξειδώσει θρεπτικές ύλες για να παραγάγει χρήσιμη ενέργεια. Ως αποτέλεσμα προκύπτει γαλακτική οξείδωση, ως συνέπεια του αναερόβιου μεταβολισμού, που ενεργοποιείται από την αδυναμία χρήσης του αερόβιου. Τελικά, η οξεία δηλητηρίαση από κυανιούχα προκαλεί ερυθρή ή κοκκινωπή χροιά στο θύμα της, επειδή οι ιστοί του δεν μπορούν να χρησιμοποιήσουν το οξυγόνο στο αίμα. Οι επιπτώσεις από την επίδραση κυανιούχου καλίου ή κυανιούχου νατρίου είναι ταυτόσημες, αλλά τα συμπτώματα της δηλητηρίασης τυπικά συμβαίνουν λίγα λεπτά μετά την εισαγωγή του δηλητηρίου. Το θύμα χάνει τις αισθήσεις του, και ο εγκεφαλικός θάνατος ακολουθεί. Κατά την περίοδο ενέργειας της δηλητηρίασης το θύμα μπορεί να υποφέρει από σπασμούς. Ο θάνατος προκαλείται από εγκεφαλική υποξία. Η μέση θανατηφόρα δόση κυανιούχου καλίου για τους ανθρώπους εκτιμήθηκε σε 200-300 mg.[10]
Ένας αριθμός διακεκριμένων ανθρώπων φονεύθηκαν ή αυτοκτόνησαν με τη χρήση κυανιούχου καλίου, συμπεριλαμβάνοντας μέλη της Νέας Βοσνίας (Young Bosnia), διάσημα πρόσωπα από το Τρίτο Ράιχ (Third Reich), όπως ο Έρβιν Ρόμελ (Erwin Rommel), η Εύα Μπράουν (Eva Braun), σύντροφος του Αδόλφου Χίτλερ (Adolf Hitler), ο Γιόσεφ Γκέμπελς (Joseph Goebbels), ο Χάινριχ Χίμλερ (Heinrich Himmler) και ο Χέρμαν Γκαίρινγκ (Hermann Göring). οι Βρετανοί πράκτορες της περιόδου του Β΄ Παγκοσμίου Πολέμου, χρησιμοποιώντας ειδικά αυτοκτονικά χάπια, ο Άλαν Τούρινγκ (Alan Turing), επιστήμονας ηλεκτρονικών υπολογιστών, ο Γουάλλας Κάρολερς (Wallace Carothers), χημικός πολυμερών, ο Βίκτορ Μέγιερ (Viktor Meyer),[11] γερμανός χημικός του 19ου αιώνα, οι Λαοί του Ναού (Peoples Temple), ο δανός συγγραφέας Γκουστάβ Βιέντ (Gustav Wied) το 1914, μέλη του Απελευθερωτών Τίγρεων Ταμίλ Εαλάμ (Liberation Tigers of Tamil Eelam) που εμπλέχθηκαν στη δολοφονία του ινδού πρωθυπουργού Ρατζίβ Γκάντι (Rajiv Gandhi), ο Τζέισον Άλτομ (Jason Altom), που ήταν πολλά υποσχόμενος τελειόφοιτος φοιτητής στο εργαστήριο του νομπελίστα χημικού Ηλία Τζέιμς Κόρεϋ (EJ Corey), στο Χάρβαντ. Ακόμη, ο Σλόμπονταν Πράλιακ (Slobodan Praljak), ένας Κροάτης οπλαρχηγός, αυτοκτόνησε πίνοντας κυανιούχο κάλιο, κατά την ανάγνωση της υπόθεσής του στο Διεθνές Δικαστήριο για Εγκληματική Συμπεριφορά στην Πρώην Γιουγκοσλαβία (International Criminal Tribunal for the former Yugoslavia, ICTY), στη Χάγη, στις 29 Νοεμβρίου του 2017.[12]
Το κυανιούχο κάλιο μπορεί να αποτοξινωθεί αποτελεσματικά με υπεροξείδιο του υδρογόνου (H2O2) ή με διάλυμα υποχλωριώδους νατρίου (NaClO). Τέτοια διαλύματα πρέπει να διατηρούνται βασικά, ώστε να εξουδετερώνουν τυχούσα έκλυση υδροκυανίου:[1]
Σημειώσεις και αναφορές
Επεξεργασία- ↑ 1,0 1,1 1,2 1,3 Andreas Rubo, Raf Kellens, Jay Reddy, Joshua Wooten, Wolfgang Hasenpusch "Alkali Metal Cyanides" in Ullmann's Encyclopedia of Industrial Chemistry 2006 Wiley-VCH, Weinheim, Germany. doi:10.1002/14356007.i01_i01
- ↑ «Suicide note reveals taste of cyanide». 8 Ιουλίου 2006.
- ↑ Μεντελική Κληρονομικότητα του Ανθρώπου στο Διαδίκτυο (OMIM): 304300
- ↑ «The only taste: Cyanide is acrid». hindustantimes.com. Hindustan Times. 8 Ιουλίου 2006.
- ↑ Von Wagner, Rudolf (1897). Manual of chemical technology. New York: D. Appleton & Co. σελ. 474 & 477.
- ↑ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, (ISBN 0-07-049439-8)
- ↑ Crystallography Open Database, Structure of KCN
- ↑ H. T. Stokes; D. L. Decker; H. M. Nelson; J. D. Jorgensen (1993). «Structure of potassium cyanide at low temperature and high pressure determined by neutron diffraction». Physical Review B 47 (17): 11082–11092. doi:. https://zenodo.org/record/1233725..
- ↑ J. Towler, MD. "The Silver Sunbeam (Facsimile 1864 edition, 1969)" pg 119
- ↑ John Harris Trestrail III. Criminal Poisoning - Investigational Guide for Law Enforcement, Toxicologists, Forensic Scientists, and Attorneys (2nd edition). p. 119
- ↑ «Top 10 Scientists who Committed Suicide». 7 Οκτωβρίου 2007.
- ↑ «War criminal 'took cyanide' in Hague court» (στα αγγλικά). BBC News. 2017-12-01. https://www.bbc.co.uk/news/world-europe-42204587. Ανακτήθηκε στις 2017-12-01.